3.2.2 物质的量在化学方程式计算中的应用-高一化学人教版必修第一册同步课件(共19张PPT)
文档属性
| 名称 | 3.2.2 物质的量在化学方程式计算中的应用-高一化学人教版必修第一册同步课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 299.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:42:43 | ||
图片预览






文档简介
(共19张PPT)
第
三
章
铁
金
属
材
料
第 二 节 金 属 材 料
物 质 的 量 在 化 学 方 程 式 计 算 中 的 应 用
教 学 目 标
核 心 素 养
1.掌握物质的量在化学方程式计算中的应用。
2.了解化学计算中常用的方法。
通过物质的量与其他物理量的联系以及化学计算中常用方法训练培养学生论据推理与模型认知的化学核心素养。
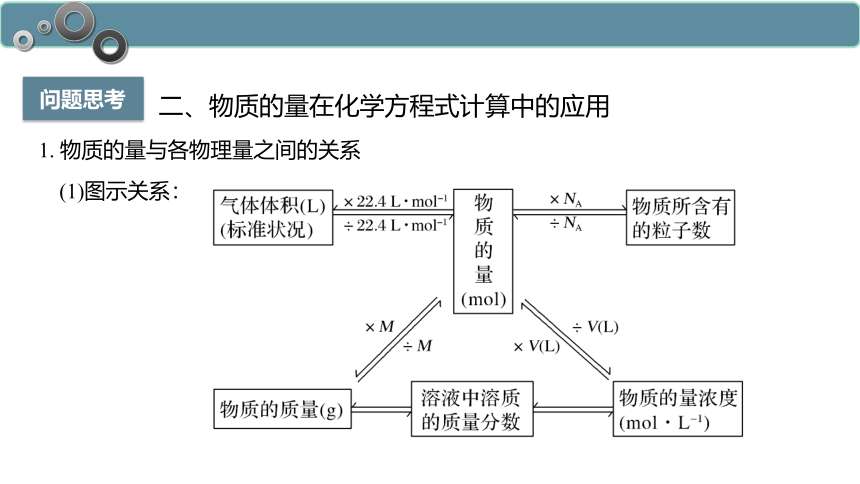
问题思考
1. 物质的量与各物理量之间的关系
(1)图示关系:
二、物质的量在化学方程式计算中的应用
问题思考
n(B)=c·V
m
M
①已知物质的质量:n(B)=
V
22.4L/mol
②已知标准状况时的气体体积:n(B)=
N
NA
③已知物质的粒子数:n(B)=
④已知溶液中的物质的量浓度:
(2)计算公式:
二、物质的量在化学方程式计算中的应用
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 ______∶______∶______∶______
物质的量之比 ______∶______∶______∶______
结论 各物质的化学计量数之比=_____________________________
=_____________________________
问题思考
2. 物质的量在化学方程式计算中的应用
2NA
2NA
2NA
NA
2 mol
2 mol
2 mol
1 mol
各物质的粒子数之比
各物质的物质的量之比
二、物质的量在化学方程式计算中的应用
自主思考
1. “化学反应前后质量是守恒的,那么物质的量也肯定守恒。”这种说法对吗?
4. 根据化学方程式计算,各物质对应的各物理量的单位左右、上下都必须相同吗?
2. 在相同的条件下,反应前后气体的体积不会发生改变,对吗?
3. 任何反应中溶液的质量都不会发生变化,对吗?
思考交流
250mL 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量。(2)生成H2的体积(标准状况)。
答:(1)参加反应的铁屑的物质的量为0.5mol。
(2)生成H2的体积在标准状况下为11.2L。
【解】参加反应的H2SO4的物质的量为:0.25×2mol/L=0.50mol
1
1
n(Fe)
0.50mol
=
Fe + H2SO4 === FeSO4 + H2↑
1 1
n(Fe) 0.50mol
n(Fe) = 0.50mol
22.4L
V(H2)
1mol
0.50mol
=
Fe + H2SO4 === FeSO4 + H2↑
1 22.4L
0.50mol V(H2)
V(H2) = 11.2L
点拔提升
1. 化学计算的基本步骤
写——写出相关的化学方程式
标——标出已知物质和所求物质有关物理量的关系,并代入已知量和未知量
列——列出比例式
解——根据比例式求解
答——简明地写出答案
二、物质的量在化学方程式计算中的应用
点拔提升
2. 物质的量应用于化学计算的基本方法
(1)把已知物的物理量转化为物质的量;
(2)根据化学方程式,利用已知物的物质的量求出未知物的物质的量;
(3)把未知物的物质的量转化为未知物的所求物理量。
二、物质的量在化学方程式计算中的应用
点拔提升
3. 有关物质的量的计算中的“三个规范”
(3)单位规范:
m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。
各种符号的书写要规范,大写字母与小写字母的意义各不相同。
(1)书写规范:
(2)符号规范:
①未知数可直接用各物理量的符号表示,且要注明物质(或粒子)的符号。
②各物理量及单位、物质的名称、公式等尽量用符号表示。
把已知量代入计算式中计算时都要带单位且单位要统一。
二、物质的量在化学方程式计算中的应用
习题解答
【经典好题1】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为( )
A、一定为1∶1 B、可能为2∶3
C、一定为3∶2 D、可能为1∶6
A
习题解答
【经典好题2】把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与的物质的量浓度之比为( )
A、1∶4 B、2∶7
C、1∶2 D、3∶8
A
习题解答
解:设原溶液中H2SO4和CuSO4的物质的量分别为x、y。
Fe + H2SO4===FeSO4+H2↑ Δm(固体质量减少)
56 g 1 mol 56 g
x 56x
Fe + CuSO4===FeSO4+Cu Δm(固体质量增加)
56 g 1 mol 64 g 8 g
y 8y
因为固体在反应前后质量相等,所以Δm(减)=Δm(增),56x=8y,
习题解答
【经典好题3】相同质量的Mg和Al分别与足量的盐酸反应,所生成的氢气在标准状况下的体积比是( )
解:设Mg和Al的质量均为m,根据Mg和Al与盐酸反应的化学方程式,可知Mg~H2、 2Al~3H2,则生成的氢气在标准状况下的体积之比为:
m
24
m
27
×
3
2
:
= 3∶4
A、2∶3 B、1∶1
C、3∶4 D、24∶27
C
习题解答
【经典好题4】一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比为( )
A、4:1 B、2:1
C、3:2 D、1:1
A
习题解答
【经典好题5】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A、0.1(b-2a)mol/L B、10( 2a-b ) mol/L
C、10(b-a )mol/L D、10( b-2a )mol/L
D
习题解答
【经典好题6】已知反应:3Cl2+8NH3=6NH4Cl+N2,在标准状况下有33.6L氯气参加反应,计算:
(1)参加反应的氨的物质的量是多少
(2)产生氮气的分子数是多少
(3)被氧化的NH3的物质的量是多少?
3Cl2 + 8NH3 = 6NH4Cl + N2
3 8 1
1.5mol n(NH3) n( N2 )
根据电子守恒可知:n(Cl2)×2 = n(被氧化NH3)×3
n(被氧化NH3)=1mol
解:参加反应的Cl2的物质的量: 33.6/22.4=1.5mol
n(NH3)=4mol
n( N2 ) =0.5mol
N( N2 ) =0.5NA
形成方法
化学计算中常用的方法
1. 关系式法:
把CO还原氧化铁生成的CO2通入澄清的石灰水中,计算生成的沉淀的量:
3CO ~ 3CO2 ~ 3CaCO3
即 CO ~ CaCO3
2. 守恒法:
(1)电子得失守恒
(2)电荷守恒
(3)元素(原子)守恒
3. 差量法:
根据反应前后物质的有关物理量的变化,找出所谓的“理论差量”,如反应前后的质量、物质的量、气体体积等。
本节内容结束
第
三
章
铁
金
属
材
料
第 二 节 金 属 材 料
物 质 的 量 在 化 学 方 程 式 计 算 中 的 应 用
教 学 目 标
核 心 素 养
1.掌握物质的量在化学方程式计算中的应用。
2.了解化学计算中常用的方法。
通过物质的量与其他物理量的联系以及化学计算中常用方法训练培养学生论据推理与模型认知的化学核心素养。
问题思考
1. 物质的量与各物理量之间的关系
(1)图示关系:
二、物质的量在化学方程式计算中的应用
问题思考
n(B)=c·V
m
M
①已知物质的质量:n(B)=
V
22.4L/mol
②已知标准状况时的气体体积:n(B)=
N
NA
③已知物质的粒子数:n(B)=
④已知溶液中的物质的量浓度:
(2)计算公式:
二、物质的量在化学方程式计算中的应用
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 ______∶______∶______∶______
物质的量之比 ______∶______∶______∶______
结论 各物质的化学计量数之比=_____________________________
=_____________________________
问题思考
2. 物质的量在化学方程式计算中的应用
2NA
2NA
2NA
NA
2 mol
2 mol
2 mol
1 mol
各物质的粒子数之比
各物质的物质的量之比
二、物质的量在化学方程式计算中的应用
自主思考
1. “化学反应前后质量是守恒的,那么物质的量也肯定守恒。”这种说法对吗?
4. 根据化学方程式计算,各物质对应的各物理量的单位左右、上下都必须相同吗?
2. 在相同的条件下,反应前后气体的体积不会发生改变,对吗?
3. 任何反应中溶液的质量都不会发生变化,对吗?
思考交流
250mL 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量。(2)生成H2的体积(标准状况)。
答:(1)参加反应的铁屑的物质的量为0.5mol。
(2)生成H2的体积在标准状况下为11.2L。
【解】参加反应的H2SO4的物质的量为:0.25×2mol/L=0.50mol
1
1
n(Fe)
0.50mol
=
Fe + H2SO4 === FeSO4 + H2↑
1 1
n(Fe) 0.50mol
n(Fe) = 0.50mol
22.4L
V(H2)
1mol
0.50mol
=
Fe + H2SO4 === FeSO4 + H2↑
1 22.4L
0.50mol V(H2)
V(H2) = 11.2L
点拔提升
1. 化学计算的基本步骤
写——写出相关的化学方程式
标——标出已知物质和所求物质有关物理量的关系,并代入已知量和未知量
列——列出比例式
解——根据比例式求解
答——简明地写出答案
二、物质的量在化学方程式计算中的应用
点拔提升
2. 物质的量应用于化学计算的基本方法
(1)把已知物的物理量转化为物质的量;
(2)根据化学方程式,利用已知物的物质的量求出未知物的物质的量;
(3)把未知物的物质的量转化为未知物的所求物理量。
二、物质的量在化学方程式计算中的应用
点拔提升
3. 有关物质的量的计算中的“三个规范”
(3)单位规范:
m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。
各种符号的书写要规范,大写字母与小写字母的意义各不相同。
(1)书写规范:
(2)符号规范:
①未知数可直接用各物理量的符号表示,且要注明物质(或粒子)的符号。
②各物理量及单位、物质的名称、公式等尽量用符号表示。
把已知量代入计算式中计算时都要带单位且单位要统一。
二、物质的量在化学方程式计算中的应用
习题解答
【经典好题1】取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为( )
A、一定为1∶1 B、可能为2∶3
C、一定为3∶2 D、可能为1∶6
A
习题解答
【经典好题2】把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与的物质的量浓度之比为( )
A、1∶4 B、2∶7
C、1∶2 D、3∶8
A
习题解答
解:设原溶液中H2SO4和CuSO4的物质的量分别为x、y。
Fe + H2SO4===FeSO4+H2↑ Δm(固体质量减少)
56 g 1 mol 56 g
x 56x
Fe + CuSO4===FeSO4+Cu Δm(固体质量增加)
56 g 1 mol 64 g 8 g
y 8y
因为固体在反应前后质量相等,所以Δm(减)=Δm(增),56x=8y,
习题解答
【经典好题3】相同质量的Mg和Al分别与足量的盐酸反应,所生成的氢气在标准状况下的体积比是( )
解:设Mg和Al的质量均为m,根据Mg和Al与盐酸反应的化学方程式,可知Mg~H2、 2Al~3H2,则生成的氢气在标准状况下的体积之比为:
m
24
m
27
×
3
2
:
= 3∶4
A、2∶3 B、1∶1
C、3∶4 D、24∶27
C
习题解答
【经典好题4】一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比为( )
A、4:1 B、2:1
C、3:2 D、1:1
A
习题解答
【经典好题5】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A、0.1(b-2a)mol/L B、10( 2a-b ) mol/L
C、10(b-a )mol/L D、10( b-2a )mol/L
D
习题解答
【经典好题6】已知反应:3Cl2+8NH3=6NH4Cl+N2,在标准状况下有33.6L氯气参加反应,计算:
(1)参加反应的氨的物质的量是多少
(2)产生氮气的分子数是多少
(3)被氧化的NH3的物质的量是多少?
3Cl2 + 8NH3 = 6NH4Cl + N2
3 8 1
1.5mol n(NH3) n( N2 )
根据电子守恒可知:n(Cl2)×2 = n(被氧化NH3)×3
n(被氧化NH3)=1mol
解:参加反应的Cl2的物质的量: 33.6/22.4=1.5mol
n(NH3)=4mol
n( N2 ) =0.5mol
N( N2 ) =0.5NA
形成方法
化学计算中常用的方法
1. 关系式法:
把CO还原氧化铁生成的CO2通入澄清的石灰水中,计算生成的沉淀的量:
3CO ~ 3CO2 ~ 3CaCO3
即 CO ~ CaCO3
2. 守恒法:
(1)电子得失守恒
(2)电荷守恒
(3)元素(原子)守恒
3. 差量法:
根据反应前后物质的有关物理量的变化,找出所谓的“理论差量”,如反应前后的质量、物质的量、气体体积等。
本节内容结束
