4.1.1 原子结构-高一化学人教版必修第一册同步课件(共31张PPT)
文档属性
| 名称 | 4.1.1 原子结构-高一化学人教版必修第一册同步课件(共31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:43:37 | ||
图片预览







文档简介
(共31张PPT)
第 一 节 原子结构与元素周期表
第 1课时 原子结构
第四章 物质结构 元素周期律
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解原子的结构模型演变的过程,知道原子的结构。
2.理解质量数的含义,质量数与质子数、中子数之间的关系及其相关的简单计算。
3.了解原子核外电子的排布规律。
通过原子结构的学习培养学生宏观辨识与微观探析的化学核心素养;通过学习原子结构相关问题的解决培养学生论据推理与模型认知的化学核心素养。
科学史话
道尔顿模型(1803年):原子是构成物质的基本粒子,它们是坚实的、不可再分的实心球。
道尔顿模型
科学史话
汤姆孙原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子。
汤姆孙原子模型
科学史话
卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
卢瑟福原子模型
科学史话
玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速圆周运动。
玻尔原子模型
科学史话
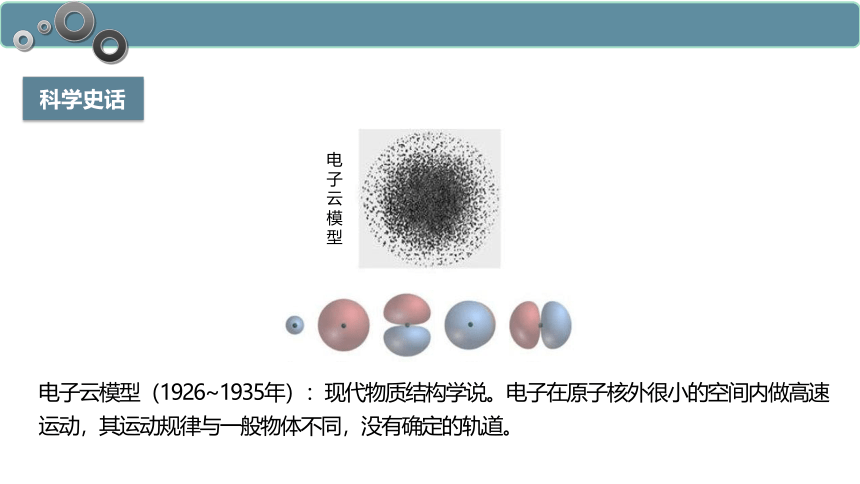
电子云模型(1926~1935年):现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
电子云模型
科学史话
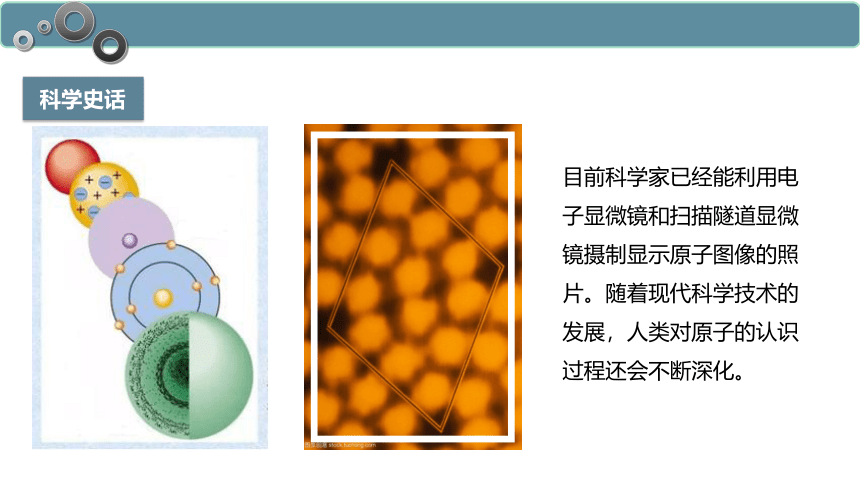
目前科学家已经能利用电子显微镜和扫描隧道显微镜摄制显示原子图像的照片。随着现代科学技术的发展,人类对原子的认识过程还会不断深化。
认识新知
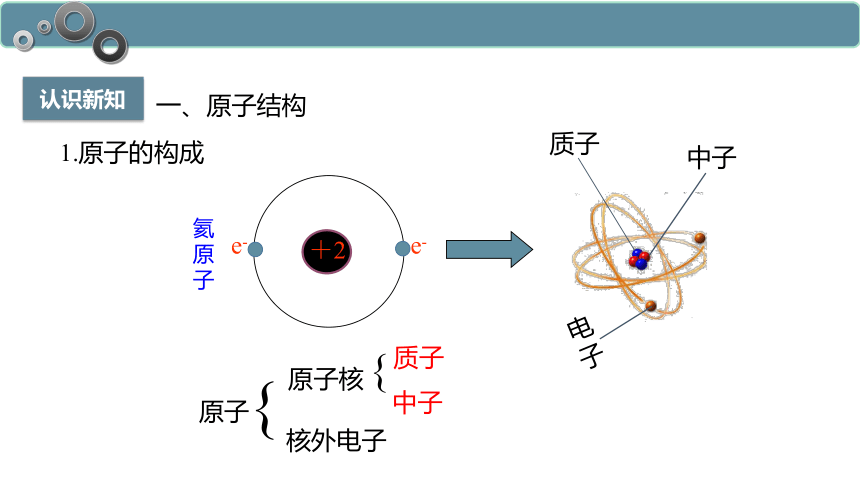
1.原子的构成
氦原子
质子
电子
中子
原子
原子核
核外电子
质子
中子
{
{
一、原子结构
2
+2
e-
e-
认识新知
一、原子结构
原子结构
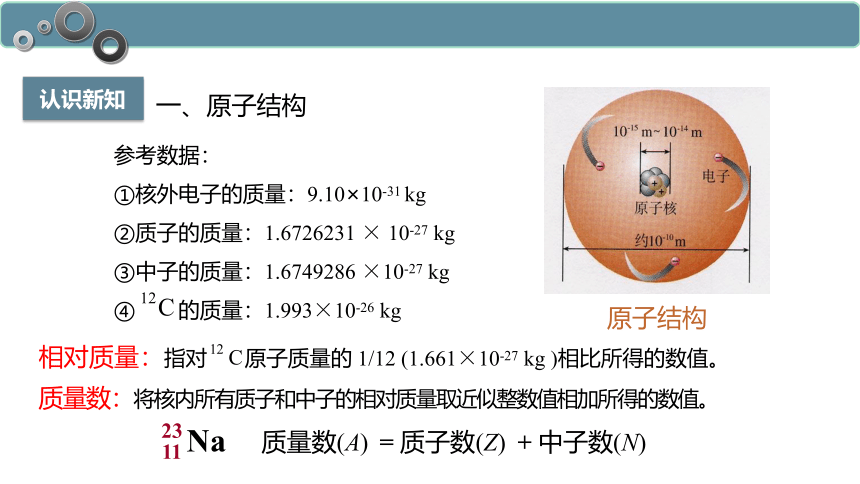
参考数据:
①核外电子的质量:9.10×10-31 kg
②质子的质量:1.6726231 × 10-27 kg
③中子的质量:1.6749286 ×10-27 kg
④ 的质量:1.993×10-26 kg
C
12
质量数:将核内所有质子和中子的相对质量取近似整数值相加所得的数值。
相对质量:指对 原子质量的 1/12 (1.661×10-27 kg )相比所得的数值。
C
12
Na
11
23
质量数(A)
= 质子数(Z)
+ 中子数(N)
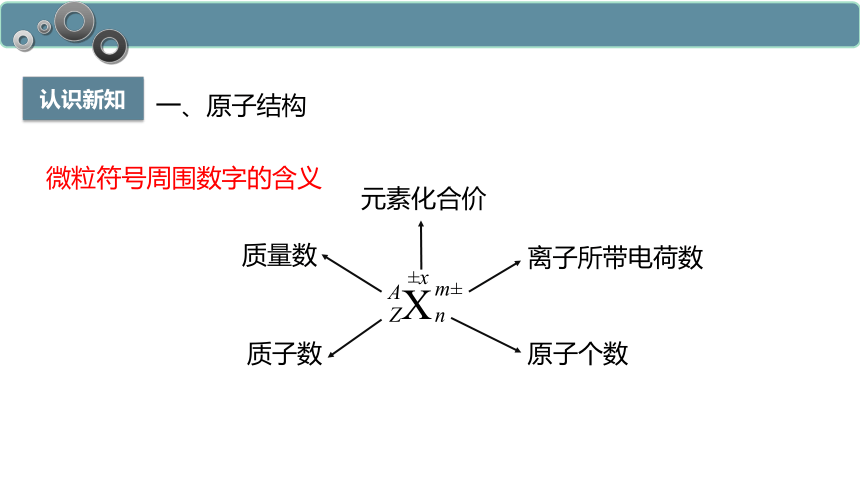
微粒符号周围数字的含义
认识新知
一、原子结构
X
A
Z
n
m±
±x
质量数
质子数
离子所带电荷数
原子个数
元素化合价
自主思考
根据所给的一些数据总结电子运动的特征:
①炮弹的速度2km/s,人造卫星的速度7.8 km/s,宇宙飞船的
速度11 km/s,氢核外电子的速度2.2×108m/s;
②乒乓球半径:4×10-2m;原子半径:约10-10m。
一、原子结构
思考1:
思考2:
电子的运动特征:
电子质量小;运动空间小;运动速度快。
电子在原子核外是如何运动的?
电子绕核运动有没有什么规律呢?
深度思考
2. 电子层
(2)电子层:在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,称作电子层。
一、原子结构
N
M
L
K
原子核
(1)电子的能量:在多电子原子中,电子的能量不同;在离核近的区域内运动的电子的能量较低,在离核远的区域内运动的电子的能量较高。
认识新知
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由 到___
能量高低 由 到___
(3)不同电子层的表示及能量关系
近
远
低
高
一、原子结构
2. 电子层
思考讨论
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
思考讨论
1. 当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
3. 你能归纳出第n层最多能容纳的电子数吗?
2. 次外层最多容纳的电子数是多少?
4. 根据归纳的规律,用原子结构示意图表示核电荷数为1~20号元素原子的核外电子排布。
请思考并讨论下列问题。
旧知对比
1
+1
H
2
+2
He
2
+3
1
Li
2
+4
2
Be
3
2
+5
B
4
2
+6
C
2
+7
5
N
+8
2
6
O
7
2
+9
F
2
+10
8
Ne
1
2
+11
8
Na
2
2
+12
8
Mg
旧知对比
2
+14
8
4
Si
2
+13
8
Al
3
2
+15
8
P
5
2
+16
8
S
6
2
+17
8
Cl
7
2
+18
8
Ar
8
核电荷数为13~18的元素的原子结构示意图
总结提升
(1)能量最低原理:
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①原子核外第n层最多容纳的电子数为2n2。如K、L、M、N层最多容纳电子数分别为2、8、18、32。
②最外层电子数最多只有8个(K层只有2个)。
③次外层电子数不超过18个。
3. 原子核外电子排布的一般规律:
一、原子结构
特别提示
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:
(1)核外电子排布的规律是相互联系的,不能孤立地理解。如:当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
3. 原子核外电子排布的一般规律:
一、原子结构
注意:
知识巩固
1. 下面关于多电子原子的核外电子运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③ C.①③ D.②④
√
知识巩固
2. 下列说法中一定错误的是( )
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某原子的核电荷数与最外层电子数相等
√
形成方法
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(1)原子结构示意图
1.微粒核外电子排布的表示方法
一、原子结构
形成方法
②非金属元素的原子得电子形成简单离子时,形成与同周期的稀有气体元素原子相同的电子层结构。
(2)离子结构示意图
①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构。
一、原子结构
(1)最外层电子数与次外层电子数相等的原子有 ;最外层电子数是次外层电子数2倍、3倍、4倍的原子分别是 。
(2)次外层电子数是最外层电子数2倍的原子有 。
(3)内层电子总数是最外层电子数2倍的原子有 。
(4)电子层数与最外层电子数相等的原子有 ;电子层数是最外层电子数2倍的原子是 。
(5)最外层电子数是电子层数2倍的原子有 ;最外层电子数是电子层数3倍的原子是 。
Be、Ar
C、O、Ne
Li、Si
Li、P
H、Be、Al
Li
He、C、S
O
形成方法
2.结构特殊的原子
一、原子结构
形成方法
(1)“10电子”粒子
①一核10电子:Ne、N3-、O2-、F-、
Na+、Mg2+、Al3+
②二核10电子:HF、OH-
③三核10电子:H2O、
④四核10电子:NH3、H3O+
⑤五核10电子:CH4、
(2)“18电子”粒子
①分子:Ar、HCl、H2S、PH3、SiH4、
F2、H2O2、N2H4
②阳离子:K+、Ca2+
③阴离子:P3-、S2-、HS-、Cl-
3.等电子粒子
一、原子结构
知识巩固
3. 下列微粒结构示意图中,不正确的是( )
√
知识巩固
4. 与OH-具有相同质子数和电子数的粒子是( )
A. H2O B. F-
C. Na+ D. NH3
√
知识巩固
5. 下列叙述中,正确的是( )
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两原子一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
√
形成方法
1. 原子的结构
2. 分层的排布
3. 排布的规律
3.1 能量由低到高
3.2 每层最多容纳电子数目是2n2
3.3 最外层电子数目不超过8个,K层为最外层时不超过2个
本节内容结束
第 一 节 原子结构与元素周期表
第 1课时 原子结构
第四章 物质结构 元素周期律
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解原子的结构模型演变的过程,知道原子的结构。
2.理解质量数的含义,质量数与质子数、中子数之间的关系及其相关的简单计算。
3.了解原子核外电子的排布规律。
通过原子结构的学习培养学生宏观辨识与微观探析的化学核心素养;通过学习原子结构相关问题的解决培养学生论据推理与模型认知的化学核心素养。
科学史话
道尔顿模型(1803年):原子是构成物质的基本粒子,它们是坚实的、不可再分的实心球。
道尔顿模型
科学史话
汤姆孙原子模型(1904年):原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成中性原子。
汤姆孙原子模型
科学史话
卢瑟福原子模型(1911年):在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
卢瑟福原子模型
科学史话
玻尔原子模型(1913年):电子在原子核外空间的一定轨道上绕核做高速圆周运动。
玻尔原子模型
科学史话
电子云模型(1926~1935年):现代物质结构学说。电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
电子云模型
科学史话
目前科学家已经能利用电子显微镜和扫描隧道显微镜摄制显示原子图像的照片。随着现代科学技术的发展,人类对原子的认识过程还会不断深化。
认识新知
1.原子的构成
氦原子
质子
电子
中子
原子
原子核
核外电子
质子
中子
{
{
一、原子结构
2
+2
e-
e-
认识新知
一、原子结构
原子结构
参考数据:
①核外电子的质量:9.10×10-31 kg
②质子的质量:1.6726231 × 10-27 kg
③中子的质量:1.6749286 ×10-27 kg
④ 的质量:1.993×10-26 kg
C
12
质量数:将核内所有质子和中子的相对质量取近似整数值相加所得的数值。
相对质量:指对 原子质量的 1/12 (1.661×10-27 kg )相比所得的数值。
C
12
Na
11
23
质量数(A)
= 质子数(Z)
+ 中子数(N)
微粒符号周围数字的含义
认识新知
一、原子结构
X
A
Z
n
m±
±x
质量数
质子数
离子所带电荷数
原子个数
元素化合价
自主思考
根据所给的一些数据总结电子运动的特征:
①炮弹的速度2km/s,人造卫星的速度7.8 km/s,宇宙飞船的
速度11 km/s,氢核外电子的速度2.2×108m/s;
②乒乓球半径:4×10-2m;原子半径:约10-10m。
一、原子结构
思考1:
思考2:
电子的运动特征:
电子质量小;运动空间小;运动速度快。
电子在原子核外是如何运动的?
电子绕核运动有没有什么规律呢?
深度思考
2. 电子层
(2)电子层:在含有多个电子的原子里,电子分别在能量不同的区域内运动。把不同的区域简化为不连续的壳层,称作电子层。
一、原子结构
N
M
L
K
原子核
(1)电子的能量:在多电子原子中,电子的能量不同;在离核近的区域内运动的电子的能量较低,在离核远的区域内运动的电子的能量较高。
认识新知
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由 到___
能量高低 由 到___
(3)不同电子层的表示及能量关系
近
远
低
高
一、原子结构
2. 电子层
思考讨论
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
下表是稀有气体元素原子的电子层排布,从中你能发现什么规律?
思考讨论
1. 当K层为最外层时,最多能容纳的电子数是多少?除了K层,其他各层为最外层时,最多能容纳的电子数是多少?
3. 你能归纳出第n层最多能容纳的电子数吗?
2. 次外层最多容纳的电子数是多少?
4. 根据归纳的规律,用原子结构示意图表示核电荷数为1~20号元素原子的核外电子排布。
请思考并讨论下列问题。
旧知对比
1
+1
H
2
+2
He
2
+3
1
Li
2
+4
2
Be
3
2
+5
B
4
2
+6
C
2
+7
5
N
+8
2
6
O
7
2
+9
F
2
+10
8
Ne
1
2
+11
8
Na
2
2
+12
8
Mg
旧知对比
2
+14
8
4
Si
2
+13
8
Al
3
2
+15
8
P
5
2
+16
8
S
6
2
+17
8
Cl
7
2
+18
8
Ar
8
核电荷数为13~18的元素的原子结构示意图
总结提升
(1)能量最低原理:
核外电子总是优先排布在能量最低的电子层里,然后再由里往外排布在能量逐步升高的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①原子核外第n层最多容纳的电子数为2n2。如K、L、M、N层最多容纳电子数分别为2、8、18、32。
②最外层电子数最多只有8个(K层只有2个)。
③次外层电子数不超过18个。
3. 原子核外电子排布的一般规律:
一、原子结构
特别提示
(2)电子不一定排满M层才排N层,如K和Ca的核外电子排布情况分别为:
(1)核外电子排布的规律是相互联系的,不能孤立地理解。如:当M层不是最外层时,最多可以排布18个电子,而当它是最外层时,最多可以排布8个电子。
3. 原子核外电子排布的一般规律:
一、原子结构
注意:
知识巩固
1. 下面关于多电子原子的核外电子运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③ C.①③ D.②④
√
知识巩固
2. 下列说法中一定错误的是( )
A.某原子K层上只有一个电子
B.某原子M层上电子数为L层上电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某原子的核电荷数与最外层电子数相等
√
形成方法
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
(1)原子结构示意图
1.微粒核外电子排布的表示方法
一、原子结构
形成方法
②非金属元素的原子得电子形成简单离子时,形成与同周期的稀有气体元素原子相同的电子层结构。
(2)离子结构示意图
①当主族中的金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构。
一、原子结构
(1)最外层电子数与次外层电子数相等的原子有 ;最外层电子数是次外层电子数2倍、3倍、4倍的原子分别是 。
(2)次外层电子数是最外层电子数2倍的原子有 。
(3)内层电子总数是最外层电子数2倍的原子有 。
(4)电子层数与最外层电子数相等的原子有 ;电子层数是最外层电子数2倍的原子是 。
(5)最外层电子数是电子层数2倍的原子有 ;最外层电子数是电子层数3倍的原子是 。
Be、Ar
C、O、Ne
Li、Si
Li、P
H、Be、Al
Li
He、C、S
O
形成方法
2.结构特殊的原子
一、原子结构
形成方法
(1)“10电子”粒子
①一核10电子:Ne、N3-、O2-、F-、
Na+、Mg2+、Al3+
②二核10电子:HF、OH-
③三核10电子:H2O、
④四核10电子:NH3、H3O+
⑤五核10电子:CH4、
(2)“18电子”粒子
①分子:Ar、HCl、H2S、PH3、SiH4、
F2、H2O2、N2H4
②阳离子:K+、Ca2+
③阴离子:P3-、S2-、HS-、Cl-
3.等电子粒子
一、原子结构
知识巩固
3. 下列微粒结构示意图中,不正确的是( )
√
知识巩固
4. 与OH-具有相同质子数和电子数的粒子是( )
A. H2O B. F-
C. Na+ D. NH3
√
知识巩固
5. 下列叙述中,正确的是( )
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两原子一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
√
形成方法
1. 原子的结构
2. 分层的排布
3. 排布的规律
3.1 能量由低到高
3.2 每层最多容纳电子数目是2n2
3.3 最外层电子数目不超过8个,K层为最外层时不超过2个
本节内容结束
