4.1.3 核素-高一化学人教版必修第一册同步课件(共22张PPT)
文档属性
| 名称 | 4.1.3 核素-高一化学人教版必修第一册同步课件(共22张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:46:27 | ||
图片预览









文档简介
(共22张PPT)
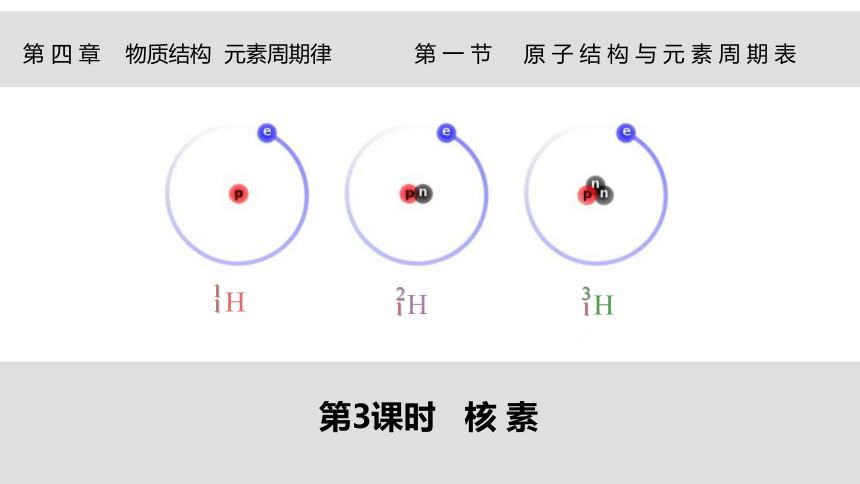
第3课时 核 素
第 四 章 物质结构 元素周期律
1
H
1
1
H
2
1
H
3
第 一 节 原 子 结 构 与 元 素 周 期 表
教 学 目 标
核 心 素 养
1.掌握核素、同位素的概念,了解元素、核素、同位素之间的区别和联系。
2.了解相对原子质量的概念及简单计算。
通过学习核素及相关概念培养学生宏观辨识与微观探析的化学核心素养;利用相关概念解决相关问题,培养学生论据推理与模型认知的化学核心素养。
问题思考
北京王府井古人类文化遗址博物馆向世人展示“北京人”狩猎、烧火、制造工具的痕迹。博物馆300多平方米的展厅里,将陈列在原址发掘出土的石砧、石锤、石片,还有原始牛、斑鹿、鸵鸟、鱼类等古生物的骨骼及古人类制成的骨铲、骨片等工具,再现25000年前斑鹿跳跃、鸵鸟欢腾、望山听水、野猪生息的景象。那么“25000年”是怎样测出来的呢?
通过测定——碳-14(14C)原子的数量进行推断
科技考古研究人员
化学与职业
科技考古研究人员
1946年,美国芝加哥大学教授利比发明了14C断代法,即利用死亡生物中14C不断衰变的原理对文物进行年代测定,使考古学家由此可以判断各种史前文物的绝对年代,因此获得1960年诺贝尔化学奖。
当今,考古工作者正是利用14C衰变测定装置,对文物进行年代测定和研究。此外,考古研究中还利用13C和15N的测定,分析古代人类的食物结构,这对于研究当时的自然环境状况、社会生产力发展及社会文化风俗等具有重要参考价值。
问题思考
H
1
1
2
3
氢
1.0079
【比较】三种原子结构的异同。
【质疑】它们是不是同一种元素?
【思考交流】在周期表中118种元素,是不是就只有118种原子呢?
自主思考
氢
1
H
1
氕
氘
氚
H
D
T
重氢
超重氢
同种元素的原子:质子数相同,但中子数不一定相同,如氢元素有三种原子:
1
H
2
1
H
3
点拔提升
核素
同种元素:原子的原子核中质子数________。
同种元素:原子的原子核中中子数可以 _________。
同种元素:
可以有 ______ 种不同原子。
相同
不相同
几
如:
C
12
6
1. 具有一定数目质子和一定数目中子的一种原子叫核素。
C
13
6
C
14
6
点拔提升
两同:
两不同:
质子数相同、元素相同
中子数不同、原子不同
(1)“两同”“两不同”:
2. 质子数相同而中子数不同的同一元素的不同原子互称为同位素。
核素
点拔提升
氘和氚是制造氢弹的材料
铀-235 是制造原子弹的材料和核反应堆的燃料
碳-12 作为原子量及阿伏加德罗常数的标准;碳-14 在考古学中测定生物死亡年代。
(2)同位素的实例及用途:
氢有三种同位素:
H
1
1
H
2
1
H
3
1
铀有三种同位素:
U
234
92
U
235
92
U
238
92
C
12
6
C
13
6
C
14
6
碳有三种同位素:
核素
点拨提升
②化学性质几乎完全相同,物理性质略有差别
H2 和D2 是两种不同的单质,化学性质基本相同。
H2O 和 D2O 是两种不同的化合物,化学性质基本相同。
③天然存在的同位素,相互间保持固定的比率
④绝大多数元素具有同位素,原子种类远大于元素种类
(3)同位素的特点:
①同位素在周期表里占据同一位置
核素
难点透析
1. 原子的相对原子质量
元素的相对原子质量
2. 原子的近似相对原子质量
=
原子的质量数
12
6C
一个 的真实质量为: 2.657×10 26kg, 的质量为1.993×10 26kg
16
8O
16
相对原子质量为:
8O
Mr =
核素的质量
质量的
12
6C
1
12
2.657×10 26kg
1.993×10 26kg
1
12
×
=16
16
近似相对原子质量为:
8O
16
难点透析
按照该元素各种核素所占的一定百分比乘以各核素的质量数计算出来的平均值:
Mr = A1×a1%+A2×a2%+ ···
4. 元素的近似相对原子质量:
按照该元素各种核素所占的一定百分比计算出来的平均值:
Mr = Mr1×a1%+Mr2×a2%+ ···
3. 元素的相对原子质量
元素的相对原子质量
难点透析
同位素 同位素的相对原子质量(Mr) 丰度(ai)
34.969 75.77%
36.966 24.23%
M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453
元素的相对原子质量 =
核素相对原子质量和丰度的平均值
35×75% + 37×25% = 35.5
元素的近似相对原子质量 =
核素质量数和丰度的平均值
= A1×a1 + A2×a2
元素的相对原子质量
知识辨析
核素1
核素 n
互称同位素
元 素
……
(1)元素的种类由质子数决定,与中子数、核外电子数无关;
(2)同一种元素,可有若干种不同的核素;
(3)核素种类由质子数和中子数共同决定,与核外电子数无关;
(4)元素和核素只能论种类,不能论个数;而原子既论种类,又能论个数;
(5)同位素是同一元素不同核素之间的互称,不指具体的原子。
方法规律
若两种微粒含有的质子数与核外电子数分别相同,则两种微粒一定带有相同电荷:
——质子数与核外电子数相同的微粒
(4)两种阴离子:
(1)两种核素:
(2)两种分子:
(3)两种阳离子:
16O和18O
H2O和NH3
和Na+
OH-和F-
方法规律
O
8
16
2
2-
- 2
离子电荷
原子个数
质量数
质子数
化合价
数字的位置不同,表示的意义不同
知识巩固
1. 在① Li、② N、③ Na、④ Mg、⑤ Li、⑥ C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,不是同一种元素。
①
⑤
②
⑥
③
④
2. 32S与33S互为同位素,下列说法正确的是( )
知识巩固
D
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
32S与33S互为同位素,质子数为16,中子数分别为16、17。
核外电子数=质子数
核外电子数=质子数=16,最外层电子数为6
×
×
×
知识巩固
3. 下列说法中正确的是( )
A.质子数相同的微粒一定属于同一种元素
B.质子数相同,电子数也相同的两种微粒,不可能是一种原子和一种离子
C.原子核内的质子数一定等于中子数
D.电子数相同的微粒一定是同一种元素
B
Ne与NH3
原子:质子数=电子数
原子中质子数=电子数,但不一定和中子数相等
10 电子微粒中Na+、Mg2+ 等
×
×
×
√
离子:质子数 ≠ 电子数
知识巩固
4. 重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 氘(D) 原子核外有1个电子
B. 1H与D互称同位素
C. H2O与D2O互称同素异形体
D. 1H218O与D216O的相对分子质量相同
1H
2
√
√
必须是单质
×
1×2+18=20
2×2+16=20
√
C
知识巩固
5. 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
质子数
X
A
(A-N)
氢化物摩尔质量 = m + A
氢化物质子数 = m + (A-N)
A
Hm
AX
本节内容结束
第3课时 核 素
第 四 章 物质结构 元素周期律
1
H
1
1
H
2
1
H
3
第 一 节 原 子 结 构 与 元 素 周 期 表
教 学 目 标
核 心 素 养
1.掌握核素、同位素的概念,了解元素、核素、同位素之间的区别和联系。
2.了解相对原子质量的概念及简单计算。
通过学习核素及相关概念培养学生宏观辨识与微观探析的化学核心素养;利用相关概念解决相关问题,培养学生论据推理与模型认知的化学核心素养。
问题思考
北京王府井古人类文化遗址博物馆向世人展示“北京人”狩猎、烧火、制造工具的痕迹。博物馆300多平方米的展厅里,将陈列在原址发掘出土的石砧、石锤、石片,还有原始牛、斑鹿、鸵鸟、鱼类等古生物的骨骼及古人类制成的骨铲、骨片等工具,再现25000年前斑鹿跳跃、鸵鸟欢腾、望山听水、野猪生息的景象。那么“25000年”是怎样测出来的呢?
通过测定——碳-14(14C)原子的数量进行推断
科技考古研究人员
化学与职业
科技考古研究人员
1946年,美国芝加哥大学教授利比发明了14C断代法,即利用死亡生物中14C不断衰变的原理对文物进行年代测定,使考古学家由此可以判断各种史前文物的绝对年代,因此获得1960年诺贝尔化学奖。
当今,考古工作者正是利用14C衰变测定装置,对文物进行年代测定和研究。此外,考古研究中还利用13C和15N的测定,分析古代人类的食物结构,这对于研究当时的自然环境状况、社会生产力发展及社会文化风俗等具有重要参考价值。
问题思考
H
1
1
2
3
氢
1.0079
【比较】三种原子结构的异同。
【质疑】它们是不是同一种元素?
【思考交流】在周期表中118种元素,是不是就只有118种原子呢?
自主思考
氢
1
H
1
氕
氘
氚
H
D
T
重氢
超重氢
同种元素的原子:质子数相同,但中子数不一定相同,如氢元素有三种原子:
1
H
2
1
H
3
点拔提升
核素
同种元素:原子的原子核中质子数________。
同种元素:原子的原子核中中子数可以 _________。
同种元素:
可以有 ______ 种不同原子。
相同
不相同
几
如:
C
12
6
1. 具有一定数目质子和一定数目中子的一种原子叫核素。
C
13
6
C
14
6
点拔提升
两同:
两不同:
质子数相同、元素相同
中子数不同、原子不同
(1)“两同”“两不同”:
2. 质子数相同而中子数不同的同一元素的不同原子互称为同位素。
核素
点拔提升
氘和氚是制造氢弹的材料
铀-235 是制造原子弹的材料和核反应堆的燃料
碳-12 作为原子量及阿伏加德罗常数的标准;碳-14 在考古学中测定生物死亡年代。
(2)同位素的实例及用途:
氢有三种同位素:
H
1
1
H
2
1
H
3
1
铀有三种同位素:
U
234
92
U
235
92
U
238
92
C
12
6
C
13
6
C
14
6
碳有三种同位素:
核素
点拨提升
②化学性质几乎完全相同,物理性质略有差别
H2 和D2 是两种不同的单质,化学性质基本相同。
H2O 和 D2O 是两种不同的化合物,化学性质基本相同。
③天然存在的同位素,相互间保持固定的比率
④绝大多数元素具有同位素,原子种类远大于元素种类
(3)同位素的特点:
①同位素在周期表里占据同一位置
核素
难点透析
1. 原子的相对原子质量
元素的相对原子质量
2. 原子的近似相对原子质量
=
原子的质量数
12
6C
一个 的真实质量为: 2.657×10 26kg, 的质量为1.993×10 26kg
16
8O
16
相对原子质量为:
8O
Mr =
核素的质量
质量的
12
6C
1
12
2.657×10 26kg
1.993×10 26kg
1
12
×
=16
16
近似相对原子质量为:
8O
16
难点透析
按照该元素各种核素所占的一定百分比乘以各核素的质量数计算出来的平均值:
Mr = A1×a1%+A2×a2%+ ···
4. 元素的近似相对原子质量:
按照该元素各种核素所占的一定百分比计算出来的平均值:
Mr = Mr1×a1%+Mr2×a2%+ ···
3. 元素的相对原子质量
元素的相对原子质量
难点透析
同位素 同位素的相对原子质量(Mr) 丰度(ai)
34.969 75.77%
36.966 24.23%
M1×a1 + M2×a2
= 34.969×75.77% + 36.966×24.23% = 35.453
元素的相对原子质量 =
核素相对原子质量和丰度的平均值
35×75% + 37×25% = 35.5
元素的近似相对原子质量 =
核素质量数和丰度的平均值
= A1×a1 + A2×a2
元素的相对原子质量
知识辨析
核素1
核素 n
互称同位素
元 素
……
(1)元素的种类由质子数决定,与中子数、核外电子数无关;
(2)同一种元素,可有若干种不同的核素;
(3)核素种类由质子数和中子数共同决定,与核外电子数无关;
(4)元素和核素只能论种类,不能论个数;而原子既论种类,又能论个数;
(5)同位素是同一元素不同核素之间的互称,不指具体的原子。
方法规律
若两种微粒含有的质子数与核外电子数分别相同,则两种微粒一定带有相同电荷:
——质子数与核外电子数相同的微粒
(4)两种阴离子:
(1)两种核素:
(2)两种分子:
(3)两种阳离子:
16O和18O
H2O和NH3
和Na+
OH-和F-
方法规律
O
8
16
2
2-
- 2
离子电荷
原子个数
质量数
质子数
化合价
数字的位置不同,表示的意义不同
知识巩固
1. 在① Li、② N、③ Na、④ Mg、⑤ Li、⑥ C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,不是同一种元素。
①
⑤
②
⑥
③
④
2. 32S与33S互为同位素,下列说法正确的是( )
知识巩固
D
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
32S与33S互为同位素,质子数为16,中子数分别为16、17。
核外电子数=质子数
核外电子数=质子数=16,最外层电子数为6
×
×
×
知识巩固
3. 下列说法中正确的是( )
A.质子数相同的微粒一定属于同一种元素
B.质子数相同,电子数也相同的两种微粒,不可能是一种原子和一种离子
C.原子核内的质子数一定等于中子数
D.电子数相同的微粒一定是同一种元素
B
Ne与NH3
原子:质子数=电子数
原子中质子数=电子数,但不一定和中子数相等
10 电子微粒中Na+、Mg2+ 等
×
×
×
√
离子:质子数 ≠ 电子数
知识巩固
4. 重水(D2O)是重要的核工业原料,下列说法错误的是( )
A. 氘(D) 原子核外有1个电子
B. 1H与D互称同位素
C. H2O与D2O互称同素异形体
D. 1H218O与D216O的相对分子质量相同
1H
2
√
√
必须是单质
×
1×2+18=20
2×2+16=20
√
C
知识巩固
5. 某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是( )
质子数
X
A
(A-N)
氢化物摩尔质量 = m + A
氢化物质子数 = m + (A-N)
A
Hm
AX
本节内容结束
