3.1.2 铁的重要化合物-高一化学人教版必修第一册同步课件(共18张PPT)
文档属性
| 名称 | 3.1.2 铁的重要化合物-高一化学人教版必修第一册同步课件(共18张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 25.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:48:09 | ||
图片预览




文档简介
(共18张PPT)
第
三
章
铁
金
属
材
料
第一 节 铁 及 其 化 合 物
铁 的 重 要 化 合 物
教 学 目 标
核 心 素 养
1.了解铁的重要化合物的主要性质及应用。
2.掌握Fe2+、Fe3+的检验方法及其相互转化。
3.了解Fe(OH)2、Fe(OH)3的制备方法。
通过铁的化合物的学习培养学生能够从物质类别和元素价态预测物质的性质,并能设计物质间的转化,培养学生论据推理与模型认知、科学探究与创新意识的化学核心素养。
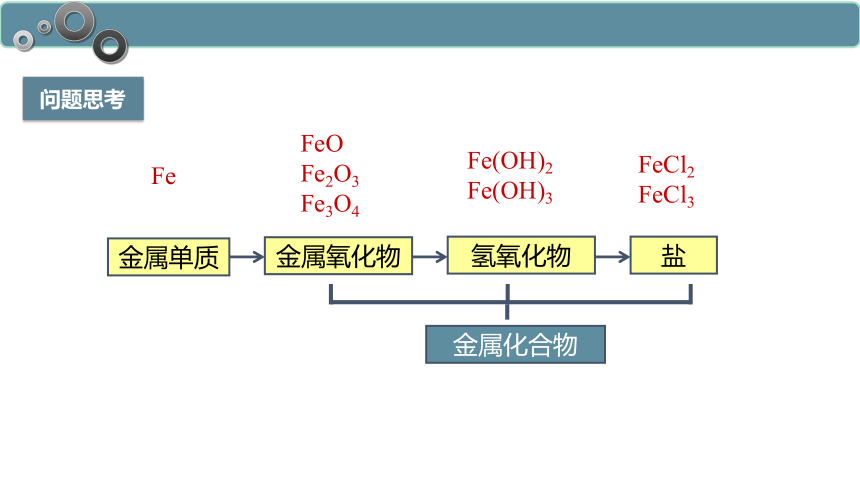
问题思考
金属单质
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
FeCl2
FeCl3
金属化合物
金属氧化物
氢氧化物
盐
资料卡片
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
褐铁矿(Fe2O3·nH2O )
黄铁矿(FeS2 )
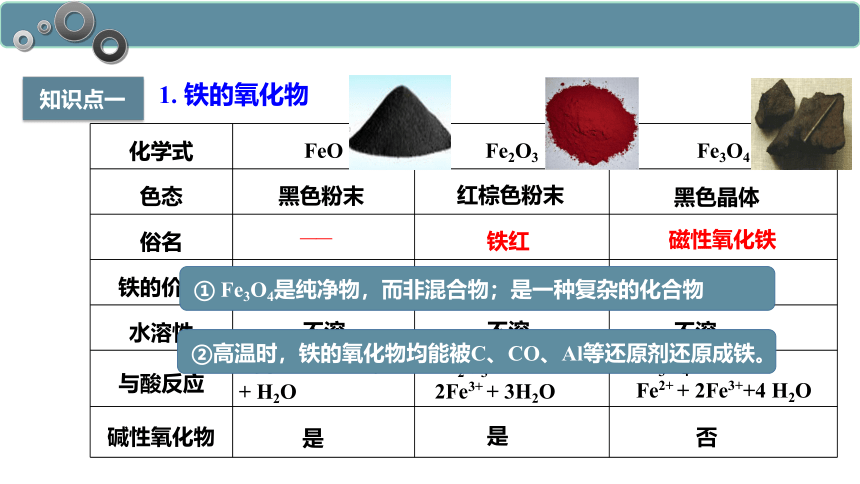
知识点一
化学式 FeO Fe2O3 Fe3O4
色态
俗名
铁的价态
水溶性
与酸反应
碱性氧化物
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
不溶
不溶
不溶
FeO + 2H+ = Fe2+
+ H2O
Fe2O3 + 6H+ =
2Fe3+ + 3H2O
Fe3O4 + 8H+=
Fe2+ + 2Fe3++4 H2O
是
是
否
① Fe3O4是纯净物,而非混合物;是一种复杂的化合物
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
1. 铁的氧化物
知识点二
2. 铁的氢氧化物
氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2
Fe3++3OH-=Fe(OH)3↓
红褐色
难溶于水
Fe(OH)3+3H+=Fe3++3H2O
Fe2++2OH-=Fe(OH)2↓(隔绝空气)
白色
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
白色 灰绿色 红褐色
2Fe(OH)3==Fe2O3+3H2O
受热易分解
稳定性
与盐酸反应
制法
颜色
溶解性
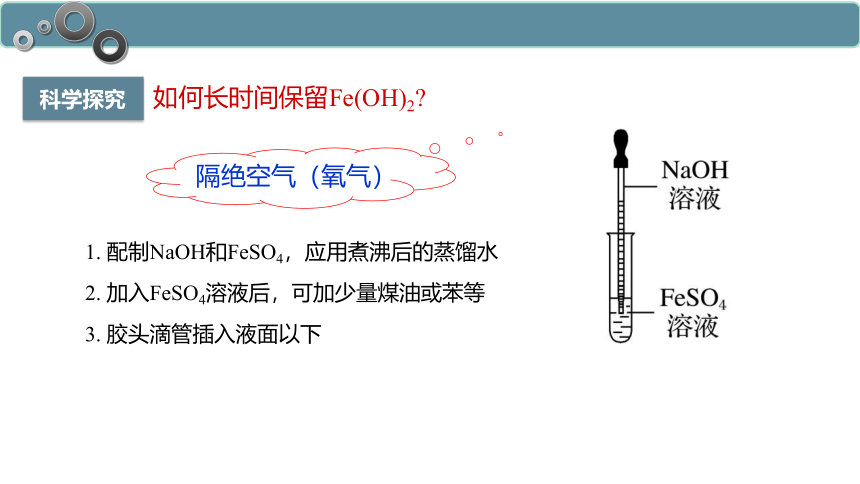
科学探究
如何长时间保留Fe(OH)2
1. 配制NaOH和FeSO4,应用煮沸后的蒸馏水
2. 加入FeSO4溶液后,可加少量煤油或苯等
3. 胶头滴管插入液面以下
隔绝空气(氧气)
知识点三
(1)Fe3+离子的检验
Fe3++3SCN -=Fe(SCN)3
Fe2+与 SCN- 反应不显色
3. 铁盐和亚铁盐
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
黄色
白色沉淀迅速变灰绿色,最后呈红褐色
立即产生
红褐色沉淀
无现象
血红色
(血红色)
实验探究
试剂 现象 离子方程式
KSCN溶液铁粉
氯水
溶液由黄色变为浅绿色
在盛有少量FeCl3溶液的试管中加入少量铁粉,滴入几滴KSCN溶液,观察并记录其现象。把上层清液带入另一支试管中,再滴入几滴氯水,又发生了什么变化?
溶液显血红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
科学探究
Fe2+ Fe3+
1
2
思考:如何实现过程1和2的变化?
实验试剂:
过程1需加入适当的氧化剂
过程2需加入适当的还原剂
实验现象:
2FeCl3+Fe=3FeCl2
Fe2+ Fe3+
Cl2 (酸性KMnO4溶液)
Fe Cu
实验结论:
(2)Fe2+与Fe3+的相互转化
元素价态
2FeCl2+Cl2=2FeCl3
趣味实验
用毛笔在铜片上刻字
铜片
Cu
魔术大揭密:2Fe3++Cu=2Fe2++Cu2+
FeCl3溶液
实验探究
设计实验方案:判断“速力菲”补血剂中铁元素的存在形式。
试剂:补血片剂溶液(久置、新制),KSCN溶液,H2O2溶液
知识总结
(1)Fe只具有还原性。可被弱氧化剂(H+、S、Fe3+等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
(2)Fe2+既有氧化性又有还原性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;可被还原剂(Al、Zn、CO、C等)还原为Fe。
(3)Fe3+只具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。
知识运用
1. 印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列后果不可能出现的是( )
B
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铜、铁都有 D、烧杯中铁、铜都无
知识运用
2. 将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A
A、2∶3 B、3∶2 C、1∶2 D、1∶1
知识运用
(1)B的化学式为 ;D的化学式为 。
(2)写出由E转变成F的化学方程式: 。
(3)常用 (填试剂名称)检验G中的阳离子,其现象为_________
。
(4)向G溶液中加入A的有关反应的离子方程式为 。
3. 已知有以下物质的相互转化:
FeCl2
KCl
4Fe(OH)2+2H2O+O2===4Fe(OH)3
KSCN溶液
棕黄色溶
液变为红色溶液
2Fe3++Fe===3Fe2+
形成方法
Fe
较弱氧化剂H+、Cu2+
还原剂Zn、Al、H2
强氧化剂:HNO3、Cl2
还原剂Fe 、Cu
强氧化剂:H2O2、Cl2 、O2
Fe2+
Fe3+
还原剂Zn、Al、H2
氧化性、还原性
还原性
氧化性
本节内容结束
第
三
章
铁
金
属
材
料
第一 节 铁 及 其 化 合 物
铁 的 重 要 化 合 物
教 学 目 标
核 心 素 养
1.了解铁的重要化合物的主要性质及应用。
2.掌握Fe2+、Fe3+的检验方法及其相互转化。
3.了解Fe(OH)2、Fe(OH)3的制备方法。
通过铁的化合物的学习培养学生能够从物质类别和元素价态预测物质的性质,并能设计物质间的转化,培养学生论据推理与模型认知、科学探究与创新意识的化学核心素养。
问题思考
金属单质
Fe
FeO
Fe2O3
Fe3O4
Fe(OH)2
Fe(OH)3
FeCl2
FeCl3
金属化合物
金属氧化物
氢氧化物
盐
资料卡片
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
褐铁矿(Fe2O3·nH2O )
黄铁矿(FeS2 )
知识点一
化学式 FeO Fe2O3 Fe3O4
色态
俗名
铁的价态
水溶性
与酸反应
碱性氧化物
——
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
+2
+3
+2、+3
不溶
不溶
不溶
FeO + 2H+ = Fe2+
+ H2O
Fe2O3 + 6H+ =
2Fe3+ + 3H2O
Fe3O4 + 8H+=
Fe2+ + 2Fe3++4 H2O
是
是
否
① Fe3O4是纯净物,而非混合物;是一种复杂的化合物
②高温时,铁的氧化物均能被C、CO、Al等还原剂还原成铁。
1. 铁的氧化物
知识点二
2. 铁的氢氧化物
氢氧化铁 Fe(OH)3 氢氧化亚铁 Fe(OH)2
Fe3++3OH-=Fe(OH)3↓
红褐色
难溶于水
Fe(OH)3+3H+=Fe3++3H2O
Fe2++2OH-=Fe(OH)2↓(隔绝空气)
白色
极易被空气中氧气氧化成氢氧化铁
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
白色 灰绿色 红褐色
2Fe(OH)3==Fe2O3+3H2O
受热易分解
稳定性
与盐酸反应
制法
颜色
溶解性
科学探究
如何长时间保留Fe(OH)2
1. 配制NaOH和FeSO4,应用煮沸后的蒸馏水
2. 加入FeSO4溶液后,可加少量煤油或苯等
3. 胶头滴管插入液面以下
隔绝空气(氧气)
知识点三
(1)Fe3+离子的检验
Fe3++3SCN -=Fe(SCN)3
Fe2+与 SCN- 反应不显色
3. 铁盐和亚铁盐
鉴别方法 Fe2+ Fe3+
直接观色
加KSCN溶液
加NaOH溶液
浅绿色
黄色
白色沉淀迅速变灰绿色,最后呈红褐色
立即产生
红褐色沉淀
无现象
血红色
(血红色)
实验探究
试剂 现象 离子方程式
KSCN溶液铁粉
氯水
溶液由黄色变为浅绿色
在盛有少量FeCl3溶液的试管中加入少量铁粉,滴入几滴KSCN溶液,观察并记录其现象。把上层清液带入另一支试管中,再滴入几滴氯水,又发生了什么变化?
溶液显血红色
2Fe3++Fe=3Fe2+
2Fe2++Cl2=2Fe3++2Cl-
科学探究
Fe2+ Fe3+
1
2
思考:如何实现过程1和2的变化?
实验试剂:
过程1需加入适当的氧化剂
过程2需加入适当的还原剂
实验现象:
2FeCl3+Fe=3FeCl2
Fe2+ Fe3+
Cl2 (酸性KMnO4溶液)
Fe Cu
实验结论:
(2)Fe2+与Fe3+的相互转化
元素价态
2FeCl2+Cl2=2FeCl3
趣味实验
用毛笔在铜片上刻字
铜片
Cu
魔术大揭密:2Fe3++Cu=2Fe2++Cu2+
FeCl3溶液
实验探究
设计实验方案:判断“速力菲”补血剂中铁元素的存在形式。
试剂:补血片剂溶液(久置、新制),KSCN溶液,H2O2溶液
知识总结
(1)Fe只具有还原性。可被弱氧化剂(H+、S、Fe3+等)氧化成Fe2+,被强氧化剂(Cl2等)氧化成Fe3+。
(2)Fe2+既有氧化性又有还原性。可被强氧化剂[Cl2、KMnO4(H+)等]氧化为Fe3+;可被还原剂(Al、Zn、CO、C等)还原为Fe。
(3)Fe3+只具有氧化性,可被弱还原剂(Fe、Cu等)还原为Fe2+,被强还原剂(Al、Zn、CO等)还原为Fe。
知识运用
1. 印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列后果不可能出现的是( )
B
A、烧杯中有铜无铁 B、烧杯中有铁无铜
C、烧杯中铜、铁都有 D、烧杯中铁、铜都无
知识运用
2. 将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe3+和Fe2+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A
A、2∶3 B、3∶2 C、1∶2 D、1∶1
知识运用
(1)B的化学式为 ;D的化学式为 。
(2)写出由E转变成F的化学方程式: 。
(3)常用 (填试剂名称)检验G中的阳离子,其现象为_________
。
(4)向G溶液中加入A的有关反应的离子方程式为 。
3. 已知有以下物质的相互转化:
FeCl2
KCl
4Fe(OH)2+2H2O+O2===4Fe(OH)3
KSCN溶液
棕黄色溶
液变为红色溶液
2Fe3++Fe===3Fe2+
形成方法
Fe
较弱氧化剂H+、Cu2+
还原剂Zn、Al、H2
强氧化剂:HNO3、Cl2
还原剂Fe 、Cu
强氧化剂:H2O2、Cl2 、O2
Fe2+
Fe3+
还原剂Zn、Al、H2
氧化性、还原性
还原性
氧化性
本节内容结束
