4.2.2 元素周期表和元素周期律的应用-高一化学人教版必修第一册同步课件(共20张PPT)
文档属性
| 名称 | 4.2.2 元素周期表和元素周期律的应用-高一化学人教版必修第一册同步课件(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:48:59 | ||
图片预览




文档简介
(共20张PPT)
第2课时 元素周期表和元素周期律的应用
第 四 章 物质结构 元素周期律
一个人要发现卓有成效的真理,需要千百万个人在失败的探索和悲惨的错误中毁掉自己的生命。
门捷列夫
第二节 元素周期律
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解元素周期表的结构。
2.认识周期表是元素周期律的具体表现形式。
3.体会元素周期表和元素周期律在科学研究和生活实践中的指导意义。
通过了解周期表的结构培养学生论据推理与模型认知的化学核心素养;通过元素周期表和元素周期律的学习培养学生科学态度与社会责任的化学核心素养。
科学史话
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预言了锗的存在和性质,多年后也得到了证实。
门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫的预言
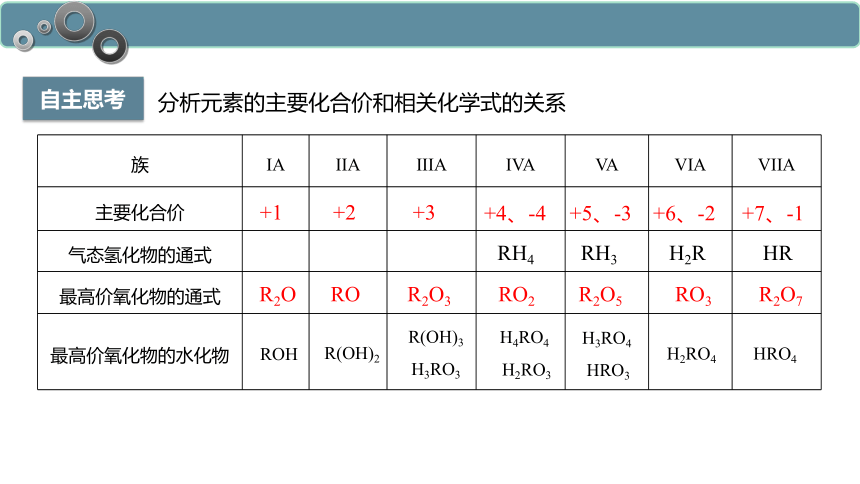
自主思考
分析元素的主要化合价和相关化学式的关系
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
最高价氧化物的水化物
+1
+2
+3
+4、-4
+5、-3
+6、-2
+7、-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
H4RO4
H2RO3
H3RO4
HRO3
H2RO4
HRO4
ROH
R(OH)2
R(OH)3
H3RO3
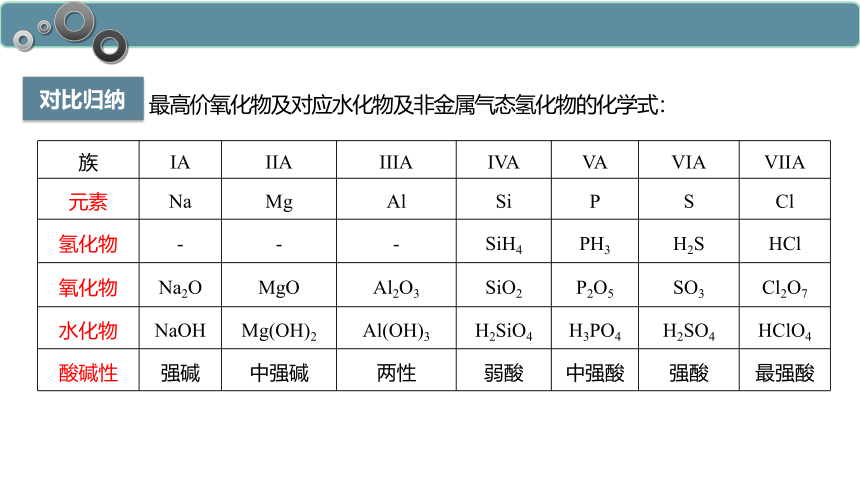
对比归纳
最高价氧化物及对应水化物及非金属气态氢化物的化学式:
族 IA IIA IIIA IVA VA VIA VIIA
元素 Na Mg Al Si P S Cl
氢化物 - - - SiH4 PH3 H2S HCl
氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
水化物 NaOH Mg(OH)2 Al(OH)3 H2SiO4 H3PO4 H2SO4 HClO4
酸碱性 强碱 中强碱 两性 弱酸 中强酸 强酸 最强酸
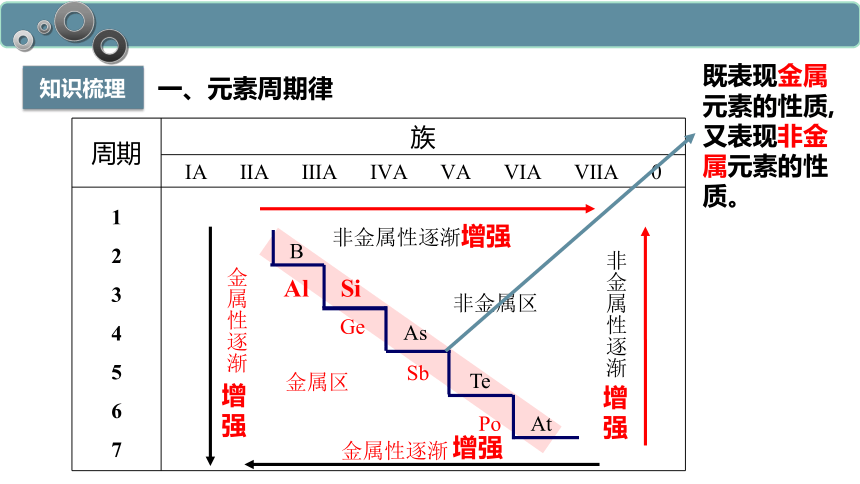
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
Ge
Sb
Po
非金属性逐渐增强
B
As
Te
At
非金属区
金属区
知识梳理
非金属性逐渐
增
强
金属性逐渐
增
强
金属性逐渐
增强
Al Si
一、元素周期律
既表现金属元素的性质,又表现非金属元素的性质。
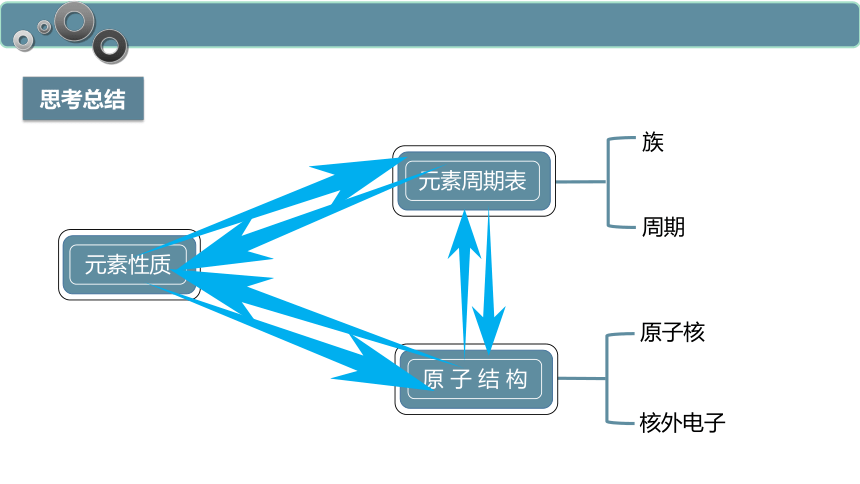
思考总结
族
周期
原子核
核外电子
元素性质
元素周期表
原 子 结 构
知识梳理
1.主族元素的最高正价 =主族元素的族序数=最外层电子数=价电子数
最低负化合价=原子达到8电子稳定结构所需得到的电子数
2.非金属:最高正化合价=原子所能失去或偏移的最外层电子数
最高正价 + |最低负价|=8
位置与化合价的关系
Al:最高正价 = Ⅲ A的族序数 = 最外层电子数
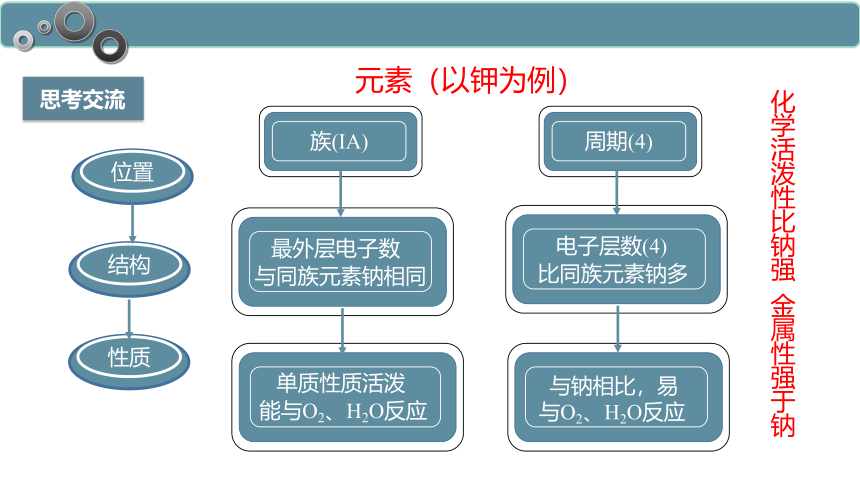
思考交流
位置
结构
性质
族(ⅠA)
与同族元素钠相同
最外层电子数
能与O2、H2O反应
单质性质活泼
周期(4)
比同族元素钠多
电子层数(4)
与钠相比,易
与O2、H2O反应
元素(以钾为例)
化学活泼性比钠强 金属性强于钠
点拔提升
二、元素周期表和元素周期律的生产应用
1. 根据周期表预言新元素的存在
类铝(镓)的发现:1875年,法国化学家布瓦博德朗在分析
比里牛斯山的闪锌矿时发现了一种新元素,命名为镓,并测
得镓的密度为4.7。不久收到门捷列夫的来信指出:镓的密度
不应是4 .7,而是5.9~6.0,布瓦博德朗是唯一手里掌握金属镓
的人,门捷列夫是怎样知道镓的密度的呢?经重新测定:镓
的密度确实是5.94,这结果使他大为惊奇,认真阅读门捷列夫的周期律论文后,他感慨地说“我没有什么可说的了,事实证明了门捷列夫理论的巨大意义”。
(1)在周期表中_______________________,可以找到半导体材料。
点拔提升
2. 指导其他与化学相关的科学技术
金属与非金属分界处
二、元素周期表和元素周期律的生产应用
点拔提升
(2)在元素周期表的__________,寻找制取农药的元素。
右上角
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
点拔提升
(3)在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
钯铂铑合金催化剂
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
钛合金管
点拔提升
① 2H2O2==== 2H2O + O2↑
MnO2
② 2KClO3==== 2KCl+ 3O2↑
MnO2
△
Pt-Rh
④ 4NH3+5O2==== 4NO+ 6H2O
△
③ 2SO2 + O2 2SO3
V2O5
△
(3)在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
思考讨论
1. 预测元素的性质
三、元素周期表和元素周期律的理论应用
(1)镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
B
A.镭比钙金属性更强 B.氢氧化物呈两性
C.在化合物中呈+2价 D.碳酸盐难溶于水
思考讨论
(2)下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强
D. 甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多, 所以甲活泼
减小
×
元素非金属性越强,氢化物越稳定
√
HClO不是最高价氧化物对应酸
×
活泼性与得失电子数目无关,与得失电子的能力有关
×
B
2. 比较元素的性质
三、元素周期表和元素周期律的理论应用
思考讨论
(3)已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4A、原子半径XB、得电子能力X、Y、Z逐渐减弱
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
C
同一周期
非金属性逐渐增强
位置: X、Y、Z
X>Y>Z
增强
增强
×
×
×
√
2. 比较元素的性质
三、元素周期表和元素周期律的理论应用
(4)几种短周期元素的原子半径及主要化合价如下表。下列叙述正确的是( )
思考讨论
-2
+5、+3、-3
+3
+2
主要化合价
66
70
143
160
原子半径/pm
W
Z
Y
X
元素代号
D
A.X、Y元素的金属性 XB.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
3. 综合应用
三、元素周期表和元素周期律的理论应用
形成方法
元素周期律和元素周期表的应用
科学预言新元素
指导化学研究
阐释 “位-构-性”
指导我学习化学
寻找新的物质
指导科学生产实践
本节内容结束
第2课时 元素周期表和元素周期律的应用
第 四 章 物质结构 元素周期律
一个人要发现卓有成效的真理,需要千百万个人在失败的探索和悲惨的错误中毁掉自己的生命。
门捷列夫
第二节 元素周期律
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.了解元素周期表的结构。
2.认识周期表是元素周期律的具体表现形式。
3.体会元素周期表和元素周期律在科学研究和生活实践中的指导意义。
通过了解周期表的结构培养学生论据推理与模型认知的化学核心素养;通过元素周期表和元素周期律的学习培养学生科学态度与社会责任的化学核心素养。
科学史话
门捷列夫在研究元素周期表时,科学地预言了11种尚未发现的元素,为它们在周期表中留下了空位。例如,他认为在铝的下方有一个与铝类似的元素“类铝”,并预测了它的性质。1875年,法国化学家发现了这种元素,将它命名为镓。镓的性质与门捷列夫推测的一样。门捷列夫还预言了锗的存在和性质,多年后也得到了证实。
门捷列夫作出这些伟大预言的科学依据是什么?
门捷列夫的预言
自主思考
分析元素的主要化合价和相关化学式的关系
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
最高价氧化物的水化物
+1
+2
+3
+4、-4
+5、-3
+6、-2
+7、-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
H4RO4
H2RO3
H3RO4
HRO3
H2RO4
HRO4
ROH
R(OH)2
R(OH)3
H3RO3
对比归纳
最高价氧化物及对应水化物及非金属气态氢化物的化学式:
族 IA IIA IIIA IVA VA VIA VIIA
元素 Na Mg Al Si P S Cl
氢化物 - - - SiH4 PH3 H2S HCl
氧化物 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7
水化物 NaOH Mg(OH)2 Al(OH)3 H2SiO4 H3PO4 H2SO4 HClO4
酸碱性 强碱 中强碱 两性 弱酸 中强酸 强酸 最强酸
周期 族
ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2 3 4 5 6 7
Ge
Sb
Po
非金属性逐渐增强
B
As
Te
At
非金属区
金属区
知识梳理
非金属性逐渐
增
强
金属性逐渐
增
强
金属性逐渐
增强
Al Si
一、元素周期律
既表现金属元素的性质,又表现非金属元素的性质。
思考总结
族
周期
原子核
核外电子
元素性质
元素周期表
原 子 结 构
知识梳理
1.主族元素的最高正价 =主族元素的族序数=最外层电子数=价电子数
最低负化合价=原子达到8电子稳定结构所需得到的电子数
2.非金属:最高正化合价=原子所能失去或偏移的最外层电子数
最高正价 + |最低负价|=8
位置与化合价的关系
Al:最高正价 = Ⅲ A的族序数 = 最外层电子数
思考交流
位置
结构
性质
族(ⅠA)
与同族元素钠相同
最外层电子数
能与O2、H2O反应
单质性质活泼
周期(4)
比同族元素钠多
电子层数(4)
与钠相比,易
与O2、H2O反应
元素(以钾为例)
化学活泼性比钠强 金属性强于钠
点拔提升
二、元素周期表和元素周期律的生产应用
1. 根据周期表预言新元素的存在
类铝(镓)的发现:1875年,法国化学家布瓦博德朗在分析
比里牛斯山的闪锌矿时发现了一种新元素,命名为镓,并测
得镓的密度为4.7。不久收到门捷列夫的来信指出:镓的密度
不应是4 .7,而是5.9~6.0,布瓦博德朗是唯一手里掌握金属镓
的人,门捷列夫是怎样知道镓的密度的呢?经重新测定:镓
的密度确实是5.94,这结果使他大为惊奇,认真阅读门捷列夫的周期律论文后,他感慨地说“我没有什么可说的了,事实证明了门捷列夫理论的巨大意义”。
(1)在周期表中_______________________,可以找到半导体材料。
点拔提升
2. 指导其他与化学相关的科学技术
金属与非金属分界处
二、元素周期表和元素周期律的生产应用
点拔提升
(2)在元素周期表的__________,寻找制取农药的元素。
右上角
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
点拔提升
(3)在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
钯铂铑合金催化剂
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
钛合金管
点拔提升
① 2H2O2==== 2H2O + O2↑
MnO2
② 2KClO3==== 2KCl+ 3O2↑
MnO2
△
Pt-Rh
④ 4NH3+5O2==== 4NO+ 6H2O
△
③ 2SO2 + O2 2SO3
V2O5
△
(3)在__________中寻找催化剂和耐高温、耐腐蚀的合金材料。
过渡元素
二、元素周期表和元素周期律的生产应用
2. 指导其他与化学相关的科学技术
思考讨论
1. 预测元素的性质
三、元素周期表和元素周期律的理论应用
(1)镭是第7周期第ⅡA族元素,下列关于镭的性质的描述中不正确的是( )
B
A.镭比钙金属性更强 B.氢氧化物呈两性
C.在化合物中呈+2价 D.碳酸盐难溶于水
思考讨论
(2)下列说法正确的是( )
A. C、N、O、F原子半径依次增大
B. NH3、H2O(g)、HF 稳定性依次增强
C. HClO比H2SO4酸性强
D. 甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多, 所以甲活泼
减小
×
元素非金属性越强,氢化物越稳定
√
HClO不是最高价氧化物对应酸
×
活泼性与得失电子数目无关,与得失电子的能力有关
×
B
2. 比较元素的性质
三、元素周期表和元素周期律的理论应用
思考讨论
(3)已知电子层数相同的三种元素X、Y、Z,其最高价含氧酸酸性:H3XO4
C、单质与氢气反应按照X、Y、Z顺序越来越容易
D、气态氢化物的稳定性按照X、Y、Z顺序减弱
C
同一周期
非金属性逐渐增强
位置: X、Y、Z
X>Y>Z
增强
增强
×
×
×
√
2. 比较元素的性质
三、元素周期表和元素周期律的理论应用
(4)几种短周期元素的原子半径及主要化合价如下表。下列叙述正确的是( )
思考讨论
-2
+5、+3、-3
+3
+2
主要化合价
66
70
143
160
原子半径/pm
W
Z
Y
X
元素代号
D
A.X、Y元素的金属性 X
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
3. 综合应用
三、元素周期表和元素周期律的理论应用
形成方法
元素周期律和元素周期表的应用
科学预言新元素
指导化学研究
阐释 “位-构-性”
指导我学习化学
寻找新的物质
指导科学生产实践
本节内容结束
