4.3.1 离子键-高一化学人教版必修第一册同步课件(共19张PPT)
文档属性
| 名称 | 4.3.1 离子键-高一化学人教版必修第一册同步课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第1课时 离 子 键
第 四 章 物质结构 元素周期律
第 三 节 化学键
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.通过NaCl的形成过程理解离子键的形成过程及形成条件。
2.知道离子键、离子化合物的概念。
3.理解电子式并能用电子式表示一些物质及物质的形成过程。
1. 运用电子式说明物质的组成及其变化,培养学生宏观辨识与微观探析的化学核心素养。
2. 分析离子键的形成,建立离子键和离子化合物判断思维模型,培养学生证据推理与模型认知的化学核心素养。
问题思考
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
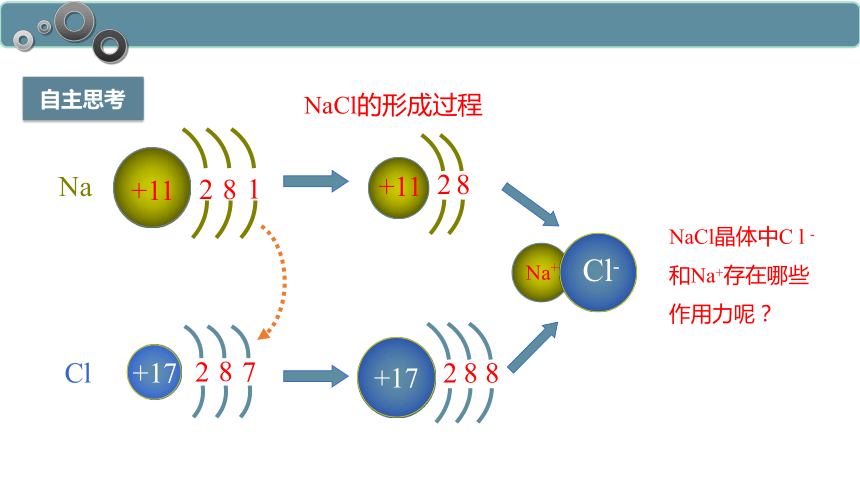
自主思考
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
NaCl的形成过程
NaCl晶体中C l -和Na+存在哪些作用力呢?
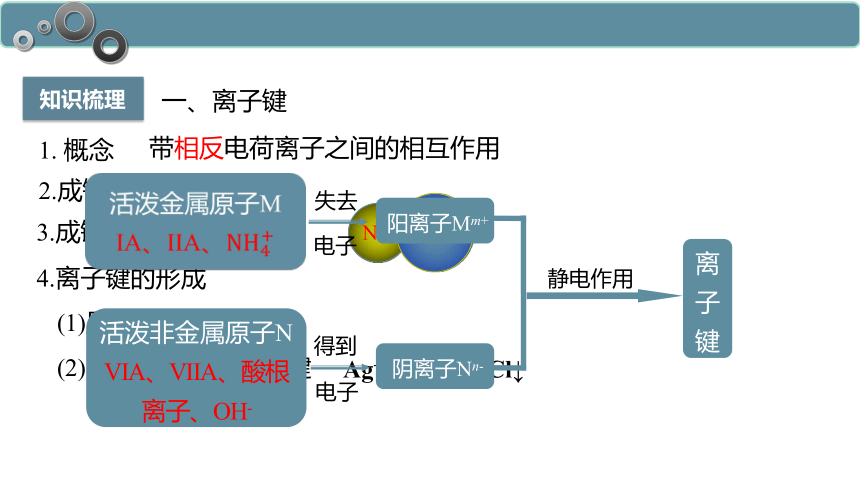
知识梳理
1. 概念
带相反电荷离子之间的相互作用
2.成键粒子
阴阳离子
3.成键本质
静电作用
4.离子键的形成
(2)离子直接形成离子键
Ag++Cl-==AgCl↓
(1)原子
一、离子键
Na+
Cl-
静电作用
阳离子Mm+
阴离子Nn-
离子键
电子
失去
电子
得到
活泼金属原子M
IA、IIA、
活泼非金属原子N
VIA、VIIA、酸根离子、OH-
知识梳理
5.离子化合物
Na+
Mg2+
Ca2 +
Al3+
Fe2+
Fe3+
Cu2+
Cl-
S2-
OH-
O2-
由离子键构成的化合物
a.活泼金属原子M(IA,IIA)和活泼非金属原子(VIA,VIIA)形成的化合物
Na2SO4、MgSO4、KNO3、NaOH
b.活泼金属原子和酸根(或氢氧根)形成的化合物
NH4Cl、NH4NO3、( NH4) 2SO4
c.铵根和酸根形成的化合物
一、离子键
NaCl、MgCl2、KCl 、 NaF
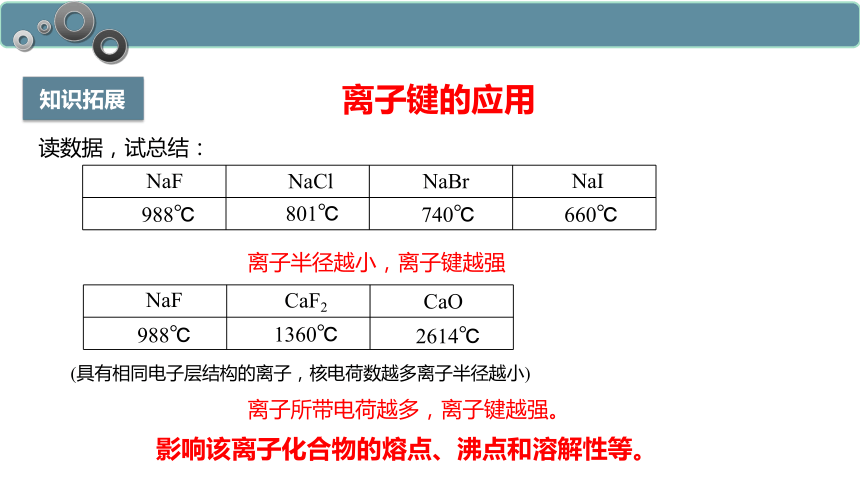
知识拓展
离子所带电荷越多,离子键越强。
离子键的应用
影响该离子化合物的熔点、沸点和溶解性等。
读数据,试总结:
离子半径越小,离子键越强
(具有相同电子层结构的离子,核电荷数越多离子半径越小)
NaF
NaCl
NaBr
NaI
988℃
801℃
740℃
660℃
NaF
CaF2
CaO
988℃
1360℃
2614℃
知识拓展
Al2O3由半径小、多电荷离子构成,离子键强,熔点高,常用作耐火材料
离子键的应用
Al2O3 耐 高 温 陶瓷
坩埚
蒸发皿
瓷管
资料卡片
在元素符号周围用 · 或 × 来表示原子的最外层电子的式子
(1)原子
H
O
Cl
Mg
Na
(2)简单离子
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
在元素符号四个方向逐一放置电子
O
2-
电 子 式
资料卡片
Cl
Na
Na
O
2-
Na
Cl
Mg
2+
Cl
(3)离子化合物
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
AB型
A2B型
AB2型
Mg
2
O
2-
电 子 式
难点透析
硫原子、 溴原子、氟原子、 硫离子、 溴离子、氟离子、 铝离子
·S·
··
··
··
Br ·
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
F ·
··
··
··
[ F ]-
··
··
:
:
Al3+
写出下列微粒的电子式:
电 子 式
难点透析
氮化钠
Na
Na
Na
N
: :
: :
3-
+
+
+
氢化钠
Na
+
H
:
-
氧化钠
Na
O
2-
Na
写出下列微粒的电子式:
电 子 式
资料卡片
(4)用电子式表示离子化合物的形成过程
Mg
2+
Br
Br
S
K
K
Br
Mg
Br
S
2-
K
K
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
电 子 式
易错辨析
(4)将多个相同的离子归在一起,如将K2S的电子式错写为
用电子式表示时易出现的错误:
(1)漏标阴离子的括号,如将S2-的电子式错写为
(2)给阳离子多标电子和括号,如将Al3+的电子式错写为
(3)漏标或错标离子的电荷,如将S2-的电子式错写为
电 子 式
知识巩固
1. 以下叙述中,错误的是( )
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、
原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.金属钠与氯气反应生成氯化钠后,体系能量降低
√
A.①④⑥ B.②③⑤
C.④⑤ D.②⑥
知识巩固
2. 下列物质中不含离子键的是( )
①NH4HCO3 ②NH3 ③BaSO4 ④CH3COONa·3H2O ⑤Ba(OH)2 ⑥H2SO4
√
知识巩固
3. 下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
×
×
×
√
Na
O2
2
O
]
[
Na
Na
知识巩固
4. A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和为35,A、C同主族,B+原子核外有10个电子,则:
(1)A、B、C三种元素分别为_______、_______、______。
(2)A、B、C两两之间可形成多种化合物,其中属于离子化合物的化学式分别为_______、_______、______。
(3)用电子式表示B和C形成化合物的过程:
___________________________________。
氧(O)
钠(Na)
硫(S)
Na2O
Na2O2
Na2S
本节内容结束
第1课时 离 子 键
第 四 章 物质结构 元素周期律
第 三 节 化学键
化学1 必修 人民教育出版社
化学2 必修 人民教育出版社
教 学 目 标
核 心 素 养
1.通过NaCl的形成过程理解离子键的形成过程及形成条件。
2.知道离子键、离子化合物的概念。
3.理解电子式并能用电子式表示一些物质及物质的形成过程。
1. 运用电子式说明物质的组成及其变化,培养学生宏观辨识与微观探析的化学核心素养。
2. 分析离子键的形成,建立离子键和离子化合物判断思维模型,培养学生证据推理与模型认知的化学核心素养。
问题思考
118种元素组成的物质千万种,什么作用使这些元素的原子结合在一起的呢?
自主思考
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
NaCl的形成过程
NaCl晶体中C l -和Na+存在哪些作用力呢?
知识梳理
1. 概念
带相反电荷离子之间的相互作用
2.成键粒子
阴阳离子
3.成键本质
静电作用
4.离子键的形成
(2)离子直接形成离子键
Ag++Cl-==AgCl↓
(1)原子
一、离子键
Na+
Cl-
静电作用
阳离子Mm+
阴离子Nn-
离子键
电子
失去
电子
得到
活泼金属原子M
IA、IIA、
活泼非金属原子N
VIA、VIIA、酸根离子、OH-
知识梳理
5.离子化合物
Na+
Mg2+
Ca2 +
Al3+
Fe2+
Fe3+
Cu2+
Cl-
S2-
OH-
O2-
由离子键构成的化合物
a.活泼金属原子M(IA,IIA)和活泼非金属原子(VIA,VIIA)形成的化合物
Na2SO4、MgSO4、KNO3、NaOH
b.活泼金属原子和酸根(或氢氧根)形成的化合物
NH4Cl、NH4NO3、( NH4) 2SO4
c.铵根和酸根形成的化合物
一、离子键
NaCl、MgCl2、KCl 、 NaF
知识拓展
离子所带电荷越多,离子键越强。
离子键的应用
影响该离子化合物的熔点、沸点和溶解性等。
读数据,试总结:
离子半径越小,离子键越强
(具有相同电子层结构的离子,核电荷数越多离子半径越小)
NaF
NaCl
NaBr
NaI
988℃
801℃
740℃
660℃
NaF
CaF2
CaO
988℃
1360℃
2614℃
知识拓展
Al2O3由半径小、多电荷离子构成,离子键强,熔点高,常用作耐火材料
离子键的应用
Al2O3 耐 高 温 陶瓷
坩埚
蒸发皿
瓷管
资料卡片
在元素符号周围用 · 或 × 来表示原子的最外层电子的式子
(1)原子
H
O
Cl
Mg
Na
(2)简单离子
一般用 表示
R
n-
直接用离子符号
简单阳离子
简单阴离子
Cl
Na
在元素符号四个方向逐一放置电子
O
2-
电 子 式
资料卡片
Cl
Na
Na
O
2-
Na
Cl
Mg
2+
Cl
(3)离子化合物
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
AB型
A2B型
AB2型
Mg
2
O
2-
电 子 式
难点透析
硫原子、 溴原子、氟原子、 硫离子、 溴离子、氟离子、 铝离子
·S·
··
··
··
Br ·
··
··
[ S ]2-
··
··
:
:
[ Br ]-
··
··
:
:
F ·
··
··
··
[ F ]-
··
··
:
:
Al3+
写出下列微粒的电子式:
电 子 式
难点透析
氮化钠
Na
Na
Na
N
: :
: :
3-
+
+
+
氢化钠
Na
+
H
:
-
氧化钠
Na
O
2-
Na
写出下列微粒的电子式:
电 子 式
资料卡片
(4)用电子式表示离子化合物的形成过程
Mg
2+
Br
Br
S
K
K
Br
Mg
Br
S
2-
K
K
书写要点:
①左侧写原子的电子式
④右侧写离子化合物的电子式
③中间用 连接
②用弧形箭头表示电子转移的方向
电 子 式
易错辨析
(4)将多个相同的离子归在一起,如将K2S的电子式错写为
用电子式表示时易出现的错误:
(1)漏标阴离子的括号,如将S2-的电子式错写为
(2)给阳离子多标电子和括号,如将Al3+的电子式错写为
(3)漏标或错标离子的电荷,如将S2-的电子式错写为
电 子 式
知识巩固
1. 以下叙述中,错误的是( )
A.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强
B.在氯化钠中,除氯离子和钠离子的静电吸引作用外,还存在电子与电子、
原子核与原子核之间的排斥作用
C.任何离子键在形成的过程中必定有电子的得与失
D.金属钠与氯气反应生成氯化钠后,体系能量降低
√
A.①④⑥ B.②③⑤
C.④⑤ D.②⑥
知识巩固
2. 下列物质中不含离子键的是( )
①NH4HCO3 ②NH3 ③BaSO4 ④CH3COONa·3H2O ⑤Ba(OH)2 ⑥H2SO4
√
知识巩固
3. 下列用电子式表示化合物的形成过程正确的是( )
K
O
K
O
]
[
K
2
K
A、
[
]
Ba
[
]
Cl
[
]
Cl
2
Ba
Cl
Cl
B、
]
Mg
F
F
Mg
F
2
[
2
C、
D、
A
Ba
[
]
Cl
[
]
Cl
2
]
Mg
F
2
[
]
F
[
×
×
×
√
Na
O2
2
O
]
[
Na
Na
知识巩固
4. A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和为35,A、C同主族,B+原子核外有10个电子,则:
(1)A、B、C三种元素分别为_______、_______、______。
(2)A、B、C两两之间可形成多种化合物,其中属于离子化合物的化学式分别为_______、_______、______。
(3)用电子式表示B和C形成化合物的过程:
___________________________________。
氧(O)
钠(Na)
硫(S)
Na2O
Na2O2
Na2S
本节内容结束
