2.4化学反应的调控(教学课件)(共23张PPT)高二化学同步备课系列(人教版2019选择性必修1)
文档属性
| 名称 | 2.4化学反应的调控(教学课件)(共23张PPT)高二化学同步备课系列(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 25.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:50:31 | ||
图片预览





文档简介
(共23张PPT)
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
新课导入
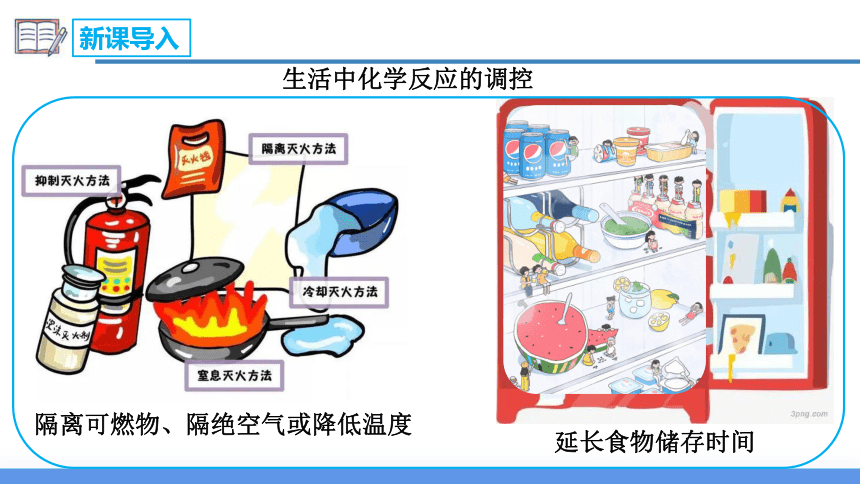
生活中化学反应的调控
隔离可燃物、隔绝空气或降低温度
延长食物储存时间
新课导入
下面我们以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
模块一 合成氨反应条件与原理分析
一、合成氨反应条件与原理分析
1.反应原理和特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。
可逆反应
正反应是气体体积减小的反应
ΔH<0、ΔS<0
一、合成氨反应条件与原理分析
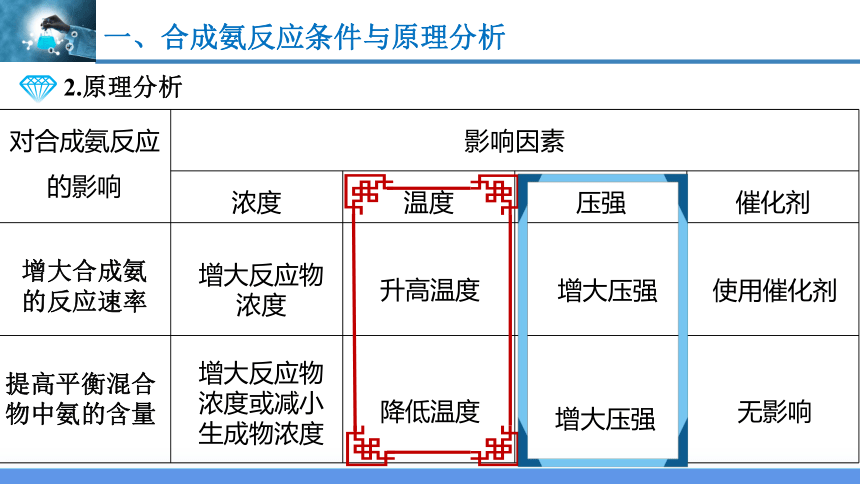
2.原理分析
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨 的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度或减小生成物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
一、合成氨反应条件与原理分析
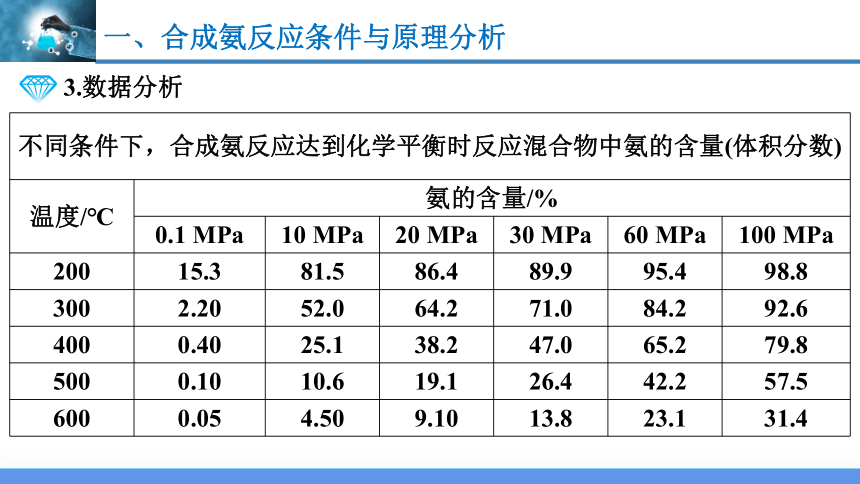
3.数据分析
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
一、合成氨反应条件与原理分析
3.实验数据分析
升高温度、增大压强、增大反应物浓度及使用催化剂等
可以使合成氨的反应速率增大
降低温度、增大压强、增大反应物浓度等
有利于提高平衡混合物中氨的含量
模块二 工业合成氨适宜条件的选择
1.压强
二、工业合成氨适宜条件的选择
原理分析
实验分析
合成氨时压强越大越好
实际生产
压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大
大大增加生产投资,并可能降低综合经济效益
我国的合成氨厂一般采用的压强为10MPa~30MPa
2.温度
二、工业合成氨适宜条件的选择
原理分析
实验分析
低温以提高平衡转化率
温度降低会使化学反应速率减小
实际生产
达到平衡所需时间变长,工业生产中是很不经济
在实际生产中一般采用的温度为400~500 ℃。
3.催化剂
二、工业合成氨适宜条件的选择
高温、高压下,N2和H2的化合反应仍然进行十分缓慢。
通常采用加入催化剂的方法,改变反应历程降低反应的活化能,使反应物在较低温度时能较快地发生反应
合成氨工业中普遍使用的是以铁为主体的名成分催化剂,又称铁触媒
3.催化剂
二、工业合成氨适宜条件的选择
铁触媒在500℃左右时的活性最大,这也是合成氨一般选择400~500℃进行的重要原因。另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。
因吸附或沉积毒物而使催化剂活性降低或丧失的过程。
4.合成氨的生产流程
二、工业合成氨适宜条件的选择
N2+H2
干燥
净化
防止催化剂中毒
N2+H2
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2+NH3
冷却
液态NH3
N2+H2+NH3
N2+H2
充分利用能源
增大压强
促使化学平衡向生成氨气的方向移动
原料气循环利用,提高原料利用率
二、工业合成氨适宜条件的选择
综上所述,工业上通常采用铁触媒、在400~500℃和10MPa~30MPa的条件下合成氨。
模块三 化工生产中调控反应的一般思路
三、化工生产中调控反应的一般思路
影响化学反应进行的因素
就是通过改变反应条件使一个可能发生的反应按照某一方向进行。
参加反应的物质组成、结构和性质等本身因素
温度、压强、浓度、催化剂等反应条件
化学反应的调控:
结合设备条件、安全操作、经济成本等情况
实际生产
根据环境保护及社会效益等方面的规定和要求做出分析
寻找适宜的生产条件
权衡利弊,才能实施生产
三、化工生产中调控反应的一般思路
外界条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度
催化剂
增大反应物的浓度
增大反应物的浓度、
减小生成物的浓度
不断地补充反应物、
及时地分离出生成物
加入合适的催化剂
不需要
加入合适的催化剂
三、化工生产中调控反应的一般思路
外界条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
温度 ΔH<0
ΔH>0
压强 反应后气体体积减小的反应
反应后气体体积增大的反应
高温
低温
高温
兼顾速率和平衡,
考虑催化剂的适宜温度
在设备条件允许的前提下,尽量
采取高温并考虑催化剂的活性
高压
(有气体参加)
高压
低压
在设备条件允许的前提下,
尽量采取高压
兼顾速率和平衡,
选取适宜的压强
课堂总结
工业上通常采用铁触媒、
在400~500℃和10MPa~30MPa的条件下合成氨。
课堂检测
1.在合成氨反应中使用催化剂和施加高压,下列叙述中正确的是( )
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用时间,而施加高压无此效果
答案 C
课堂检测
2.合成氨反应达到平衡时,NH3的体积分数与温度、压强的关系如图所示,据此分析合成氨工业中最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
答案 C
课堂检测
3.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列错误的是( )
A.使用催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
答案 B
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第四节 化学反应的调控
新课导入
生活中化学反应的调控
隔离可燃物、隔绝空气或降低温度
延长食物储存时间
新课导入
下面我们以工业合成氨生产条件的选择为例,研究化学反应的调控问题。
模块一 合成氨反应条件与原理分析
一、合成氨反应条件与原理分析
1.反应原理和特点
N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。
可逆反应
正反应是气体体积减小的反应
ΔH<0、ΔS<0
一、合成氨反应条件与原理分析
2.原理分析
对合成氨反应的影响 影响因素 浓度 温度 压强 催化剂
增大合成氨 的反应速率
提高平衡混合物中氨的含量
增大反应物浓度
增大反应物浓度或减小生成物浓度
升高温度
降低温度
增大压强
增大压强
使用催化剂
无影响
一、合成氨反应条件与原理分析
3.数据分析
不同条件下,合成氨反应达到化学平衡时反应混合物中氨的含量(体积分数) 温度/℃ 氨的含量/% 0.1 MPa 10 MPa 20 MPa 30 MPa 60 MPa 100 MPa
200 15.3 81.5 86.4 89.9 95.4 98.8
300 2.20 52.0 64.2 71.0 84.2 92.6
400 0.40 25.1 38.2 47.0 65.2 79.8
500 0.10 10.6 19.1 26.4 42.2 57.5
600 0.05 4.50 9.10 13.8 23.1 31.4
一、合成氨反应条件与原理分析
3.实验数据分析
升高温度、增大压强、增大反应物浓度及使用催化剂等
可以使合成氨的反应速率增大
降低温度、增大压强、增大反应物浓度等
有利于提高平衡混合物中氨的含量
模块二 工业合成氨适宜条件的选择
1.压强
二、工业合成氨适宜条件的选择
原理分析
实验分析
合成氨时压强越大越好
实际生产
压强越大,对材料的强度和设备的制造要求就越高,需要的动力也越大
大大增加生产投资,并可能降低综合经济效益
我国的合成氨厂一般采用的压强为10MPa~30MPa
2.温度
二、工业合成氨适宜条件的选择
原理分析
实验分析
低温以提高平衡转化率
温度降低会使化学反应速率减小
实际生产
达到平衡所需时间变长,工业生产中是很不经济
在实际生产中一般采用的温度为400~500 ℃。
3.催化剂
二、工业合成氨适宜条件的选择
高温、高压下,N2和H2的化合反应仍然进行十分缓慢。
通常采用加入催化剂的方法,改变反应历程降低反应的活化能,使反应物在较低温度时能较快地发生反应
合成氨工业中普遍使用的是以铁为主体的名成分催化剂,又称铁触媒
3.催化剂
二、工业合成氨适宜条件的选择
铁触媒在500℃左右时的活性最大,这也是合成氨一般选择400~500℃进行的重要原因。另外,为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化。
因吸附或沉积毒物而使催化剂活性降低或丧失的过程。
4.合成氨的生产流程
二、工业合成氨适宜条件的选择
N2+H2
干燥
净化
防止催化剂中毒
N2+H2
压缩机加压
10MPa~30MPa
N2+H2
热交换
N2+H2
铁触媒
400~500℃
N2+H2+NH3
冷却
液态NH3
N2+H2+NH3
N2+H2
充分利用能源
增大压强
促使化学平衡向生成氨气的方向移动
原料气循环利用,提高原料利用率
二、工业合成氨适宜条件的选择
综上所述,工业上通常采用铁触媒、在400~500℃和10MPa~30MPa的条件下合成氨。
模块三 化工生产中调控反应的一般思路
三、化工生产中调控反应的一般思路
影响化学反应进行的因素
就是通过改变反应条件使一个可能发生的反应按照某一方向进行。
参加反应的物质组成、结构和性质等本身因素
温度、压强、浓度、催化剂等反应条件
化学反应的调控:
结合设备条件、安全操作、经济成本等情况
实际生产
根据环境保护及社会效益等方面的规定和要求做出分析
寻找适宜的生产条件
权衡利弊,才能实施生产
三、化工生产中调控反应的一般思路
外界条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
浓度
催化剂
增大反应物的浓度
增大反应物的浓度、
减小生成物的浓度
不断地补充反应物、
及时地分离出生成物
加入合适的催化剂
不需要
加入合适的催化剂
三、化工生产中调控反应的一般思路
外界条件 有利于增大反应速率的条件控制 有利于平衡正向移动的条件控制 综合分析结果
温度 ΔH<0
ΔH>0
压强 反应后气体体积减小的反应
反应后气体体积增大的反应
高温
低温
高温
兼顾速率和平衡,
考虑催化剂的适宜温度
在设备条件允许的前提下,尽量
采取高温并考虑催化剂的活性
高压
(有气体参加)
高压
低压
在设备条件允许的前提下,
尽量采取高压
兼顾速率和平衡,
选取适宜的压强
课堂总结
工业上通常采用铁触媒、
在400~500℃和10MPa~30MPa的条件下合成氨。
课堂检测
1.在合成氨反应中使用催化剂和施加高压,下列叙述中正确的是( )
A.都能提高反应速率,都对化学平衡无影响
B.都对化学平衡有影响,但都不影响达到平衡状态所用的时间
C.都能缩短达到平衡状态所用的时间,只有施加高压对化学平衡有影响
D.使用催化剂能缩短反应达到平衡状态所用时间,而施加高压无此效果
答案 C
课堂检测
2.合成氨反应达到平衡时,NH3的体积分数与温度、压强的关系如图所示,据此分析合成氨工业中最有前途的研究方向是( )
A.提高分离技术
B.研制耐高压的合成塔
C.研制低温催化剂
D.探索不用N2和H2合成氨的新途径
答案 C
课堂检测
3.据报道,在300 ℃、70 MPa下由二氧化碳和氢气合成乙醇已成为现实:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g),下列错误的是( )
A.使用催化剂可大大提高生产效率
B.反应需在300 ℃进行可推测该反应是吸热反应
C.充入大量CO2气体可提高H2的转化率
D.从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
答案 B
