2.2.4 化学平衡图像(教学课件)(共23张PPT)高二化学同步备课系列(人教版2019选择性必修1)
文档属性
| 名称 | 2.2.4 化学平衡图像(教学课件)(共23张PPT)高二化学同步备课系列(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:53:50 | ||
图片预览




文档简介
(共23张PPT)
第4讲 化学平衡图像
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
模块一 速率图像
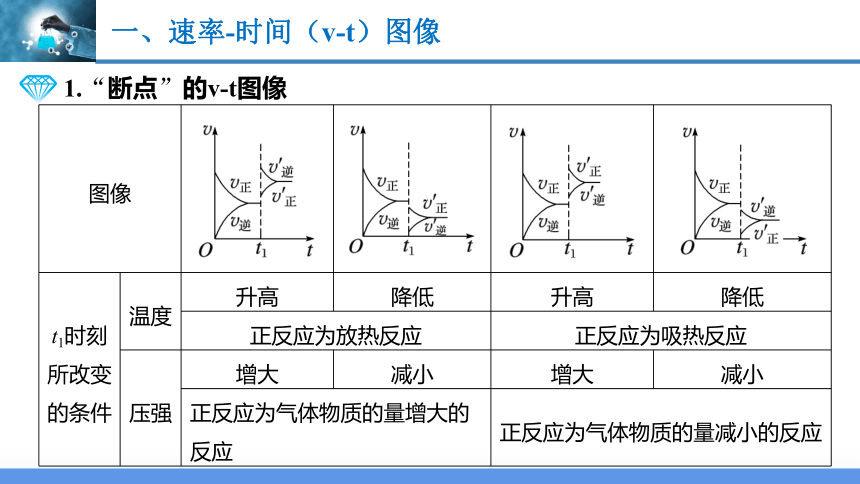
一、速率-时间(v-t)图像
图像
t1时刻所改变的条件 温度 升高 降低 升高 降低
正反应为放热反应 正反应为吸热反应 压强 增大 减小 增大 减小
正反应为气体物质的量增大的反应 正反应为气体物质的量减小的反应 1.“断点”的v-t图像
一、速率-时间(v-t)图像
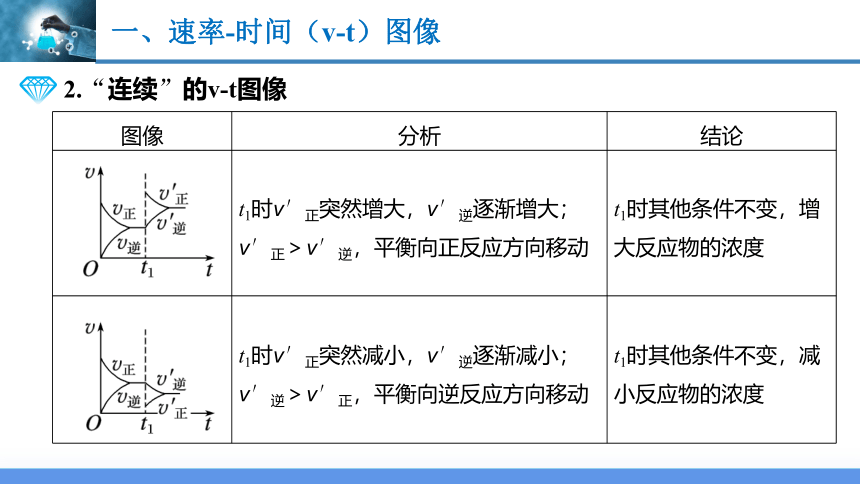
2.“连续”的v-t图像
图像 分析 结论
t1时v′正突然增大,v′逆逐渐增大;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,增大反应物的浓度
t1时v′正突然减小,v′逆逐渐减小;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,减小反应物的浓度
一、速率-时间(v-t)图像
t1时v′逆突然增大,v′正逐渐增大;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,增大生成物的浓度
t1时v′逆突然减小,v′正逐渐减小;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,减小生成物的浓度
2.“连续”的v-t图像
一、速率-时间(v-t)图像
3.“平台”的v-t图像
图像 分析 结论
t1时v′正、v′逆均突然增大且v′正=v′逆,平衡不移动 t1时其他条件不变使用催化剂
t1时其他条件不变增大反应体系的压强且m+n=p+q(反应前后气体体积无变化)
t1时v′正、v′逆均突然减小且v′正=v′逆,平衡不移动 t1时其他条件不变,减小反应体系的压强且m+n=p+q(反应前后气体体积无变化)
一、速率-时间(v-t)图像
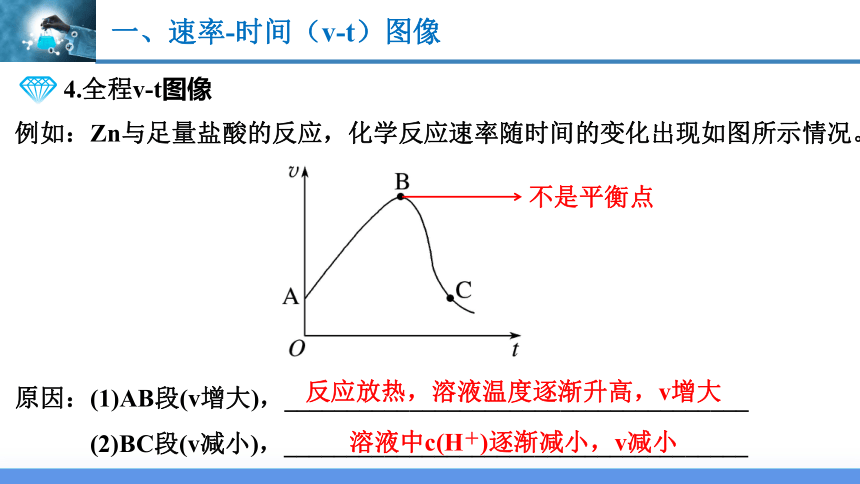
4.全程v-t图像
例如:Zn与足量盐酸的反应,化学反应速率随时间的变化出现如图所示情况。
原因:(1)AB段(v增大),_____________________________________
(2)BC段(v减小),_____________________________________
反应放热,溶液温度逐渐升高,v增大
溶液中c(H+)逐渐减小,v减小
不是平衡点
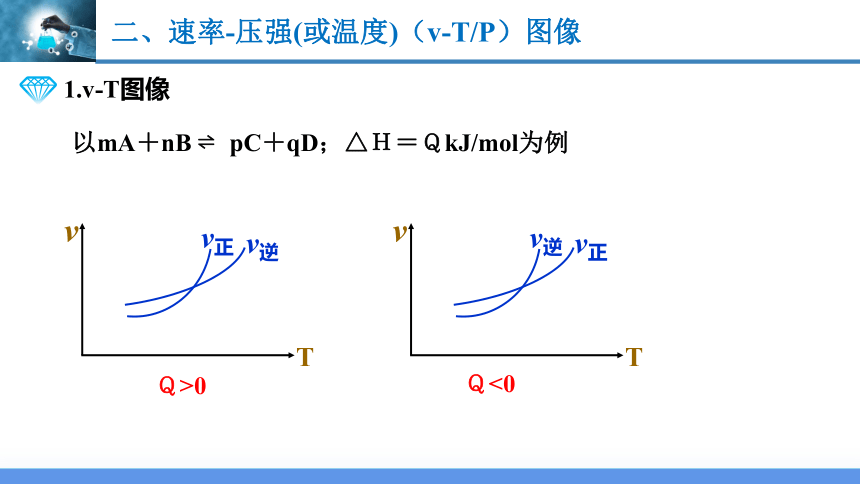
二、速率-压强(或温度)(v-T/P)图像
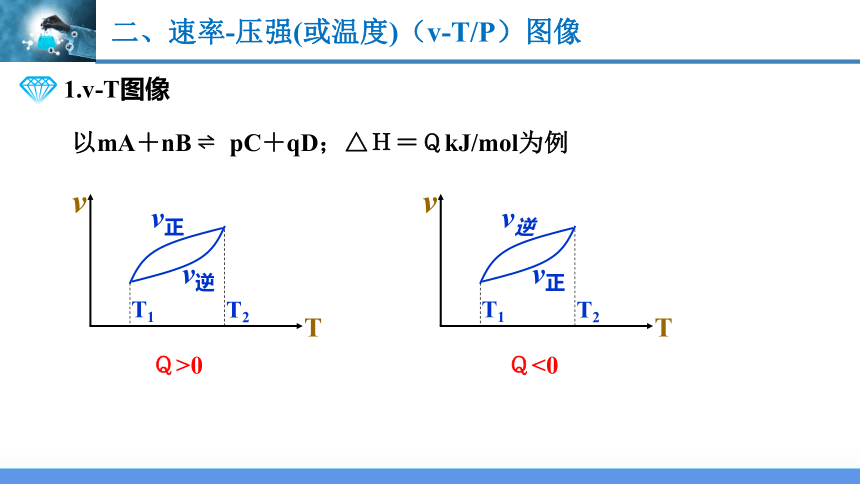
1.v-T图像
以mA+nB pC+qD;△H=QkJ/mol为例
T
v
v逆
v正
T1
T2
Q>0
T
v
v正
v逆
T1
T2
Q<0
二、速率-压强(或温度)(v-T/P)图像
1.v-T图像
以mA+nB pC+qD;△H=QkJ/mol为例
T
v
v正
v逆
Q>0
T
v
v逆
v正
Q<0
二、速率-压强(或温度)(v-T/P)图像
2.v-P图像
以mA+nB pC+qD;△H=QkJ/mol为例
P
v
v逆
v正
P1
P2
P
v
v正
v逆
P1
P2
m+n>p+q
m+n二、速率-压强(或温度)(v-T/P)图像
2.v-P图像
以mA+nB pC+qD;△H=QkJ/mol为例
P
v
v正
v逆
m+n>p+q
P
v
v逆
v正
m+n二、速率-压强(或温度)(v-T/P)图像
模块二 平衡图像
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
先从拐点向横轴作垂线:先拐先平,温度、压强均高。
再从拐点向纵轴作垂线:
①分析温度、压强升高时,转化率或含量的变化,
② 判断平衡移动的方向,从而确定反应的热效应或物质计量数。
t
A的转化率
T1
T2
对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
T1____T2, 正反应____热
P1
P2
t
B的转化率
P1 ___P2 m+n___p+q
>
<
升温
吸
加压
<
【例 】
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
<
放热
<
增大
(2) p1____p2,正反应为气体体积______
的反应
(1)T1_____T2,正反应为______反应。
练1:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
>
放热
>
(2) p1____p2,m+n___p+q
(1)T1___T2,正反应为______反应。
练2:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
t
T1
T2
A%
t
P1
P2
C%
=
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
t
T2P2
T1P2
T1P1
B%
正反应是放热还是吸热?
m+n正反应吸热
练3:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
判断m+n与p+q的关系?
二、恒温线或恒压线图像
该类图像的纵坐标为物质的平衡浓度(反应物或生成物)或反应物的转化率,横坐标为温度或压强。
例1 mA(g)+ nB(g) pC(g)+ qD(g)
正反应 热m+n p+q
放
>
等温线
两个变量影响平衡:
① 直接看横轴:
温度升高,图象的变化趋势,得知温度对平衡的影响。
② 再向横轴作垂线:
(即在等温时),得知压强对平衡的影响。
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
二、恒温线或恒压线图像
P
A%
500℃
200℃
例2:对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
正反应放热
m+n>p+q
正反应放热
m+n等温线
等压线
二、恒温线或恒压线图像
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
P
A%
300℃
200℃
练1:对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热m+n>p+q
正反应吸热m+n=p+q
三、反应过程中组分含量或浓度与温度图像
在相同时间段内,M点前,表示化学反应从反应物开始,则v正>v逆,未达平衡;M点为刚达到的平衡点。M点后为平衡受温度的影响情况,即升温,A%增大(C%减小),平衡逆向移动,ΔH<0。
对于反应mA(g)+nB(g) pC(g)+qD(g)
三、化学平衡曲线外的非平衡点分析
左上方(E点),A%大于此压强或温度时平衡体系中的A%,E点必须向正反应方向移动才能达到平衡状态,所以,E点v正>v逆
对于反应mA(g)+nB(g) pC(g)+qD(g)
L线上所有的点都是平衡点
右下方(F点)v正右下方(E点)v正>v逆。
三、化学平衡曲线外的非平衡点分析
例:可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
第4讲 化学平衡图像
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
模块一 速率图像
一、速率-时间(v-t)图像
图像
t1时刻所改变的条件 温度 升高 降低 升高 降低
正反应为放热反应 正反应为吸热反应 压强 增大 减小 增大 减小
正反应为气体物质的量增大的反应 正反应为气体物质的量减小的反应 1.“断点”的v-t图像
一、速率-时间(v-t)图像
2.“连续”的v-t图像
图像 分析 结论
t1时v′正突然增大,v′逆逐渐增大;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,增大反应物的浓度
t1时v′正突然减小,v′逆逐渐减小;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,减小反应物的浓度
一、速率-时间(v-t)图像
t1时v′逆突然增大,v′正逐渐增大;v′逆>v′正,平衡向逆反应方向移动 t1时其他条件不变,增大生成物的浓度
t1时v′逆突然减小,v′正逐渐减小;v′正>v′逆,平衡向正反应方向移动 t1时其他条件不变,减小生成物的浓度
2.“连续”的v-t图像
一、速率-时间(v-t)图像
3.“平台”的v-t图像
图像 分析 结论
t1时v′正、v′逆均突然增大且v′正=v′逆,平衡不移动 t1时其他条件不变使用催化剂
t1时其他条件不变增大反应体系的压强且m+n=p+q(反应前后气体体积无变化)
t1时v′正、v′逆均突然减小且v′正=v′逆,平衡不移动 t1时其他条件不变,减小反应体系的压强且m+n=p+q(反应前后气体体积无变化)
一、速率-时间(v-t)图像
4.全程v-t图像
例如:Zn与足量盐酸的反应,化学反应速率随时间的变化出现如图所示情况。
原因:(1)AB段(v增大),_____________________________________
(2)BC段(v减小),_____________________________________
反应放热,溶液温度逐渐升高,v增大
溶液中c(H+)逐渐减小,v减小
不是平衡点
二、速率-压强(或温度)(v-T/P)图像
1.v-T图像
以mA+nB pC+qD;△H=QkJ/mol为例
T
v
v逆
v正
T1
T2
Q>0
T
v
v正
v逆
T1
T2
Q<0
二、速率-压强(或温度)(v-T/P)图像
1.v-T图像
以mA+nB pC+qD;△H=QkJ/mol为例
T
v
v正
v逆
Q>0
T
v
v逆
v正
Q<0
二、速率-压强(或温度)(v-T/P)图像
2.v-P图像
以mA+nB pC+qD;△H=QkJ/mol为例
P
v
v逆
v正
P1
P2
P
v
v正
v逆
P1
P2
m+n>p+q
m+n
2.v-P图像
以mA+nB pC+qD;△H=QkJ/mol为例
P
v
v正
v逆
m+n>p+q
P
v
v逆
v正
m+n
模块二 平衡图像
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
先从拐点向横轴作垂线:先拐先平,温度、压强均高。
再从拐点向纵轴作垂线:
①分析温度、压强升高时,转化率或含量的变化,
② 判断平衡移动的方向,从而确定反应的热效应或物质计量数。
t
A的转化率
T1
T2
对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
T1____T2, 正反应____热
P1
P2
t
B的转化率
P1 ___P2 m+n___p+q
>
<
升温
吸
加压
<
【例 】
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
<
放热
<
增大
(2) p1____p2,正反应为气体体积______
的反应
(1)T1_____T2,正反应为______反应。
练1:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
>
放热
>
(2) p1____p2,m+n___p+q
(1)T1___T2,正反应为______反应。
练2:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
t
T1
T2
A%
t
P1
P2
C%
=
一、某物质的转化率(或百分含量)-时间-温度(或压强)图像
t
T2P2
T1P2
T1P1
B%
正反应是放热还是吸热?
m+n
练3:对于反应 mA(g)+ nB(g) pC(g)+ qD(g)
判断m+n与p+q的关系?
二、恒温线或恒压线图像
该类图像的纵坐标为物质的平衡浓度(反应物或生成物)或反应物的转化率,横坐标为温度或压强。
例1 mA(g)+ nB(g) pC(g)+ qD(g)
正反应 热m+n p+q
放
>
等温线
两个变量影响平衡:
① 直接看横轴:
温度升高,图象的变化趋势,得知温度对平衡的影响。
② 再向横轴作垂线:
(即在等温时),得知压强对平衡的影响。
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
二、恒温线或恒压线图像
P
A%
500℃
200℃
例2:对于反应mA(g)+nB(g) pC(g)+qD(g)
T
A的转化率
1.01*107Pa
1.01*106Pa
1.01*105Pa
正反应放热
m+n>p+q
正反应放热
m+n
等压线
二、恒温线或恒压线图像
T
C%
1.01*106Pa
1.01*105Pa
1.01*104Pa
P
A%
300℃
200℃
练1:对于反应mA(g)+nB(g) pC(g)+qD(g)
正反应吸热m+n>p+q
正反应吸热m+n=p+q
三、反应过程中组分含量或浓度与温度图像
在相同时间段内,M点前,表示化学反应从反应物开始,则v正>v逆,未达平衡;M点为刚达到的平衡点。M点后为平衡受温度的影响情况,即升温,A%增大(C%减小),平衡逆向移动,ΔH<0。
对于反应mA(g)+nB(g) pC(g)+qD(g)
三、化学平衡曲线外的非平衡点分析
左上方(E点),A%大于此压强或温度时平衡体系中的A%,E点必须向正反应方向移动才能达到平衡状态,所以,E点v正>v逆
对于反应mA(g)+nB(g) pC(g)+qD(g)
L线上所有的点都是平衡点
右下方(F点)v正
三、化学平衡曲线外的非平衡点分析
例:可逆反应: mA(s)+nB(g) ?? pC(g);△H<0,在一定温度下B的转化率与压强的关系如图所示,则下列判断正确的是( )。(双选)
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速度慢
α(B)
压强
0
X
Y
BD
