2.2.2化学平衡常数(教学课件)(共36张PPT)高二化学同步备课系列(人教版2019选择性必修1)
文档属性
| 名称 | 2.2.2化学平衡常数(教学课件)(共36张PPT)高二化学同步备课系列(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:55:01 | ||
图片预览











文档简介
(共36张PPT)
第2讲 化学平衡常数
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
新课导入
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70 48.37
2 12.28 9.964 0 3.841 1.524 16.87 48.62
3 12.01 8.403 0 4.580 0.973 14.86 49.54
4 0 0 15.20 1.696 1.696 11.81 48.49
5 0 0 12.87 1.433 1.433 10.00 48.70
6 0 0 37.77 4.213 4.213 29.34 48.50
457.6 ℃,在容积不变的密闭容器中发生反应:
H2(g) + I2(g) 2HI(g)
化学平衡,反应物和生成物的浓度之间有什么关系?
C(H2)·C(I2)
C2(HI)
科学家们通过大量数据验证,上述计算得出的定值称为化学平衡常数,用K来表示。
模块一 化学平衡常数
一、化学平衡常数
对于一般的可逆反应
mA(g) + nB(g) pC(g) + qD(g)
在任意时刻时,
称为浓度商
当该反应在一定温度下达到化学平衡时
=K
K是常数,称为化学平衡常数,简称平衡常数
一、化学平衡常数
K=
mA(g) + nB(g) pC(g) + qD(g)
c为平衡浓度
c为任一时刻浓度
1.化学平衡常数的表达式
化学平衡常数:
浓度商:
一、化学平衡常数
化学平衡常数是表明化学反应限度的一个特征值,通常情况下,只受温度影响。
当反应中有关物质的浓度商等于平衡常数时,表明反应达到限度,即达到化学平衡状态。
2.化学平衡常数的意义
一般来说,K>105时,反应就进行得基本完全
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
一、化学平衡常数
微提醒
平衡常数必须指明温度,反应必须达到平衡状态。
平衡常数表示反应进行的程度,不表示 反应的快慢,
即速率大,K值不一定大。
在进行K值的计算时,纯固体、纯液体不作考虑,表达式中不需表达
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
如:
一定温度下
一、化学平衡常数
N2+3H2 2NH3
2NH3 N2+3H2
某温度下
1/2N2+3/2H2 NH3
微提醒
平衡常数的表达式与方程式的书写有关
方程式的系数扩大n倍,K变为Kn,ΔH变为nΔH;
正反应与逆反应K值互为倒数,ΔH互为相反数;
方程式想加减,ΔH想加减,K值相乘除。
一、化学平衡常数
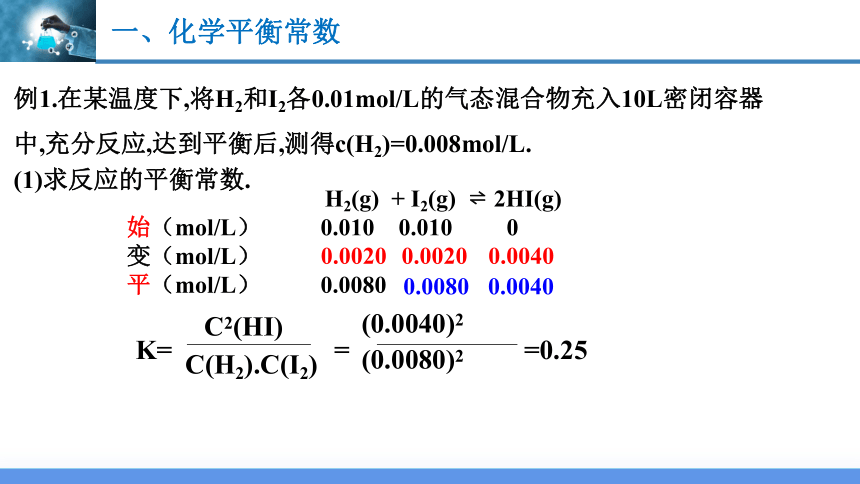
例1.在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反应,达到平衡后,测得c(H2)=0.008mol/L.
H2(g) + I2(g) 2HI(g)
始(mol/L) 0.010 0.010 0
变(mol/L)
平(mol/L) 0.0080
0.0040
0.0020
0.0020
0.0040
0.0080
K=
C2(HI)
C(H2).C(I2)
=
(0.0040)2
(0.0080)2
=0.25
(1)求反应的平衡常数.
一、化学平衡常数
例1.在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反应,达到平衡后,测得c(H2)=0.008mol/L.
(1)求反应的平衡常数.
(2)在上述温度下,将H2和I2各0.20mol的气态混合物充入该密闭容器中,试求达到平衡时各物质的浓度.
(2)根据题意:c(H2)=0.020mol/L, c(I2)=0.020mol/L
设H2的变化浓度为xmol L-1
H2 + I2 2HI
始 0.020 0.020 0
变
平
2x
x
x
2x
0.020-x
0.020-x
K只随温度发生变化,因此
K=
C2(HI)
C(H2).C(I2)
=
(2x)2
(0.020-x)2
=0.25
解得x=0.0040mol/L
C(H2)=C(I2)=0.016mol/L
C(HI)=0.0080mol/L
一、化学平衡常数
例2:在容积不变的密闭容器中,将 2.0mol CO和 10mol H2O(g)混合加热到830℃,达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) ,此时该反应的k=1.0。求达到平衡时CO转化为CO2的转化率。
起:
K=
C(CO2) ·C(H2)
C(CO) ·C(H2O)
=
(x/y)2
(2.0-x)/y· (10-x)/y )
=1
x=5/3
CO(g) + H2O(g) CO2(g) + H2(g)
催化剂
高温
变:
平:
【解】设达到平衡时CO转化为CO2的物质的量为x mol,容器的容积为yL
转化率为=
×100%
=83%
模块二 化学平衡常数的应用
二、化学平衡常数的应用
1.判断平衡移动的方向
mA(g) + nB(g) pC(g) + qD(g)
K=
c为平衡浓度
平衡常数
c为任一时刻浓度
浓度商
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
二、化学平衡常数的应用
高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)
已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
Qc =
c(CO2)
c(CO)
=
0.025mol·L-1
0.1mol·L-1
=0. 25
否
正向
大于
QC<K ,
反应向正方向进行
二、化学平衡常数的应用
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
2.判断反应的热效应
二、化学平衡常数的应用
温度/℃ 200 300 400
K 1.0 0.86 0.5
在0.5 L的密闭容器中,一定量的氮气与氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,其化学平衡常数K与温度的关系如下表所示:
请回答下列问题。
(1)该反应的化学平衡常数表达式为________________,a________(填“大于”“小于”或“等于”)0。
二、化学平衡常数的应用
(2)400 ℃时,2NH3(g)N2(g)+3H2(g)的化学平衡常数为______,测得氨气、氮气、氢气的物质的量分别为3 mol、2 mol、1 mol时,该反应的v正(N2)_______(填“大于”“小于”或“等于”)v逆(N2)。
温度/℃ 200 300 400
K 1.0 0.86 0.5
在0.5 L的密闭容器中,一定量的氮气与氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,其化学平衡常数K与温度的关系如下表所示:
模块三 速率常数
三、速率常数与平衡常数的换算及应用
已知反应aA(g)+bB(g) cC(g),
反应速率v正=k正ca(A)·cb(B),v逆=k逆cc(C)
1.推导过程
当v正=v逆时,反应达到平衡,即k正ca(A)·cb(B)=k逆cc(C)
=K
ca(A)·cb(B)
cc(C)
=
k正
k逆
2.结论
K=
k正
k逆
三、速率常数与平衡常数的换算及应用
3.例题
合成氨反应N2(g)+3H2(g) 2NH3(g) △H<0是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率v正=k正c(N2) c3(H2),逆反应速率v逆=k逆c2(NH3)。k正、k逆为速率常数。平衡常数K与温度的关系如图。
①表示正反应的平衡常数K与温度变化的曲线为________
(填L1或L2)。
②平衡时,合成氨反应的平衡常数K=________
(用k正、k逆表示)。
L1
k正
k逆
三、速率常数与平衡常数的换算及应用
练:(1)NO2可发生二聚反应生成N2O4,化学方程式为2NO2(g) N2O4(g),
上述反应达到平衡后,升高温度可使体系颜色加深,
则该反应的ΔH________0(填“>”或“<”)。
k正
k逆
<
三、速率常数与平衡常数的换算及应用
练:(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆= k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则如图(lg k表示速率常数的对数; 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lg k正随 变化关系的是斜线________,能表示lgk逆随 变化关系的是斜线________。
T
1
T
1
T
1
③
④
三、速率常数与平衡常数的换算及应用
练:(3)图中A、B、C、D四点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=________。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时v正____v逆(填“>”或“<”)
10
>
模块四 压强平衡常数
四、压强平衡常数
当把化学平衡常数K表达式中各物质的浓度用该物质的分压来表示时,就得到该反应的压强平衡常数Kp,其表达式的意义相同。
1.压强平衡常数Kp
Kp仅适用于气相发生的反应。
四、压强平衡常数
2.计算方法
第四步:根据平衡常数计算公式代入计算。
第一步:
根据三段式法计算平衡体系中各组分的物质的量或物质的量浓度。
第二步:计算各气体组分的物质的量分数或体积分数。
第三步:根据分压计算公式求出各气体物质的分压。
某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)
四、压强平衡常数
(1)已知:平衡总压为P平
3.Kp的计算模板
N2(g) + 3H2(g) 2NH3(g)
n(平) a b c
p(分压)
第三段
a+b+c
a
×P平
a+b+c
b
×P平
a+b+c
c
×P平
Kp=
a+b+c
a
×P平
( )
3
a+b+c
b
×P平
( )
2
a+b+c
c
×P平
( )
四、压强平衡常数
(2)已知:恒温恒容,初始压强为P0,转换率为α
3.Kp的计算模板
2NO2(g) N2O4(g)
p(起) P0 0
p(转)
P0 α
P0 α
2
1
p(平)
P0-P0 α
P0 α
2
1
Kp=
P0-P0 α
( )
2
P0 α
2
1
四、压强平衡常数
例:工业生产硫酸过程中发生的一个反应为:SO2(g)+ O2(g) ? SO3(g);将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为_________,平衡常数Kp=____________________。
钒催化剂
Δ
2
1
四、压强平衡常数
钒催化剂
Δ
解析: 假设原气体的物质的量为100 mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,则2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
SO2(g) + O2(g) SO3(g)
2
1
平: 2m(1-α) m(1-α) 2mα
起 : 2m m 0
转: 2mα mα 2mα
平衡时气体的总物质的量为n(总)=[2m(1-α)+m(1-α)+2mα+q] mol,
则SO3的物质的量分数为:
n(总)
n(SO2)
×100%
=
2m(1-α)+m(1-α)+2mα+q
2m(1-α)
四、压强平衡常数
则SO3的物质的量分数为:
n(总)
n(SO2)
×100%
=
2m(1-α)+m(1-α)+2mα+q
2m(1-α)
=
100-mα
2mα
×100%
SO3的分压P(SO3)=
100-mα
2mαp
P(SO2)=
100-mα
2m(1-α)p
P(O2)=
100-mα
m(1-α)p
Kp=
四、压强平衡常数
练1.一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g) 2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
(1)650 ℃时CO2的平衡转化率为__________。
(2)t1 ℃时平衡常数Kp=__________
0.5p
25%
课堂总结
K=
mA(g) + nB(g) pC(g) + qD(g)
c为平衡浓度
c为任一时刻浓度
化学平衡常数:
浓度商:
课堂总结
方程式的系数扩大n倍,K变为Kn,ΔH变为nΔH;
正反应与逆反应K值互为倒数,ΔH互为相反数;
方程式想加减,ΔH想加减,K值相乘除。
一般来说,K>105时,反应就进行得基本完全
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
课堂总结
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
课堂总结
K=
k正
k逆
某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)
压强平衡常数Kp
第2讲 化学平衡常数
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
新课导入
序号 起始时的浓度 (×10-3 mol·L-1) 平衡时的浓度 (×10-3 mol·L-1) 平衡时
c(H2) c(I2) c(HI) c(H2) c(I2) c(HI) 1 11.97 6.944 0 5.617 0.594 12.70 48.37
2 12.28 9.964 0 3.841 1.524 16.87 48.62
3 12.01 8.403 0 4.580 0.973 14.86 49.54
4 0 0 15.20 1.696 1.696 11.81 48.49
5 0 0 12.87 1.433 1.433 10.00 48.70
6 0 0 37.77 4.213 4.213 29.34 48.50
457.6 ℃,在容积不变的密闭容器中发生反应:
H2(g) + I2(g) 2HI(g)
化学平衡,反应物和生成物的浓度之间有什么关系?
C(H2)·C(I2)
C2(HI)
科学家们通过大量数据验证,上述计算得出的定值称为化学平衡常数,用K来表示。
模块一 化学平衡常数
一、化学平衡常数
对于一般的可逆反应
mA(g) + nB(g) pC(g) + qD(g)
在任意时刻时,
称为浓度商
当该反应在一定温度下达到化学平衡时
=K
K是常数,称为化学平衡常数,简称平衡常数
一、化学平衡常数
K=
mA(g) + nB(g) pC(g) + qD(g)
c为平衡浓度
c为任一时刻浓度
1.化学平衡常数的表达式
化学平衡常数:
浓度商:
一、化学平衡常数
化学平衡常数是表明化学反应限度的一个特征值,通常情况下,只受温度影响。
当反应中有关物质的浓度商等于平衡常数时,表明反应达到限度,即达到化学平衡状态。
2.化学平衡常数的意义
一般来说,K>105时,反应就进行得基本完全
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
一、化学平衡常数
微提醒
平衡常数必须指明温度,反应必须达到平衡状态。
平衡常数表示反应进行的程度,不表示 反应的快慢,
即速率大,K值不一定大。
在进行K值的计算时,纯固体、纯液体不作考虑,表达式中不需表达
Fe3O4(s) + 4H2(g)
高温
3Fe(s) + 4H2O(g)
如:
一定温度下
一、化学平衡常数
N2+3H2 2NH3
2NH3 N2+3H2
某温度下
1/2N2+3/2H2 NH3
微提醒
平衡常数的表达式与方程式的书写有关
方程式的系数扩大n倍,K变为Kn,ΔH变为nΔH;
正反应与逆反应K值互为倒数,ΔH互为相反数;
方程式想加减,ΔH想加减,K值相乘除。
一、化学平衡常数
例1.在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反应,达到平衡后,测得c(H2)=0.008mol/L.
H2(g) + I2(g) 2HI(g)
始(mol/L) 0.010 0.010 0
变(mol/L)
平(mol/L) 0.0080
0.0040
0.0020
0.0020
0.0040
0.0080
K=
C2(HI)
C(H2).C(I2)
=
(0.0040)2
(0.0080)2
=0.25
(1)求反应的平衡常数.
一、化学平衡常数
例1.在某温度下,将H2和I2各0.01mol/L的气态混合物充入10L密闭容器中,充分反应,达到平衡后,测得c(H2)=0.008mol/L.
(1)求反应的平衡常数.
(2)在上述温度下,将H2和I2各0.20mol的气态混合物充入该密闭容器中,试求达到平衡时各物质的浓度.
(2)根据题意:c(H2)=0.020mol/L, c(I2)=0.020mol/L
设H2的变化浓度为xmol L-1
H2 + I2 2HI
始 0.020 0.020 0
变
平
2x
x
x
2x
0.020-x
0.020-x
K只随温度发生变化,因此
K=
C2(HI)
C(H2).C(I2)
=
(2x)2
(0.020-x)2
=0.25
解得x=0.0040mol/L
C(H2)=C(I2)=0.016mol/L
C(HI)=0.0080mol/L
一、化学平衡常数
例2:在容积不变的密闭容器中,将 2.0mol CO和 10mol H2O(g)混合加热到830℃,达到下列平衡:CO(g)+H2O(g) CO2(g)+H2(g) ,此时该反应的k=1.0。求达到平衡时CO转化为CO2的转化率。
起:
K=
C(CO2) ·C(H2)
C(CO) ·C(H2O)
=
(x/y)2
(2.0-x)/y· (10-x)/y )
=1
x=5/3
CO(g) + H2O(g) CO2(g) + H2(g)
催化剂
高温
变:
平:
【解】设达到平衡时CO转化为CO2的物质的量为x mol,容器的容积为yL
转化率为=
×100%
=83%
模块二 化学平衡常数的应用
二、化学平衡常数的应用
1.判断平衡移动的方向
mA(g) + nB(g) pC(g) + qD(g)
K=
c为平衡浓度
平衡常数
c为任一时刻浓度
浓度商
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
二、化学平衡常数的应用
高炉炼铁中发生的基本反应如下: FeO(s)+CO(g) Fe(s)+CO2(g) (条件省略)
已知1100℃,K=0.263,某时刻测得高炉中c(CO2)=0.025mol·L-1,c(CO)=0.1mol·L-1 在这种情况下:
(1)该反应是否处于平衡状态_____(填“是”或“否”);
(2)此时反应会向______进行?(填“正向”或“逆向”);
(3)此时化学反应速率是ν正 _____ν逆(填“大于”、“小于”或“等于”)。
Qc =
c(CO2)
c(CO)
=
0.025mol·L-1
0.1mol·L-1
=0. 25
否
正向
大于
QC<K ,
反应向正方向进行
二、化学平衡常数的应用
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
2.判断反应的热效应
二、化学平衡常数的应用
温度/℃ 200 300 400
K 1.0 0.86 0.5
在0.5 L的密闭容器中,一定量的氮气与氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,其化学平衡常数K与温度的关系如下表所示:
请回答下列问题。
(1)该反应的化学平衡常数表达式为________________,a________(填“大于”“小于”或“等于”)0。
二、化学平衡常数的应用
(2)400 ℃时,2NH3(g)N2(g)+3H2(g)的化学平衡常数为______,测得氨气、氮气、氢气的物质的量分别为3 mol、2 mol、1 mol时,该反应的v正(N2)_______(填“大于”“小于”或“等于”)v逆(N2)。
温度/℃ 200 300 400
K 1.0 0.86 0.5
在0.5 L的密闭容器中,一定量的氮气与氢气进行如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH=a kJ·mol-1,其化学平衡常数K与温度的关系如下表所示:
模块三 速率常数
三、速率常数与平衡常数的换算及应用
已知反应aA(g)+bB(g) cC(g),
反应速率v正=k正ca(A)·cb(B),v逆=k逆cc(C)
1.推导过程
当v正=v逆时,反应达到平衡,即k正ca(A)·cb(B)=k逆cc(C)
=K
ca(A)·cb(B)
cc(C)
=
k正
k逆
2.结论
K=
k正
k逆
三、速率常数与平衡常数的换算及应用
3.例题
合成氨反应N2(g)+3H2(g) 2NH3(g) △H<0是人工固氮的主要手段,对人类生存和经济发展都有着重大意义。合成氨反应中正反应速率v正=k正c(N2) c3(H2),逆反应速率v逆=k逆c2(NH3)。k正、k逆为速率常数。平衡常数K与温度的关系如图。
①表示正反应的平衡常数K与温度变化的曲线为________
(填L1或L2)。
②平衡时,合成氨反应的平衡常数K=________
(用k正、k逆表示)。
L1
k正
k逆
三、速率常数与平衡常数的换算及应用
练:(1)NO2可发生二聚反应生成N2O4,化学方程式为2NO2(g) N2O4(g),
上述反应达到平衡后,升高温度可使体系颜色加深,
则该反应的ΔH________0(填“>”或“<”)。
k正
k逆
<
三、速率常数与平衡常数的换算及应用
练:(2)已知该反应的正反应速率方程为v正=k正·c2(NO2),逆反应速率方程为v逆= k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则如图(lg k表示速率常数的对数; 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lg k正随 变化关系的是斜线________,能表示lgk逆随 变化关系的是斜线________。
T
1
T
1
T
1
③
④
三、速率常数与平衡常数的换算及应用
练:(3)图中A、B、C、D四点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则温度T1时化学平衡常数K=________。已知温度T1时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2 mol·L-1,此时v正____v逆(填“>”或“<”)
10
>
模块四 压强平衡常数
四、压强平衡常数
当把化学平衡常数K表达式中各物质的浓度用该物质的分压来表示时,就得到该反应的压强平衡常数Kp,其表达式的意义相同。
1.压强平衡常数Kp
Kp仅适用于气相发生的反应。
四、压强平衡常数
2.计算方法
第四步:根据平衡常数计算公式代入计算。
第一步:
根据三段式法计算平衡体系中各组分的物质的量或物质的量浓度。
第二步:计算各气体组分的物质的量分数或体积分数。
第三步:根据分压计算公式求出各气体物质的分压。
某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)
四、压强平衡常数
(1)已知:平衡总压为P平
3.Kp的计算模板
N2(g) + 3H2(g) 2NH3(g)
n(平) a b c
p(分压)
第三段
a+b+c
a
×P平
a+b+c
b
×P平
a+b+c
c
×P平
Kp=
a+b+c
a
×P平
( )
3
a+b+c
b
×P平
( )
2
a+b+c
c
×P平
( )
四、压强平衡常数
(2)已知:恒温恒容,初始压强为P0,转换率为α
3.Kp的计算模板
2NO2(g) N2O4(g)
p(起) P0 0
p(转)
P0 α
P0 α
2
1
p(平)
P0-P0 α
P0 α
2
1
Kp=
P0-P0 α
( )
2
P0 α
2
1
四、压强平衡常数
例:工业生产硫酸过程中发生的一个反应为:SO2(g)+ O2(g) ? SO3(g);将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为_________,平衡常数Kp=____________________。
钒催化剂
Δ
2
1
四、压强平衡常数
钒催化剂
Δ
解析: 假设原气体的物质的量为100 mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,则2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:
SO2(g) + O2(g) SO3(g)
2
1
平: 2m(1-α) m(1-α) 2mα
起 : 2m m 0
转: 2mα mα 2mα
平衡时气体的总物质的量为n(总)=[2m(1-α)+m(1-α)+2mα+q] mol,
则SO3的物质的量分数为:
n(总)
n(SO2)
×100%
=
2m(1-α)+m(1-α)+2mα+q
2m(1-α)
四、压强平衡常数
则SO3的物质的量分数为:
n(总)
n(SO2)
×100%
=
2m(1-α)+m(1-α)+2mα+q
2m(1-α)
=
100-mα
2mα
×100%
SO3的分压P(SO3)=
100-mα
2mαp
P(SO2)=
100-mα
2m(1-α)p
P(O2)=
100-mα
m(1-α)p
Kp=
四、压强平衡常数
练1.一定量的CO2与足量的C在恒压密闭容器中发生反应:C(s)+CO2(g) 2CO(g) ΔH=+173 kJ·mol-1,若压强为p kPa,平衡时体系中气体体积分数与温度的关系如图所示,回答下列问题:
(1)650 ℃时CO2的平衡转化率为__________。
(2)t1 ℃时平衡常数Kp=__________
0.5p
25%
课堂总结
K=
mA(g) + nB(g) pC(g) + qD(g)
c为平衡浓度
c为任一时刻浓度
化学平衡常数:
浓度商:
课堂总结
方程式的系数扩大n倍,K变为Kn,ΔH变为nΔH;
正反应与逆反应K值互为倒数,ΔH互为相反数;
方程式想加减,ΔH想加减,K值相乘除。
一般来说,K>105时,反应就进行得基本完全
K值越大,反应进行得越完全,反应物平衡转化率越高;
K值越小,反应进行越不完全,反应物平衡转化率越低。
课堂总结
Q<K ,反应向正方向进行
Q=K ,反应处于平衡状态
Q>K ,反应向逆方向进行
若升高温度,K值增大,则正反应为吸热反应
若升高温度,K值减小,则正反应为放热反应
课堂总结
K=
k正
k逆
某气体的分压=气体总压强×该气体的体积分数(或物质的量分数)
压强平衡常数Kp
