2.2.1化学平衡(教学课件)(共25张PPT)高二化学同步备课系列(人教版2019选择性必修1)
文档属性
| 名称 | 2.2.1化学平衡(教学课件)(共25张PPT)高二化学同步备课系列(人教版2019选择性必修1) |  | |
| 格式 | pptx | ||
| 文件大小 | 14.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-22 17:55:42 | ||
图片预览








文档简介
(共25张PPT)
第1讲 化学平衡
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
模块一 化学平衡
一、化学平衡
1.含义
一定条件下,可逆反应里,正反应速率和逆反应速率相等,
反应混合物中各组分的浓度保持不变的状态。
适用条件:
外在标志:
内在本质:
适用对象:
可逆反应
一定条件
v(正)=v(逆)≠0
反应混合物中各组分的浓度保持不变
一、化学平衡
2.平衡特征
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。平衡移动
模块二 化学平衡状态的判断
二、化学平衡状态的判断
⑤单位时间内有2mol SO2生成,同时有_____O2 ______
2mol
2mol
1mol
2mol
生成
消耗
生成
标志一 :v正=v逆≠0
①单位时间内有2mol SO2消耗,同时有2mol SO2生成;
②单位时间内有2mol SO3生成,同时有_____SO3消耗;
③单位时间内有2mol SO2生成,同时有_____SO3 ______ ;
④单位时间内有1mol O2生成, 同时有_____SO3 ______ ;
二、化学平衡状态的判断
标志一 :v正=v逆≠0
即单位时间内生成与消耗某反应物(生成物)的量相等。
该物质的生成速率与消耗速率相等。
用同一种物质来表示反应速率时
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
用不同种物质来表示反应速率时
必须符合两方面
二、化学平衡状态的判断
标志二:变量不变
(注意不是相等,也不是成一定的比值)
各组分的物质的量或物质的量分数保持不变
各组分的质量或质量分数保持不变
各气体的体积或体积分数保持不变
各组分浓度保持不变
特例:只有生成物有气体时,体积分数始终不变,不是变量
二、化学平衡状态的判断
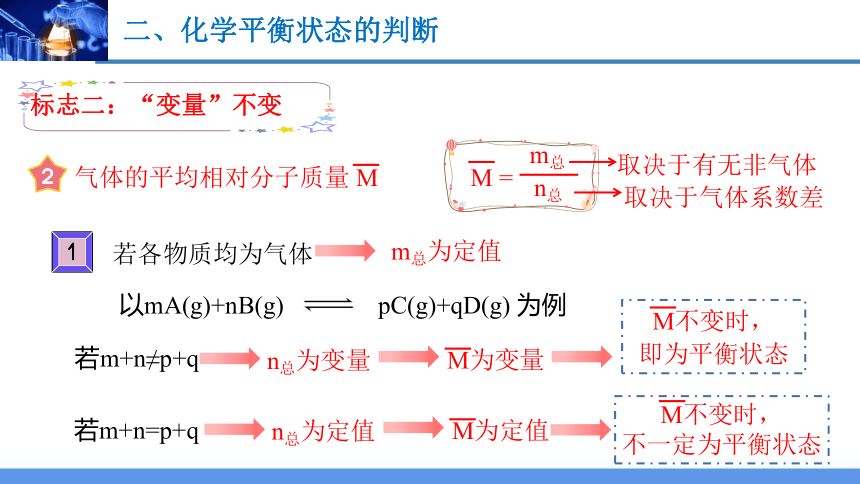
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
以mA(g)+nB(g) pC(g)+qD(g) 为例
若m+n≠p+q
若m+n=p+q
若各物质均为气体
m总为定值
n总为变量
M为变量
M不变时,
即为平衡状态
n总为定值
M为定值
M不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
m总为变量
若有非气体参与
M为变量
M不变时,
即为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
以mA(g)+nB(g) pC(g)+qD(g) 为例
且m+n≠p+q
若各物质均为气体
M不变时,
即为平衡状态
若各物质均为气体,且m+n=p+q
M不变时,
不一定为平衡状态
若有非气体参与
M不变时,
即为平衡状态
二、化学平衡状态的判断
课堂检测
2SO2(g)+O2(g) 2SO3(g) ,
当平均相对分子质量不变时,_______是化学平衡状态
H2(g)+I2(g) 2HI(g)
当平均相对分子质量不变时,_______是化学平衡状态
1.
一定
不一定
2. C(s)+O2(g) CO2(g)
当平均相对分子质量不变时,_______是化学平衡状态
CO2(g)+C(s) 2CO(g)
当平均相对分子质量不变时,_______是化学平衡状态
一定
一定
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
以mA(g)+nB(g) pC(g)+qD(g) 为例
若各物质均为气体
①恒容
m总为定值
ρ为定值
ρ不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
以mA(g)+nB(g) pC(g)+qD(g) 为例
若各物质均为气体
m总为定值
若m+n≠p+q
若m+n=p+q
②恒压
V容器为变量
ρ为变量
ρ不变时,
一定为平衡状态
V容器为定值
ρ为定值量
ρ不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
m总为变量
若有非气体参与
恒压或是恒容
ρ为变量
ρ不变时,
一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
取决于有无非气体
取决于气体系数差
气体密度ρ
若有非气体参与,恒压或是恒容
ρ不变时,
一定为平衡状态
若各物质均为气体
①恒容
ρ不变时,
不一定为平衡状态
②恒压
若m+n≠p+q
若m+n=p+q
ρ =
m总
V容器
二、化学平衡状态的判断
课堂检测
2SO2(g)+O2(g) 2SO3(g) ,
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
H2(g)+I2(g) 2HI(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
不一定
一定
不一定
不一定
二、化学平衡状态的判断
课堂检测
C(s)+O2(g) CO2(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
CO2(g)+C(s) 2CO(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
一定
一定
一定
一定
二、化学平衡状态的判断
标志二:“变量”不变
混合气体总压强
因为恒容、恒温条件下,n(g)越大则压强P就越大,则无论各成份是否均为气体,只需考虑Δn(g)。
当Δn(g)=0,则P为恒值,不一定是化学平衡状态。
PV=nRT
当Δn(g)≠0,则P一定时,一定是化学平衡状态。
二、化学平衡状态的判断
课堂检测
恒容、恒温条件下 ,
C(s)+O2(g) CO2(g)
当体系总压强不变时,_______是化学平衡状态
CO2(g)+C(s) 2CO(g)
当体系总压强不变时,_______是化学平衡状态
2SO2(g)+O2(g) 2SO3(g) ,
当体系总压强不变时,_______是化学平衡状态
H2(g)+I2(g) 2HI(g)
当体系总压强不变时,_______是化学平衡状态
不一定
一定
一定
不一定
二、化学平衡状态的判断
体系的颜色和温度不变
一定为平衡状态
H2 + I2 2HI
△
2NO2 N2O4
红棕色
课堂检测
1.一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化②体系的密度不再发生变化③各组分的物质的量浓度不再改变④各组分的质量分数不再改变⑤反应速率vB∶vC∶vD=n∶p∶q其中,能说明反应已达到平衡的是( )A.只有③④ B.只有②③④C.只有①②③④ D.①②③④⑤
B
课堂检测
2.可逆反应N2(g)+3H2(g)2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
C
课堂检测
3. 40 ℃,向体积为V L的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是( )
A.X是N2OB.1~3 min时,v(NO2)=3V(1) mol·L-1·min-1C.60 ℃下该反应达平衡时NO的量不变D.NO2和X的浓度相等可以作为
判断反应达到平衡的标志
A
课堂总结
1.化学平衡
2.化学平衡状态判断
(2)变量不变,即为平衡
(1)
v正=v逆≠0
第1讲 化学平衡
新人教版 化学 选择性必修一
第二章 化学反应速率与化学平衡
第二节 化学平衡
模块一 化学平衡
一、化学平衡
1.含义
一定条件下,可逆反应里,正反应速率和逆反应速率相等,
反应混合物中各组分的浓度保持不变的状态。
适用条件:
外在标志:
内在本质:
适用对象:
可逆反应
一定条件
v(正)=v(逆)≠0
反应混合物中各组分的浓度保持不变
一、化学平衡
2.平衡特征
逆:可逆反应(或可逆过程)
等: v正 = v逆 (不等于零)
动:正逆反应均未停止,只是速率相等,是动态平衡
定:平衡时,各组分的浓度或含量保持不变
变:条件改变,原平衡被破坏,在新的条件下建立新的平衡。平衡移动
模块二 化学平衡状态的判断
二、化学平衡状态的判断
⑤单位时间内有2mol SO2生成,同时有_____O2 ______
2mol
2mol
1mol
2mol
生成
消耗
生成
标志一 :v正=v逆≠0
①单位时间内有2mol SO2消耗,同时有2mol SO2生成;
②单位时间内有2mol SO3生成,同时有_____SO3消耗;
③单位时间内有2mol SO2生成,同时有_____SO3 ______ ;
④单位时间内有1mol O2生成, 同时有_____SO3 ______ ;
二、化学平衡状态的判断
标志一 :v正=v逆≠0
即单位时间内生成与消耗某反应物(生成物)的量相等。
该物质的生成速率与消耗速率相等。
用同一种物质来表示反应速率时
②速率之比化学方程式中相应的化学计量数之比。
①表示两个不同的方向。
用不同种物质来表示反应速率时
必须符合两方面
二、化学平衡状态的判断
标志二:变量不变
(注意不是相等,也不是成一定的比值)
各组分的物质的量或物质的量分数保持不变
各组分的质量或质量分数保持不变
各气体的体积或体积分数保持不变
各组分浓度保持不变
特例:只有生成物有气体时,体积分数始终不变,不是变量
二、化学平衡状态的判断
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
以mA(g)+nB(g) pC(g)+qD(g) 为例
若m+n≠p+q
若m+n=p+q
若各物质均为气体
m总为定值
n总为变量
M为变量
M不变时,
即为平衡状态
n总为定值
M为定值
M不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
m总为变量
若有非气体参与
M为变量
M不变时,
即为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
气体的平均相对分子质量 M
M =
m总
n总
取决于有无非气体
取决于气体系数差
以mA(g)+nB(g) pC(g)+qD(g) 为例
且m+n≠p+q
若各物质均为气体
M不变时,
即为平衡状态
若各物质均为气体,且m+n=p+q
M不变时,
不一定为平衡状态
若有非气体参与
M不变时,
即为平衡状态
二、化学平衡状态的判断
课堂检测
2SO2(g)+O2(g) 2SO3(g) ,
当平均相对分子质量不变时,_______是化学平衡状态
H2(g)+I2(g) 2HI(g)
当平均相对分子质量不变时,_______是化学平衡状态
1.
一定
不一定
2. C(s)+O2(g) CO2(g)
当平均相对分子质量不变时,_______是化学平衡状态
CO2(g)+C(s) 2CO(g)
当平均相对分子质量不变时,_______是化学平衡状态
一定
一定
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
以mA(g)+nB(g) pC(g)+qD(g) 为例
若各物质均为气体
①恒容
m总为定值
ρ为定值
ρ不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
以mA(g)+nB(g) pC(g)+qD(g) 为例
若各物质均为气体
m总为定值
若m+n≠p+q
若m+n=p+q
②恒压
V容器为变量
ρ为变量
ρ不变时,
一定为平衡状态
V容器为定值
ρ为定值量
ρ不变时,
不一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
ρ =
m总
V容器
取决于有无非气体
取决于气体系数差
气体密度ρ
m总为变量
若有非气体参与
恒压或是恒容
ρ为变量
ρ不变时,
一定为平衡状态
二、化学平衡状态的判断
标志二:“变量”不变
取决于有无非气体
取决于气体系数差
气体密度ρ
若有非气体参与,恒压或是恒容
ρ不变时,
一定为平衡状态
若各物质均为气体
①恒容
ρ不变时,
不一定为平衡状态
②恒压
若m+n≠p+q
若m+n=p+q
ρ =
m总
V容器
二、化学平衡状态的判断
课堂检测
2SO2(g)+O2(g) 2SO3(g) ,
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
H2(g)+I2(g) 2HI(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
不一定
一定
不一定
不一定
二、化学平衡状态的判断
课堂检测
C(s)+O2(g) CO2(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
CO2(g)+C(s) 2CO(g)
恒容条件下,当气体密度不变时,________是化学平衡状态
恒压条件下,当气体密度不变时,________是化学平衡状态
一定
一定
一定
一定
二、化学平衡状态的判断
标志二:“变量”不变
混合气体总压强
因为恒容、恒温条件下,n(g)越大则压强P就越大,则无论各成份是否均为气体,只需考虑Δn(g)。
当Δn(g)=0,则P为恒值,不一定是化学平衡状态。
PV=nRT
当Δn(g)≠0,则P一定时,一定是化学平衡状态。
二、化学平衡状态的判断
课堂检测
恒容、恒温条件下 ,
C(s)+O2(g) CO2(g)
当体系总压强不变时,_______是化学平衡状态
CO2(g)+C(s) 2CO(g)
当体系总压强不变时,_______是化学平衡状态
2SO2(g)+O2(g) 2SO3(g) ,
当体系总压强不变时,_______是化学平衡状态
H2(g)+I2(g) 2HI(g)
当体系总压强不变时,_______是化学平衡状态
不一定
一定
一定
不一定
二、化学平衡状态的判断
体系的颜色和温度不变
一定为平衡状态
H2 + I2 2HI
△
2NO2 N2O4
红棕色
课堂检测
1.一定温度下,在固定容积的密闭容器中,可逆反应:mA(s)+nB(g) pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化②体系的密度不再发生变化③各组分的物质的量浓度不再改变④各组分的质量分数不再改变⑤反应速率vB∶vC∶vD=n∶p∶q其中,能说明反应已达到平衡的是( )A.只有③④ B.只有②③④C.只有①②③④ D.①②③④⑤
B
课堂检测
2.可逆反应N2(g)+3H2(g)2NH3(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )A.3v正(N2)=v正(H2)B.v正(N2)=v逆(NH3)C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
C
课堂检测
3. 40 ℃,向体积为V L的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是( )
A.X是N2OB.1~3 min时,v(NO2)=3V(1) mol·L-1·min-1C.60 ℃下该反应达平衡时NO的量不变D.NO2和X的浓度相等可以作为
判断反应达到平衡的标志
A
课堂总结
1.化学平衡
2.化学平衡状态判断
(2)变量不变,即为平衡
(1)
v正=v逆≠0
