2.3氧化剂和还原剂2 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3氧化剂和还原剂2 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 08:59:46 | ||
图片预览






文档简介
(共18张PPT)
候课要求:
1、打开课本第69页,今天讲氧化剂和还原剂
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
第3节 氧化还原反应
氧化剂和还原剂
1.通过阅读课本69页,能说出氧化剂、还原剂的概念,并学会判断氧化剂、还原剂。(重点)
2.通过从化合价变化的角度,学会分析元素的化合价与物质的氧化性、还原性的关系,并能说出常见的氧化剂和还原剂。(重点)
3.通过从反应方程式的角度,能简单地比较物质氧化性或还原性的强弱。(难点)
学习目标:
一、氧化剂和还原剂
交流研讨:
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
课本69页
目标一
2、氧化性、还原性
还原剂→具有还原性→失电子→化合价升高→被氧化→氧化产物→发生氧化反应
氧化剂→具有氧化性→得电子→化合价降低→被还原→还原产物→发生还原反应
1、定义
氧化剂:在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂
还原剂:在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物称为还原剂
升失氧作还原剂,具有还原性
降得还氧化剂,具有氧化性
一、氧化剂和还原剂
课本69页
目标一
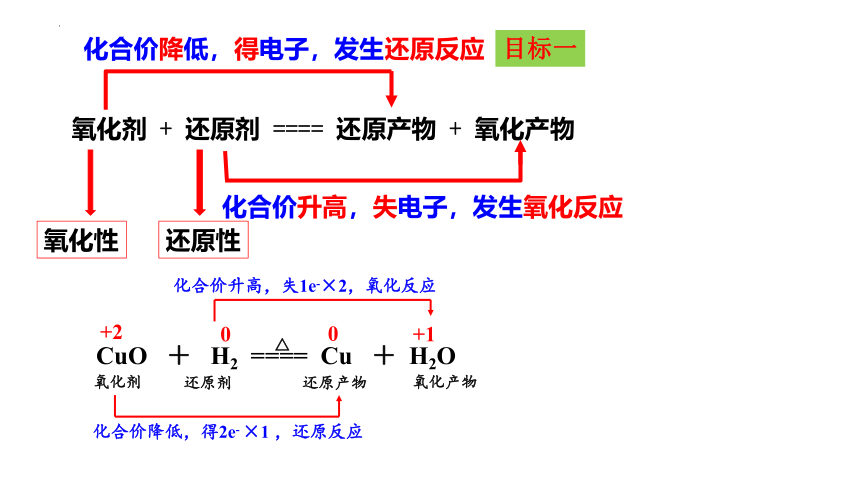
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
还原产物
氧化产物
目标一
0
0
+2
-2
得2e-×2 ,化合价降低,还原反应
失2e-×2,化合价升高,氧化反应
(2) Fe2O3 + 3CO ==== 2Fe + 3CO2
+3
+4
+2
0
失2e-×3 ,化合价升高,氧化反应
得3e-×2,化合价降低,还原反应
(1) 2Cu + O2 ==== 2CuO
△
请用双线桥表示下列反应的电子转移情况,并标出氧化剂、还原剂、氧化产物、还原产物。
氧化剂
氧化剂
还原剂
还原剂
既是氧化产物也是还原产物
还原产物
氧化产物
当堂检测
目标一
二、元素的化合价与物质的氧化性、还原性的关系
铁元素(Fe):
硫元素(S):
0
+2
+3
-2
0
+4
+6
↑
↓
↑
↑
↑
↑
↓
↓
↓
↓
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
[巧记口诀] 高价氧,低价还;中间价态两俱全。
课本69页
目标二
三、常见的氧化剂
F2、Cl2、Br2、 I2 、O2、O3等
MnO2、PbO2等
浓H2SO4、HNO3等
KMnO4、 K2Cr2O7 、 KClO3、FeCl3等
Na2O2、H2O2
1.活泼非金属单质
2. 高价态元素的氧化物
3. 高价态元素的含氧酸
4. 高价态元素的盐
5.过氧化物
具有氧化性,易得电子,高价态物质
课本70页
目标二
四、常见的还原剂
Na、Mg、 Al、Zn、Fe等
H2、C
CO、SO2
盐酸、 H2SO3 、H2S等
Na2SO3、FeSO4
1.活泼金属单质
2.某些非金属单质
4. 低价态元素的酸
5. 低价态元素的盐
3. 低价态元素的氧化物
具有还原性,易失电子,低价态物质
课本70页
目标二
2. 下列说法正确的是( )
A、含最高价元素的化合物,一定具有强氧化性
B、阳离子只有氧化性,阴离子只有还原性
C、失电子越多,还原性越强
D、强氧化剂与强还原剂不一定能发生氧化还原反应
D
B
1. 下列微粒既有氧化性,又有还原性的是( )
A、Mg B、SO2 C、Zn2+ D、I-
注意:氧化性、还原性的强弱只取决于得失电子的难易程度,与得失电子的数目多少无关,如Na比Al的还原性强
当堂检测
目标二
氧化剂 + 还原剂 还原产物 + 氧化产物
化合价降低,得ne-,
化合价升高,失ne-,
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
1、根据反应方程式判断(剂强物弱规律)
口诀:剂强物弱
五、氧化性和还原性强弱比较
目标三
根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
①Fe+ Cu2+ == Fe2+ + Cu
②2Fe3+ + Cu == 2Fe2+ + Cu2+
Cu2+ > Fe3+ > Fe2+
Fe > Cu > Fe2+
Fe2+ > Cu2+ > Fe3+
B
当堂检测
目标三
1.下列变化中,必须加入还原剂才能实现的是( )
A、NaCl→AgCl B、H2O→O2
C、KClO3→KCl D、MnO2→MnCl2
-2 0
+4 +2
+5 -1
D
-1 -1
2.对于反应NaH+H2O====NaOH+H2↑,下列叙述正确的是( )
①H2是还原剂;②H2O是氧化剂;
③NaH既是氧化剂,又是还原剂;
④NaH中氢元素被还原;
⑤被氧化的氢原子与被还原氢原子个数比为1:1。
A、①③⑤ B、②④ C、②⑤ D、②④⑤
C
-1 +1 +1 0
当堂检测
目标一
D
当堂检测
3.下列反应中,SO2被还原的是( )
A.SO2 + 2NaOH = Na2SO3+H2O
B. SO2+Cl2+2H2O = H2SO4+2HCl
C.SO2+2H2S = 3S ↓+2H2O
D.SO2+NO2 = SO3+NO
C
目标二和三
口诀:单强离弱
2
2
2
2
①2KMnO4 + 16HCl(浓) = 2KCl+2MnCl2 + 5Cl2↑+
8H2O, ②MnO2 + 4 HCl(浓) = MnCl2 + Cl2↑+ 2H2O,
反应①较容易,氧化性:KMnO4> MnO2
3. 根据变价元素被氧化或被还原的程度判断
4. 根据反应进行的难易程度(反应条件)判断
2Fe+3Cl2==2FeCl3 , Fe+S=FeS,变价金属Fe被Cl2氧化为+3价,而S只能将Fe氧化+2价,氧化性: Cl2 >S
△
点燃
候课要求:
1、打开课本第69页,今天讲氧化剂和还原剂
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
第3节 氧化还原反应
氧化剂和还原剂
1.通过阅读课本69页,能说出氧化剂、还原剂的概念,并学会判断氧化剂、还原剂。(重点)
2.通过从化合价变化的角度,学会分析元素的化合价与物质的氧化性、还原性的关系,并能说出常见的氧化剂和还原剂。(重点)
3.通过从反应方程式的角度,能简单地比较物质氧化性或还原性的强弱。(难点)
学习目标:
一、氧化剂和还原剂
交流研讨:
以下氧化还原反应中,化合价升高的元素有哪些,化合价降低的元素有哪些?哪种反应物含有化合价升高的元素,哪种反应物含有化合价降低的元素?
课本69页
目标一
2、氧化性、还原性
还原剂→具有还原性→失电子→化合价升高→被氧化→氧化产物→发生氧化反应
氧化剂→具有氧化性→得电子→化合价降低→被还原→还原产物→发生还原反应
1、定义
氧化剂:在氧化还原反应中,所含某种(或某些)元素化合价降低的反应物称为氧化剂
还原剂:在氧化还原反应中,所含某种(或某些)元素化合价升高的反应物称为还原剂
升失氧作还原剂,具有还原性
降得还氧化剂,具有氧化性
一、氧化剂和还原剂
课本69页
目标一
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
化合价降低,得电子,发生还原反应
化合价升高,失电子,发生氧化反应
氧化性
还原性
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
还原产物
氧化产物
目标一
0
0
+2
-2
得2e-×2 ,化合价降低,还原反应
失2e-×2,化合价升高,氧化反应
(2) Fe2O3 + 3CO ==== 2Fe + 3CO2
+3
+4
+2
0
失2e-×3 ,化合价升高,氧化反应
得3e-×2,化合价降低,还原反应
(1) 2Cu + O2 ==== 2CuO
△
请用双线桥表示下列反应的电子转移情况,并标出氧化剂、还原剂、氧化产物、还原产物。
氧化剂
氧化剂
还原剂
还原剂
既是氧化产物也是还原产物
还原产物
氧化产物
当堂检测
目标一
二、元素的化合价与物质的氧化性、还原性的关系
铁元素(Fe):
硫元素(S):
0
+2
+3
-2
0
+4
+6
↑
↓
↑
↑
↑
↑
↓
↓
↓
↓
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
[巧记口诀] 高价氧,低价还;中间价态两俱全。
课本69页
目标二
三、常见的氧化剂
F2、Cl2、Br2、 I2 、O2、O3等
MnO2、PbO2等
浓H2SO4、HNO3等
KMnO4、 K2Cr2O7 、 KClO3、FeCl3等
Na2O2、H2O2
1.活泼非金属单质
2. 高价态元素的氧化物
3. 高价态元素的含氧酸
4. 高价态元素的盐
5.过氧化物
具有氧化性,易得电子,高价态物质
课本70页
目标二
四、常见的还原剂
Na、Mg、 Al、Zn、Fe等
H2、C
CO、SO2
盐酸、 H2SO3 、H2S等
Na2SO3、FeSO4
1.活泼金属单质
2.某些非金属单质
4. 低价态元素的酸
5. 低价态元素的盐
3. 低价态元素的氧化物
具有还原性,易失电子,低价态物质
课本70页
目标二
2. 下列说法正确的是( )
A、含最高价元素的化合物,一定具有强氧化性
B、阳离子只有氧化性,阴离子只有还原性
C、失电子越多,还原性越强
D、强氧化剂与强还原剂不一定能发生氧化还原反应
D
B
1. 下列微粒既有氧化性,又有还原性的是( )
A、Mg B、SO2 C、Zn2+ D、I-
注意:氧化性、还原性的强弱只取决于得失电子的难易程度,与得失电子的数目多少无关,如Na比Al的还原性强
当堂检测
目标二
氧化剂 + 还原剂 还原产物 + 氧化产物
化合价降低,得ne-,
化合价升高,失ne-,
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
1、根据反应方程式判断(剂强物弱规律)
口诀:剂强物弱
五、氧化性和还原性强弱比较
目标三
根据下列反应判断有关物质还原性由强到弱的顺序是 ( )
①Fe+ Cu2+ == Fe2+ + Cu
②2Fe3+ + Cu == 2Fe2+ + Cu2+
Cu2+ > Fe3+ > Fe2+
Fe > Cu > Fe2+
Fe2+ > Cu2+ > Fe3+
B
当堂检测
目标三
1.下列变化中,必须加入还原剂才能实现的是( )
A、NaCl→AgCl B、H2O→O2
C、KClO3→KCl D、MnO2→MnCl2
-2 0
+4 +2
+5 -1
D
-1 -1
2.对于反应NaH+H2O====NaOH+H2↑,下列叙述正确的是( )
①H2是还原剂;②H2O是氧化剂;
③NaH既是氧化剂,又是还原剂;
④NaH中氢元素被还原;
⑤被氧化的氢原子与被还原氢原子个数比为1:1。
A、①③⑤ B、②④ C、②⑤ D、②④⑤
C
-1 +1 +1 0
当堂检测
目标一
D
当堂检测
3.下列反应中,SO2被还原的是( )
A.SO2 + 2NaOH = Na2SO3+H2O
B. SO2+Cl2+2H2O = H2SO4+2HCl
C.SO2+2H2S = 3S ↓+2H2O
D.SO2+NO2 = SO3+NO
C
目标二和三
口诀:单强离弱
2
2
2
2
①2KMnO4 + 16HCl(浓) = 2KCl+2MnCl2 + 5Cl2↑+
8H2O, ②MnO2 + 4 HCl(浓) = MnCl2 + Cl2↑+ 2H2O,
反应①较容易,氧化性:KMnO4> MnO2
3. 根据变价元素被氧化或被还原的程度判断
4. 根据反应进行的难易程度(反应条件)判断
2Fe+3Cl2==2FeCl3 , Fe+S=FeS,变价金属Fe被Cl2氧化为+3价,而S只能将Fe氧化+2价,氧化性: Cl2 >S
△
点燃
