2.3 氧化还原反应1 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3 氧化还原反应1 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:01:20 | ||
图片预览



文档简介
(共18张PPT)
候课要求:
1、打开课本第66页,今天讲氧化还原反应
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
课本66页
第3节 氧化还原反应
第1课时
1.通过阅读课本67页,能说出氧化还原反应的概念、特征、及实质。(重点)
2.通过探究氧化还原的实质,从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,建立证据推理与模型认知的核心素养。(重难点)
学习目标:
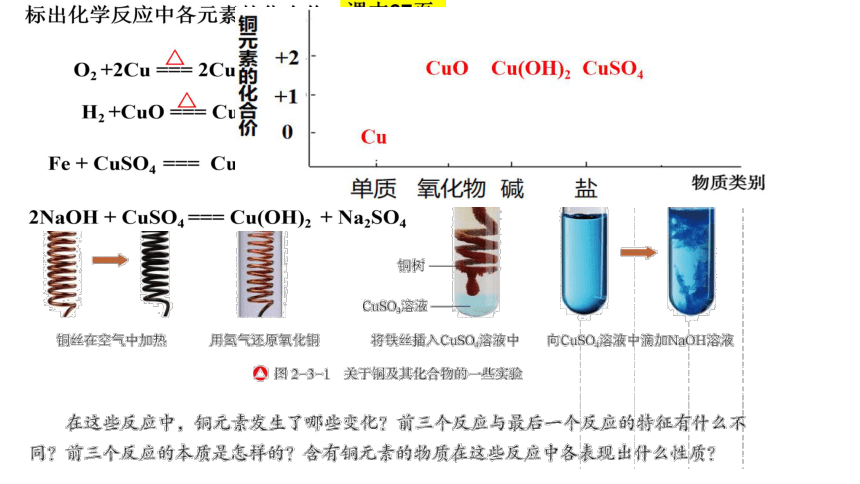
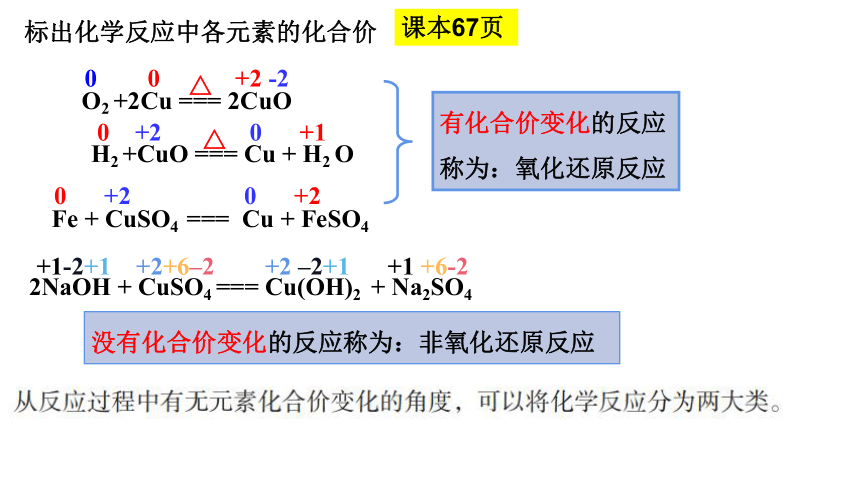
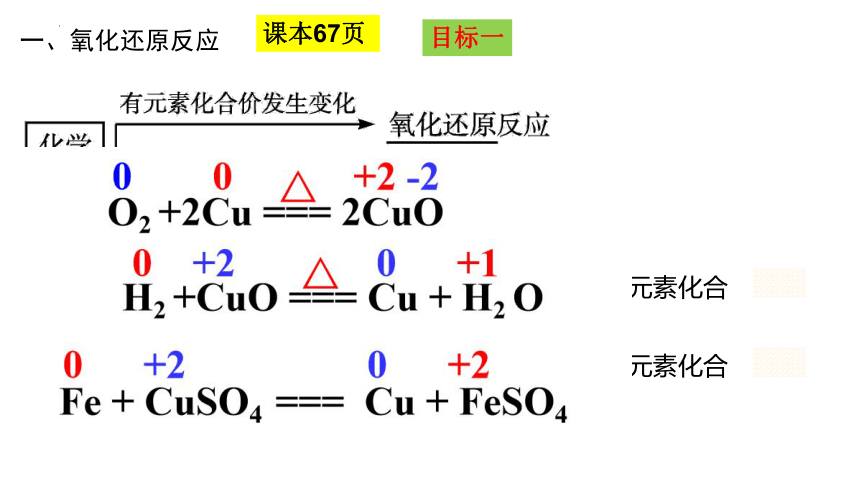
标出化学反应中各元素的化合价
2NaOH + CuSO4 === Cu(OH)2 + Na2SO4
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
0 +2 0 +1
0 +2 0 +2
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称为:氧化还原反应
O2 +2Cu === 2CuO
0 0 +2 -2
△
课本67页
一、氧化还原反应
(1)氧化反应:在氧化还原反应中,反应物所含某种或某些元素化合价升高的反应。
(2)还原反应:在氧化还原反应中,反应物所含某种或某些元素化合价降低的反应。
课本67页
目标一
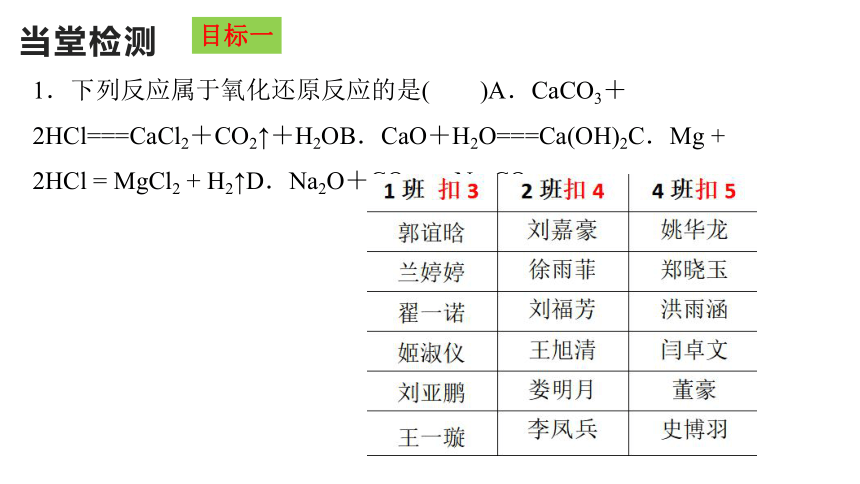
1.下列反应属于氧化还原反应的是( )A.CaCO3+2HCl===CaCl2+CO2↑+H2OB.CaO+H2O===Ca(OH)2C.Mg + 2HCl = MgCl2 + H2↑D.Na2O+CO2===Na2CO3
当堂检测
目标一
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1.金属钠可以在氯气中剧烈地燃烧并生成氯化钠。这个反应属于氧化还原反应吗?氯气由氯分子构成,一个氯分子由两个氯原子构成。金属钠由钠原子构成。氯化钠由Na+和Cl-构成。可见在反应过程中,钠原子变成了Na+ ,氯原子变成了Cl- 。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
交流研讨:
2Na+Cl2===2NaCl
点燃
课本67页
目标一
Na+ Cl-
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
化合价的升降——电子的得失
2Na + Cl2 ==== 2NaCl
点燃
化合价变化本质的原因分析
2
2
2+
2+
2.写出铁与CuSO4溶液反应的化学方程式,判断该反应是否属于氧化还原反应。按照图2-3-2所示实验装置进行铁与CuSO4溶液反应的实验,实验现象之一是电流表指针发生偏转。这一实验现象对于你认识铁与CuSO4溶液反应的实质有什么启示?
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去2e-
得到2e-
(实质) (特征)
某元素得到电子
化合价降低
还原反应
某元素失去电子
化合价升高
氧化反应
升失氧,降得还
2、氧化还原反应的实质
--电子的转移
课本67页
目标一
当堂检测
1.氧化还原反应的实质是( )
A.氧元素的得失 B.化合价的升降
C.电子转移 D.分子中原子的重新组合
目标一
我们能否方便直观地表示出氧化还原反应中的电子转移情况呢?
我……
【想一想】
Fe + Cu2+ = Fe2+ + Cu
+2
0
+2
0
化合价升高,失2e-,氧化反应
化合价降低,得2e-,还原反应
Fe + Cu2+ = Fe2+ + Cu
+2
0
+2
0
2e-
注意事项
①箭头、箭尾指向化合价变化的同种元素
②必须注明“得到”或“失去”字样③失去电子总数=得到电子总数。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标明电子转移的总数,不标“得、失”。
双线桥
单线桥
二、氧化还原反应的表示方法:
课本68页
目标二
(1)CuO + H2 ==== Cu + H2O
△
请用双线桥表示下列反应的电子转移情况。
【当堂检测】
(2)Fe2O3 + 3CO ==== 2Fe + 3CO2
目标二
课堂小结
当堂检测:
判断以下反应是不是氧化还原反应
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
氧化还原反应与四大基本反应类型的关系
化合反应
复分解反应
置换反应
小结:
有单质参加的化合反应是氧化还原反应
有单质生成的分解反应是氧化还原反应
置换反应属于氧化还原反应
复分解反应不是氧化还原反应
候课要求:
1、打开课本第66页,今天讲氧化还原反应
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
课本66页
第3节 氧化还原反应
第1课时
1.通过阅读课本67页,能说出氧化还原反应的概念、特征、及实质。(重点)
2.通过探究氧化还原的实质,从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,建立证据推理与模型认知的核心素养。(重难点)
学习目标:
标出化学反应中各元素的化合价
2NaOH + CuSO4 === Cu(OH)2 + Na2SO4
H2 +CuO === Cu + H2 O
△
Fe + CuSO4 === Cu + FeSO4
+1-2+1 +2+6–2 +2 –2+1 +1 +6-2
0 +2 0 +1
0 +2 0 +2
没有化合价变化的反应称为:非氧化还原反应
有化合价变化的反应称为:氧化还原反应
O2 +2Cu === 2CuO
0 0 +2 -2
△
课本67页
一、氧化还原反应
(1)氧化反应:在氧化还原反应中,反应物所含某种或某些元素化合价升高的反应。
(2)还原反应:在氧化还原反应中,反应物所含某种或某些元素化合价降低的反应。
课本67页
目标一
1.下列反应属于氧化还原反应的是( )A.CaCO3+2HCl===CaCl2+CO2↑+H2OB.CaO+H2O===Ca(OH)2C.Mg + 2HCl = MgCl2 + H2↑D.Na2O+CO2===Na2CO3
当堂检测
目标一
思考:在氧化还原反应中,元素化合价为什么会变化 ?
1.金属钠可以在氯气中剧烈地燃烧并生成氯化钠。这个反应属于氧化还原反应吗?氯气由氯分子构成,一个氯分子由两个氯原子构成。金属钠由钠原子构成。氯化钠由Na+和Cl-构成。可见在反应过程中,钠原子变成了Na+ ,氯原子变成了Cl- 。钠原子和氯原子是怎样变化为Na+和Cl-并进而形成氯化钠的呢?
交流研讨:
2Na+Cl2===2NaCl
点燃
课本67页
目标一
Na+ Cl-
Na
Cl
+11
2
8
1
2
8
7
+17
e-
Cl-
Na+
+11
2
8
2
8
8
+17
化合价的升降——电子的得失
2Na + Cl2 ==== 2NaCl
点燃
化合价变化本质的原因分析
2
2
2+
2+
2.写出铁与CuSO4溶液反应的化学方程式,判断该反应是否属于氧化还原反应。按照图2-3-2所示实验装置进行铁与CuSO4溶液反应的实验,实验现象之一是电流表指针发生偏转。这一实验现象对于你认识铁与CuSO4溶液反应的实质有什么启示?
Fe + CuSO4==== FeSO4 + Cu
0
0
+2
+2
失去2e-
得到2e-
(实质) (特征)
某元素得到电子
化合价降低
还原反应
某元素失去电子
化合价升高
氧化反应
升失氧,降得还
2、氧化还原反应的实质
--电子的转移
课本67页
目标一
当堂检测
1.氧化还原反应的实质是( )
A.氧元素的得失 B.化合价的升降
C.电子转移 D.分子中原子的重新组合
目标一
我们能否方便直观地表示出氧化还原反应中的电子转移情况呢?
我……
【想一想】
Fe + Cu2+ = Fe2+ + Cu
+2
0
+2
0
化合价升高,失2e-,氧化反应
化合价降低,得2e-,还原反应
Fe + Cu2+ = Fe2+ + Cu
+2
0
+2
0
2e-
注意事项
①箭头、箭尾指向化合价变化的同种元素
②必须注明“得到”或“失去”字样③失去电子总数=得到电子总数。
注意事项
①单线桥必须画在反应物中。
②箭头指向得电子元素,箭尾指向失电子元素。
③标明电子转移的总数,不标“得、失”。
双线桥
单线桥
二、氧化还原反应的表示方法:
课本68页
目标二
(1)CuO + H2 ==== Cu + H2O
△
请用双线桥表示下列反应的电子转移情况。
【当堂检测】
(2)Fe2O3 + 3CO ==== 2Fe + 3CO2
目标二
课堂小结
当堂检测:
判断以下反应是不是氧化还原反应
SO3+H2O = H2SO4
2Cu+O2+CO2+H2O= Cu2 (OH)2CO3
CaCO3 CaO+CO2↑
2KClO3 2KCl+3O2 ↑
Fe+H2SO4(稀) =FeSO4 + H2↑
Fe2O3+3C 2Fe+3CO↑
Ba(OH)2+H2SO4=BaSO4 ↓+2H2O
AgNO3+NaCl = AgCl↓ + NaNO3
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
置换反应
复分解反应
化合反应
分解反应
氧化还原反应与四大基本反应类型的关系
化合反应
复分解反应
置换反应
小结:
有单质参加的化合反应是氧化还原反应
有单质生成的分解反应是氧化还原反应
置换反应属于氧化还原反应
复分解反应不是氧化还原反应
