2.2.2电解质 (2) 课件(14张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2.2电解质 (2) 课件(14张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:02:21 | ||
图片预览





文档简介
(共14张PPT)
候课要求:
1、打开课本第55页,导学案44页,今天强弱电解质
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
电解质
第二课时
主讲人:刘荣
1.通过阅读课本55页,能够说出强电解质和弱电解质的含义,并能列举常见的强电解质和弱电解质;
2.通过学习电解质的电离,会书写常见强、弱电解质的电离方程式,并从电离的角度认识酸、碱、盐;
3.通过学习电解质的类别,体会物质的多样性。
学习目标
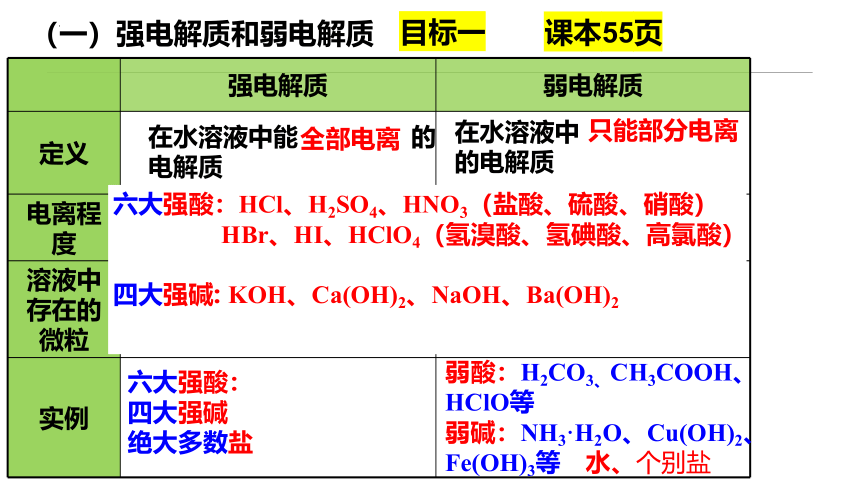
(一)强电解质和弱电解质
强电解质 弱电解质
定义
电离程度
溶液中存在的微粒
实例
在水溶液中能 的电解质
在水溶液中 的电解质
阴、阳离子、不存在分子
弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等 水、个别盐
既有阴、阳离子,又有电解质分子
全部电离
只能部分电离
完全电离
部分电离
六大强酸:
四大强碱
绝大多数盐
六大强酸:HCl、H2SO4、HNO3(盐酸、硫酸、硝酸)
HBr、HI、HClO4(氢溴酸、氢碘酸、高氯酸)
四大强碱: KOH、Ca(OH)2、NaOH、Ba(OH)2
目标一
课本55页
想一想
强电解质溶液一定比弱电解质溶液的导电性强吗?电解质溶液导电能力的强弱取决于什么?
答案:不一定,取决于溶液中自由移动的离子浓度大小及所带的电荷数,离子浓度越大,所带电荷越多,电解质溶液导电能力越强。
(二)电解质的电离方程式
1、强、弱电解质电离方程式书写原则:
①强电解质的完全电离用“=”;
②弱电解质的电离方程式用可逆符号表示部分电离,“ ”。
练习:写出下列物质在水溶液的电离方程式:HClO 、H2SO4、NH3·H2O、Ba(OH)2 、NaHSO4、NaHCO3
目标二
必须拍照上传答案的学生:
1班:兰婷婷、赵紫涵、肖冰芮
2班:袁嘉焱、邢昊坤、王佳琦
4班:樊露晴、史博羽、张新若
(二)电解质的电离
练习1: 写出下列物质的电离方程式:HClO 、H2SO4 。
H2SO4 === 2H+ + SO42-
HClO H+ + ClO-
酸:电离时生成的 全部是 的化合物。
阳离子
氢离子
目标二
练习2:
写出下列碱的电离方程式:NH3·H2O、Ba(OH)2 。
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
阴离子
氢氧根离子
(二)电解质的电离
NH3·H2O NH4+ + OH-
目标二
练习3
写出下列盐的电离方程式:NaHSO4、NaHCO3
盐:电离时能生成 (还包括 )和 的化合物。
金属阳离子
铵根离子
酸根阴离子
(二)电解质的电离
NaHCO3 === Na+ + HCO3 -
NaHSO4 === Na+ + H+ + SO42-
目标二
当堂检测
1、判断正误
①能电离出H+的化合物都是酸 ( )
②盐酸溶液中不存在HCl ( )
③强电解质溶液的导电性一定比弱电解质强 ( )
④固体NaCl不能导电 ( )
⑤盐中一定存在金属阳离子 ( )
╳
╳
╳
√
√
2、写出下列物质在水溶液中的电离方程式
①CH3COOH
②BaSO4
③H2CO3
目标一和二
目标二
电解质
弱电解质
强电解质
课堂小结
六大强酸:HCl、H2SO4、HNO3
HBr、HI、HClO4
四大强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2
绝大多数盐
弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等
水、个别盐
酸、碱、盐、金属氧化物、水
1.下列化合物中属于弱电解质的是( )
A.BaCO3 B.Ba(OH)2
C.CO2 D.NH3·H2O
D
当堂检测
2.下列电解质在水溶液中的电离方程式书写正确的是( )
A.H2SO4 = H+ + SO42- B.Ca(OH)2 = Ca2+ + (OH)2-
C.FeCl3 = Fe3+ + 3Cl- D.NaHCO3 = Na+ + H+ + CO32-
C
目标一
目标二
当堂检测
3.现有:①铁片 ②NaCl ③氨水 ④醋酸 ⑤酒精 ⑥硝酸 ⑦稀硫酸 ⑧KOH ⑨蔗糖 ⑩HClO 熔融的KCl其中属于混合物的是 ,
属于化合物的是 ,
属于电解质的是 ,
属于非电解质的是 ,
属于强电解质的是 ,
属于弱电解质的是 ,
既不是电解质又不是非电解质的是 。
能导电的有_____________________.
目标一
候课要求:
1、打开课本第55页,导学案44页,今天强弱电解质
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
电解质
第二课时
主讲人:刘荣
1.通过阅读课本55页,能够说出强电解质和弱电解质的含义,并能列举常见的强电解质和弱电解质;
2.通过学习电解质的电离,会书写常见强、弱电解质的电离方程式,并从电离的角度认识酸、碱、盐;
3.通过学习电解质的类别,体会物质的多样性。
学习目标
(一)强电解质和弱电解质
强电解质 弱电解质
定义
电离程度
溶液中存在的微粒
实例
在水溶液中能 的电解质
在水溶液中 的电解质
阴、阳离子、不存在分子
弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等 水、个别盐
既有阴、阳离子,又有电解质分子
全部电离
只能部分电离
完全电离
部分电离
六大强酸:
四大强碱
绝大多数盐
六大强酸:HCl、H2SO4、HNO3(盐酸、硫酸、硝酸)
HBr、HI、HClO4(氢溴酸、氢碘酸、高氯酸)
四大强碱: KOH、Ca(OH)2、NaOH、Ba(OH)2
目标一
课本55页
想一想
强电解质溶液一定比弱电解质溶液的导电性强吗?电解质溶液导电能力的强弱取决于什么?
答案:不一定,取决于溶液中自由移动的离子浓度大小及所带的电荷数,离子浓度越大,所带电荷越多,电解质溶液导电能力越强。
(二)电解质的电离方程式
1、强、弱电解质电离方程式书写原则:
①强电解质的完全电离用“=”;
②弱电解质的电离方程式用可逆符号表示部分电离,“ ”。
练习:写出下列物质在水溶液的电离方程式:HClO 、H2SO4、NH3·H2O、Ba(OH)2 、NaHSO4、NaHCO3
目标二
必须拍照上传答案的学生:
1班:兰婷婷、赵紫涵、肖冰芮
2班:袁嘉焱、邢昊坤、王佳琦
4班:樊露晴、史博羽、张新若
(二)电解质的电离
练习1: 写出下列物质的电离方程式:HClO 、H2SO4 。
H2SO4 === 2H+ + SO42-
HClO H+ + ClO-
酸:电离时生成的 全部是 的化合物。
阳离子
氢离子
目标二
练习2:
写出下列碱的电离方程式:NH3·H2O、Ba(OH)2 。
碱:电离时生成的 全部是 的化合物。
Ba(OH)2 === Ba2+ + 2OH-
阴离子
氢氧根离子
(二)电解质的电离
NH3·H2O NH4+ + OH-
目标二
练习3
写出下列盐的电离方程式:NaHSO4、NaHCO3
盐:电离时能生成 (还包括 )和 的化合物。
金属阳离子
铵根离子
酸根阴离子
(二)电解质的电离
NaHCO3 === Na+ + HCO3 -
NaHSO4 === Na+ + H+ + SO42-
目标二
当堂检测
1、判断正误
①能电离出H+的化合物都是酸 ( )
②盐酸溶液中不存在HCl ( )
③强电解质溶液的导电性一定比弱电解质强 ( )
④固体NaCl不能导电 ( )
⑤盐中一定存在金属阳离子 ( )
╳
╳
╳
√
√
2、写出下列物质在水溶液中的电离方程式
①CH3COOH
②BaSO4
③H2CO3
目标一和二
目标二
电解质
弱电解质
强电解质
课堂小结
六大强酸:HCl、H2SO4、HNO3
HBr、HI、HClO4
四大强碱:KOH、Ca(OH)2、NaOH、Ba(OH)2
绝大多数盐
弱酸:H2CO3、CH3COOH、HClO等
弱碱:NH3·H2O、Cu(OH)2、Fe(OH)3等
水、个别盐
酸、碱、盐、金属氧化物、水
1.下列化合物中属于弱电解质的是( )
A.BaCO3 B.Ba(OH)2
C.CO2 D.NH3·H2O
D
当堂检测
2.下列电解质在水溶液中的电离方程式书写正确的是( )
A.H2SO4 = H+ + SO42- B.Ca(OH)2 = Ca2+ + (OH)2-
C.FeCl3 = Fe3+ + 3Cl- D.NaHCO3 = Na+ + H+ + CO32-
C
目标一
目标二
当堂检测
3.现有:①铁片 ②NaCl ③氨水 ④醋酸 ⑤酒精 ⑥硝酸 ⑦稀硫酸 ⑧KOH ⑨蔗糖 ⑩HClO 熔融的KCl其中属于混合物的是 ,
属于化合物的是 ,
属于电解质的是 ,
属于非电解质的是 ,
属于强电解质的是 ,
属于弱电解质的是 ,
既不是电解质又不是非电解质的是 。
能导电的有_____________________.
目标一
