2.2 离子反应(1) 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.2 离子反应(1) 课件(18张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 10.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:03:04 | ||
图片预览





文档简介
(共18张PPT)
写出下列电解质的电离方程式
(1). H2SO4
(2). Ba(OH)2
(3). MgCl2
(4). BaSO4
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
MgCl2 Mg2+ +2Cl-
BaSO4 Ba 2+ + SO4 2-
溶液 溶液中的真实微粒
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
MgCl2 Mg2+ +2Cl-
BaSO4
第3课时 电解质在水溶液中的反应
离子反应
学习目标
1.通过观看实验视频并阅读课本58页,能说出离子反应的含义、实质及其发生的条件;(重点)
2.通过对离子反应的理解,会书写化学反应的离子方程式;(重难点)
3. 通过学习离子反应的实质,养成从现象看本质的思想。
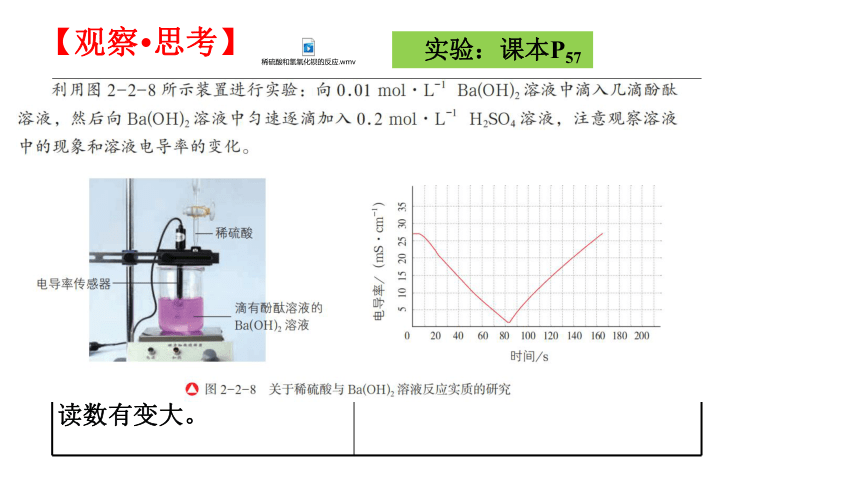
【观察·思考】
实验:课本P57
实验现象 原因分析
溶液中不断产生白色沉淀,红色逐渐变浅,直至消失。
电流表指针不断偏向零,
继续滴加稀硫酸,电流表读数有变大。
1.滴有酚酞溶液的Ba(OH)2溶液由红色变成无色,说明H+与OH-发生了反应;
2.生成白色沉淀,说明Ba2+与SO42-发生了反应;
3.指针的偏转反应出溶液中离子浓度的减小,说明离子参加了反应;
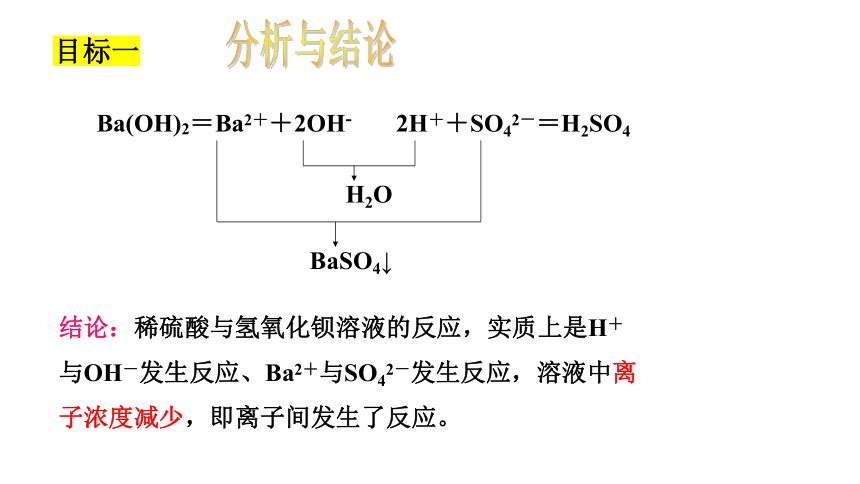
分析与结论
Ba(OH)2=Ba2++2OH-
2H++SO42-=H2SO4
H2O
BaSO4↓
结论:稀硫酸与氢氧化钡溶液的反应,实质上是H+与OH-发生反应、Ba2+与SO42-发生反应,溶液中离子浓度减少,即离子间发生了反应。
目标一
一、离子反应
1.离子反应:
在溶液中有离子参加的化学反应。
2.离子反应发生的条件
离子反应发生的条件
生成难溶物
生成挥发性物质
生成难电离的物质
生成沉淀
生成气体
生成水
复分解反应发生的条件
目标一
课本58页
三者满足其一即可发生
离子反应的实质是溶液中某种或某些离子浓度的改变
下列能发生离子反应的是( )
A KCl 溶液与 NaOH溶液混合
B AgNO3溶液与 NaCl溶液混合
C Na2CO3溶液与Ca(OH)2溶液混合
D NaCl溶液与 Ca(NO3)2溶液混合
练习2
B C
当堂检测
目标一
二、离子方程式
1、定义:用实际参加反应的离子的符号来表示离子反应的式子。
怎样书写一个离子反应的离子方程式呢?
目标二
课本58页
2、离子方程式的书写
(1)明确反应物反应在溶液中的主要存在形式。对于
易溶于水且易电离(即可溶于水的强电解质)的反应物写出其电离方程式,其他反应物则用化学式表示。
如:H2SO4 = 2H+ +SO42- Ba(OH)2 = Ba2++2OH-
例:写出H2SO4与Ba(OH)2反应的离子方程式。
目标二
课本59页
溶液 溶液混合前
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
2、离子方程式的书写
例:写出H2SO4与Ba(OH)2反应的离子方程式。
(2)判断上述微粒中哪些能够相互作用生成难溶(沉淀)、难电离(弱电解质)或挥发性物质(气体),用化学式表示这些物质。
目标二
课本59页
溶液 溶液混合前 溶液混合后
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
2、离子方程式的书写
(3)综合前两步,写出离子方程式,并配平。
(遵守质量守恒即原子守恒和电荷守恒)
反应的离子符号或化学式 = 生成物的化学式或离子符号
如:硫酸与氢氧化钡在溶液中反应的离子方程式为:
2H++2OH-+ Ba2++SO42- = 2H2O + BaSO4 ↓
目标二
课本59页
总结:
离子方程式的书写过程:
1、确定反应物的书写形式(以化学式还是离子的形式)
2、确定生成物的书写形式(以化学式还是离子的形式)
3、书写正确的离子方程式(注意原子守恒和电荷守恒)
判断物质是以离子形式书写还是以化学形式书写的方法
离子符号表示的是:可溶于水的强电解质
用化学式表示:(弱电解质、沉淀、气体、单质、氧化物)
当堂检测
(1)CuSO4溶液与NaOH溶液
(2)Na2CO3溶液与稀盐酸
(3)CaCO3溶液与稀盐酸
(4)NaCl溶液与AgNO3溶液
书写下列反应的离子方程式
目标二
完成课本58页第1题四个反应的离子方程式。
H++OH- = H2O
当堂检测
Ba2++SO42- = BaSO4 ↓
(1)NaOH溶液与稀硫酸
(2)KOH与稀盐酸
(3)BaCl2溶液与Na2SO4溶液
(4)Ba(NO3)2溶液与Na2SO4溶液
目标二
课本59页
3、离子方程式的意义
①不仅可以表示一定物质间的某一反应,还可以表示所有同一类型的反应。
②揭示了化学反应的实质
课本60页
电解质
在水溶液中
自由离子
一定条件
发生离子反应
离子反应方程式
某些离子浓度变化
参加反 应的离子
结果
课堂小结
生成难溶物
生成挥发性物质
生成难电离的物质
易溶水且易电离物需写出电离方程式
难溶、难电离物仍写化学式
气体、单质和氧化物仍写化学式
当堂检测
1.下列各组物质相互混合后,不会发生离子反应的是( )
A.稀硫酸与氯化铜溶液
B.氢氧化钠溶液与氯化亚铁溶液
C.碳酸钠溶液与稀硝酸
D.澄清石灰水与稀盐酸
2.能用H++OH-=H2O表示的化学反应是( )
A.稀硫酸与氢氧化钡溶液反应
B.稀盐酸与氢氧化钠溶液反应
C.稀盐酸与氢氧化铜反应
D.稀硝酸与氢氧化铝反应
A
B
目标二
目标一
3.下列离子方程式不正确的是( )A.氢氧化钡溶液与盐酸反应:OH- + H+ = H2O B.锌投入到稀硫酸中:Zn + 2H+ = Zn2+ + H2↑C.碳酸钠溶液与盐酸反应:2H+ + Na2CO3 = H2O + CO2↑+ 2Na+ D.金属钠与水反应:2Na + 2H2O = 2Na+ + 2OH- + H2↑
C
目标二
写出下列电解质的电离方程式
(1). H2SO4
(2). Ba(OH)2
(3). MgCl2
(4). BaSO4
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
MgCl2 Mg2+ +2Cl-
BaSO4 Ba 2+ + SO4 2-
溶液 溶液中的真实微粒
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
MgCl2 Mg2+ +2Cl-
BaSO4
第3课时 电解质在水溶液中的反应
离子反应
学习目标
1.通过观看实验视频并阅读课本58页,能说出离子反应的含义、实质及其发生的条件;(重点)
2.通过对离子反应的理解,会书写化学反应的离子方程式;(重难点)
3. 通过学习离子反应的实质,养成从现象看本质的思想。
【观察·思考】
实验:课本P57
实验现象 原因分析
溶液中不断产生白色沉淀,红色逐渐变浅,直至消失。
电流表指针不断偏向零,
继续滴加稀硫酸,电流表读数有变大。
1.滴有酚酞溶液的Ba(OH)2溶液由红色变成无色,说明H+与OH-发生了反应;
2.生成白色沉淀,说明Ba2+与SO42-发生了反应;
3.指针的偏转反应出溶液中离子浓度的减小,说明离子参加了反应;
分析与结论
Ba(OH)2=Ba2++2OH-
2H++SO42-=H2SO4
H2O
BaSO4↓
结论:稀硫酸与氢氧化钡溶液的反应,实质上是H+与OH-发生反应、Ba2+与SO42-发生反应,溶液中离子浓度减少,即离子间发生了反应。
目标一
一、离子反应
1.离子反应:
在溶液中有离子参加的化学反应。
2.离子反应发生的条件
离子反应发生的条件
生成难溶物
生成挥发性物质
生成难电离的物质
生成沉淀
生成气体
生成水
复分解反应发生的条件
目标一
课本58页
三者满足其一即可发生
离子反应的实质是溶液中某种或某些离子浓度的改变
下列能发生离子反应的是( )
A KCl 溶液与 NaOH溶液混合
B AgNO3溶液与 NaCl溶液混合
C Na2CO3溶液与Ca(OH)2溶液混合
D NaCl溶液与 Ca(NO3)2溶液混合
练习2
B C
当堂检测
目标一
二、离子方程式
1、定义:用实际参加反应的离子的符号来表示离子反应的式子。
怎样书写一个离子反应的离子方程式呢?
目标二
课本58页
2、离子方程式的书写
(1)明确反应物反应在溶液中的主要存在形式。对于
易溶于水且易电离(即可溶于水的强电解质)的反应物写出其电离方程式,其他反应物则用化学式表示。
如:H2SO4 = 2H+ +SO42- Ba(OH)2 = Ba2++2OH-
例:写出H2SO4与Ba(OH)2反应的离子方程式。
目标二
课本59页
溶液 溶液混合前
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
2、离子方程式的书写
例:写出H2SO4与Ba(OH)2反应的离子方程式。
(2)判断上述微粒中哪些能够相互作用生成难溶(沉淀)、难电离(弱电解质)或挥发性物质(气体),用化学式表示这些物质。
目标二
课本59页
溶液 溶液混合前 溶液混合后
H2SO4 2H+ +SO42-
Ba(OH)2 Ba2++2OH-
2、离子方程式的书写
(3)综合前两步,写出离子方程式,并配平。
(遵守质量守恒即原子守恒和电荷守恒)
反应的离子符号或化学式 = 生成物的化学式或离子符号
如:硫酸与氢氧化钡在溶液中反应的离子方程式为:
2H++2OH-+ Ba2++SO42- = 2H2O + BaSO4 ↓
目标二
课本59页
总结:
离子方程式的书写过程:
1、确定反应物的书写形式(以化学式还是离子的形式)
2、确定生成物的书写形式(以化学式还是离子的形式)
3、书写正确的离子方程式(注意原子守恒和电荷守恒)
判断物质是以离子形式书写还是以化学形式书写的方法
离子符号表示的是:可溶于水的强电解质
用化学式表示:(弱电解质、沉淀、气体、单质、氧化物)
当堂检测
(1)CuSO4溶液与NaOH溶液
(2)Na2CO3溶液与稀盐酸
(3)CaCO3溶液与稀盐酸
(4)NaCl溶液与AgNO3溶液
书写下列反应的离子方程式
目标二
完成课本58页第1题四个反应的离子方程式。
H++OH- = H2O
当堂检测
Ba2++SO42- = BaSO4 ↓
(1)NaOH溶液与稀硫酸
(2)KOH与稀盐酸
(3)BaCl2溶液与Na2SO4溶液
(4)Ba(NO3)2溶液与Na2SO4溶液
目标二
课本59页
3、离子方程式的意义
①不仅可以表示一定物质间的某一反应,还可以表示所有同一类型的反应。
②揭示了化学反应的实质
课本60页
电解质
在水溶液中
自由离子
一定条件
发生离子反应
离子反应方程式
某些离子浓度变化
参加反 应的离子
结果
课堂小结
生成难溶物
生成挥发性物质
生成难电离的物质
易溶水且易电离物需写出电离方程式
难溶、难电离物仍写化学式
气体、单质和氧化物仍写化学式
当堂检测
1.下列各组物质相互混合后,不会发生离子反应的是( )
A.稀硫酸与氯化铜溶液
B.氢氧化钠溶液与氯化亚铁溶液
C.碳酸钠溶液与稀硝酸
D.澄清石灰水与稀盐酸
2.能用H++OH-=H2O表示的化学反应是( )
A.稀硫酸与氢氧化钡溶液反应
B.稀盐酸与氢氧化钠溶液反应
C.稀盐酸与氢氧化铜反应
D.稀硝酸与氢氧化铝反应
A
B
目标二
目标一
3.下列离子方程式不正确的是( )A.氢氧化钡溶液与盐酸反应:OH- + H+ = H2O B.锌投入到稀硫酸中:Zn + 2H+ = Zn2+ + H2↑C.碳酸钠溶液与盐酸反应:2H+ + Na2CO3 = H2O + CO2↑+ 2Na+ D.金属钠与水反应:2Na + 2H2O = 2Na+ + 2OH- + H2↑
C
目标二
