3.1.1亚铁盐和铁盐 课件(16张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.1.1亚铁盐和铁盐 课件(16张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:09:06 | ||
图片预览





文档简介
(共16张PPT)
候课要求:
1、打开课本第86页,导学案71页,今天铁的多样性--亚铁盐和铁盐
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
知识回顾:
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
每天进步一点点,坚持带来大改变!
高价氧,低价还,中间价态两俱全
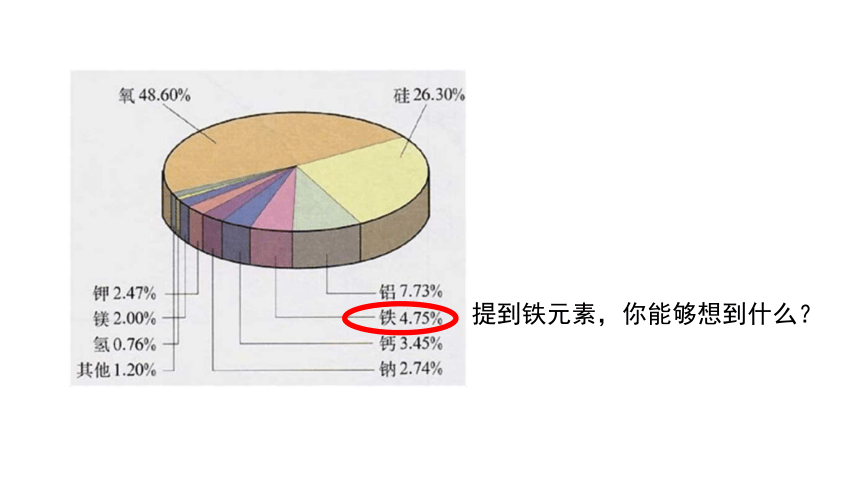
提到铁元素,你能够想到什么?
铁的多样性
第1课时--亚铁盐和铁盐
主讲人:刘荣
1.通过阅读课本86页,能说出铁在自然界中的存在形态及在日常生活中的应用;
2.通过实验探究,能够说出亚铁盐和铁盐的化学性质,并会书写相关方程式;(重难点)
学习目标
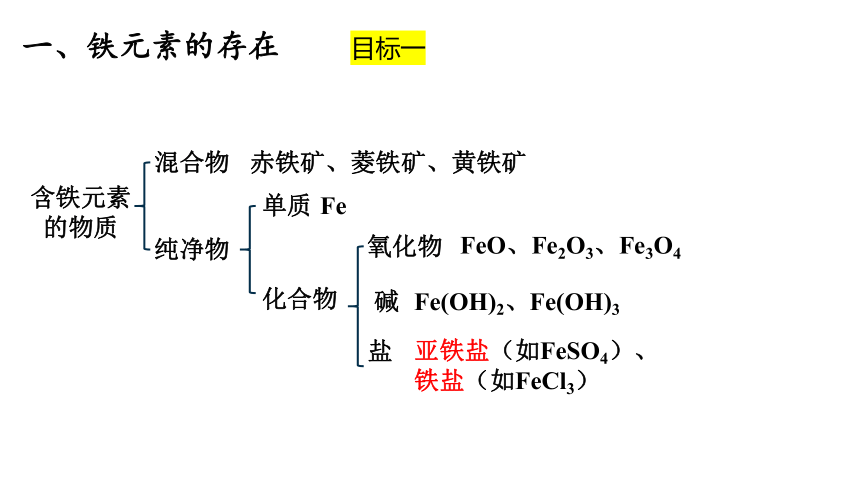
一、铁元素的存在
目标一
课本86页
单质
氧化物
化合物
碱
盐
混合物
纯净物
含铁元素
的物质
Fe
亚铁盐(如FeSO4)、铁盐(如FeCl3)
FeO、Fe2O3、Fe3O4
Fe(OH)2、Fe(OH)3
赤铁矿、菱铁矿、黄铁矿
一、铁元素的存在
目标一
二、亚铁盐和铁盐
亚铁盐:组成中含有Fe2+的盐,如FeSO4、FeCl2、Fe(NO3)2等
铁盐:组成中含有Fe3+的盐,如Fe2(SO4)3、FeCl3、Fe(NO3)3等
1、常见的亚铁盐和铁盐
目标二
课本87页
思考:
1. 说明预测性质和选取试剂的思路。
2. 什么样的实验现象可以作为证据支持你所预测的亚铁盐和铁盐的性质?
3. 总结亚铁盐和铁盐的性质。
4. 实验室里如何保存 FeSO4 溶液?为什么?
目标二
课本87页
课本88页
预测与假设:亚铁盐和铁盐的性质
1.从物质类别的角度
亚铁盐
铁盐
FeSO4
FeCl3
碱
氢氧化亚铁(白色沉淀)
碱
氢氧化铁(红褐色沉淀)
2.从氧化还原反应的规律(化合价)的角度
既具有还原性
又具有氧化性
+2
FeSO4
氧化性
+3
FeCl3
①能与碱反应
硫酸亚铁 ②可作还原剂
③可作氧化剂
氯化铁 ①能与碱反应
②可作氧化剂
目标二
验证 实验方案 现象
①验证FeSO4能与碱反应 向盛有FeSO4溶液的试管中滴加NaOH溶液,观察实验现象 产生__色沉淀
②验证FeSO4具有还原性,可作还原剂 向盛有FeSO4溶液的试管中先滴加KSCN溶液,再滴加氯水,观察溶液颜色变化
向盛有酸性KMnO4溶液的试管中滴加FeSO4溶液,观察溶液颜色变化。 酸性KMnO4溶液变为_____色
③验证FeSO4具有氧化性,可作氧化剂 向盛有锌片的试管中加入FeSO4溶液,放置一段时间,观察实验现象 Zn表面变____
目标二
课本89页
滴加硫氰酸钾溶液不变红,滴加氯水,溶液变红
验证 实验方案 现象
①验证FeCl3能与碱反应 向盛有FeCl3溶液的试管中加入NaOH溶液 产生_____色沉淀
②FeCl3具有氧化性,可作氧化剂 向盛有铁粉的试管中加入FeCl3溶液,振荡后观察溶液颜色变化 溶液由______色变为______色
向盛有FeCl3溶液的试管中插入铜丝,放置一段时间后,观察实验现象。 溶液变为_____色
向盛有FeCl3溶液的试管中加入KI溶液和淀粉溶液,观察溶液颜色变化。 溶液变为_____色
目标二
课本88页
1、亚铁盐的性质
(1)与碱的反应
Fe2++2OH-=Fe(OH)2↓
(2)氧化性
Fe2++Zn=Fe+Zn2+
(3)还原性
2Fe2++Cl2=2Fe3++2Cl-
小结:
2、铁盐的性质
(1)与碱的反应
Fe3++3OH-=Fe(OH)3↓
(2)氧化性
2Fe3++2I-=2Fe2++I2
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Fe=3Fe2+
实验室保存FeSO4溶液,加入铁粉防止Fe2+被氧化
常用于工业腐蚀线路板
能被酸性高锰酸钾氧化
目标二
在FeSO4溶液里加铁钉或铁粉防止溶液里的Fe2+
被氧化
2Fe3++Fe=3Fe2+
FeSO4溶液保存
FeSO4
学以致用
2Fe3++Cu=2Fe2++Cu2+
目标二
当堂检测:
1.下列试剂加入KSCN溶液,生成红色溶液的是( ) A FeCl2 B. FeCl3 C. Fe2O3 D. Fe(OH)3
2.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是( )A.FeO B.Fe2O3 C.FeCl3 D.Fe2(SO4)33.下列反应中,体现Fe3+氧化性的是( )(多选)A.FeCl3溶液加入NaOH溶液产生红褐色沉淀
B.FeCl3溶液加入AgNO3溶液产生白色沉淀C.FeCl3溶液加入铁粉,铁粉消失
D.FeCl3溶液加入KI-淀粉溶液,溶液变蓝
目标二
目标二
目标二
候课要求:
1、打开课本第86页,导学案71页,今天铁的多样性--亚铁盐和铁盐
2、准备黑红颜色的笔各一只,准备好演草纸
3、课上认真听讲,积极回答问题
知识回顾:
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
每天进步一点点,坚持带来大改变!
高价氧,低价还,中间价态两俱全
提到铁元素,你能够想到什么?
铁的多样性
第1课时--亚铁盐和铁盐
主讲人:刘荣
1.通过阅读课本86页,能说出铁在自然界中的存在形态及在日常生活中的应用;
2.通过实验探究,能够说出亚铁盐和铁盐的化学性质,并会书写相关方程式;(重难点)
学习目标
一、铁元素的存在
目标一
课本86页
单质
氧化物
化合物
碱
盐
混合物
纯净物
含铁元素
的物质
Fe
亚铁盐(如FeSO4)、铁盐(如FeCl3)
FeO、Fe2O3、Fe3O4
Fe(OH)2、Fe(OH)3
赤铁矿、菱铁矿、黄铁矿
一、铁元素的存在
目标一
二、亚铁盐和铁盐
亚铁盐:组成中含有Fe2+的盐,如FeSO4、FeCl2、Fe(NO3)2等
铁盐:组成中含有Fe3+的盐,如Fe2(SO4)3、FeCl3、Fe(NO3)3等
1、常见的亚铁盐和铁盐
目标二
课本87页
思考:
1. 说明预测性质和选取试剂的思路。
2. 什么样的实验现象可以作为证据支持你所预测的亚铁盐和铁盐的性质?
3. 总结亚铁盐和铁盐的性质。
4. 实验室里如何保存 FeSO4 溶液?为什么?
目标二
课本87页
课本88页
预测与假设:亚铁盐和铁盐的性质
1.从物质类别的角度
亚铁盐
铁盐
FeSO4
FeCl3
碱
氢氧化亚铁(白色沉淀)
碱
氢氧化铁(红褐色沉淀)
2.从氧化还原反应的规律(化合价)的角度
既具有还原性
又具有氧化性
+2
FeSO4
氧化性
+3
FeCl3
①能与碱反应
硫酸亚铁 ②可作还原剂
③可作氧化剂
氯化铁 ①能与碱反应
②可作氧化剂
目标二
验证 实验方案 现象
①验证FeSO4能与碱反应 向盛有FeSO4溶液的试管中滴加NaOH溶液,观察实验现象 产生__色沉淀
②验证FeSO4具有还原性,可作还原剂 向盛有FeSO4溶液的试管中先滴加KSCN溶液,再滴加氯水,观察溶液颜色变化
向盛有酸性KMnO4溶液的试管中滴加FeSO4溶液,观察溶液颜色变化。 酸性KMnO4溶液变为_____色
③验证FeSO4具有氧化性,可作氧化剂 向盛有锌片的试管中加入FeSO4溶液,放置一段时间,观察实验现象 Zn表面变____
目标二
课本89页
滴加硫氰酸钾溶液不变红,滴加氯水,溶液变红
验证 实验方案 现象
①验证FeCl3能与碱反应 向盛有FeCl3溶液的试管中加入NaOH溶液 产生_____色沉淀
②FeCl3具有氧化性,可作氧化剂 向盛有铁粉的试管中加入FeCl3溶液,振荡后观察溶液颜色变化 溶液由______色变为______色
向盛有FeCl3溶液的试管中插入铜丝,放置一段时间后,观察实验现象。 溶液变为_____色
向盛有FeCl3溶液的试管中加入KI溶液和淀粉溶液,观察溶液颜色变化。 溶液变为_____色
目标二
课本88页
1、亚铁盐的性质
(1)与碱的反应
Fe2++2OH-=Fe(OH)2↓
(2)氧化性
Fe2++Zn=Fe+Zn2+
(3)还原性
2Fe2++Cl2=2Fe3++2Cl-
小结:
2、铁盐的性质
(1)与碱的反应
Fe3++3OH-=Fe(OH)3↓
(2)氧化性
2Fe3++2I-=2Fe2++I2
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Fe=3Fe2+
实验室保存FeSO4溶液,加入铁粉防止Fe2+被氧化
常用于工业腐蚀线路板
能被酸性高锰酸钾氧化
目标二
在FeSO4溶液里加铁钉或铁粉防止溶液里的Fe2+
被氧化
2Fe3++Fe=3Fe2+
FeSO4溶液保存
FeSO4
学以致用
2Fe3++Cu=2Fe2++Cu2+
目标二
当堂检测:
1.下列试剂加入KSCN溶液,生成红色溶液的是( ) A FeCl2 B. FeCl3 C. Fe2O3 D. Fe(OH)3
2.将下列四种铁的化合物溶于稀盐酸,滴加KSCN溶液没有颜色变化,再加入氯水即呈红色的是( )A.FeO B.Fe2O3 C.FeCl3 D.Fe2(SO4)33.下列反应中,体现Fe3+氧化性的是( )(多选)A.FeCl3溶液加入NaOH溶液产生红褐色沉淀
B.FeCl3溶液加入AgNO3溶液产生白色沉淀C.FeCl3溶液加入铁粉,铁粉消失
D.FeCl3溶液加入KI-淀粉溶液,溶液变蓝
目标二
目标二
目标二
