2.3.1共价键的极性 课件(24张)2022-2023学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.3.1共价键的极性 课件(24张)2022-2023学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:13:45 | ||
图片预览



文档简介
(共24张PPT)
第二章 分子结构与性质
Autumn
第三节 分子结构与物质的性质
第1课时 共价键的极性
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
知识回顾——共价键
【思考】化学键存在极性的本质原因是什么?
由于不同的成键电子间的电负性的差异,共用电子对会发生偏移,偏移的程度越大,共价键的极性越强,在反应中越容易发生断裂。
【练习】指出下列物质中的共价键类型
O2 CH4 CO2 H2O2 Na2O2 NaOH
(H-O-O-H)
Cl
:
:
: :
Cl
:
: :
H Cl
:
:
: :
δ+ δ-
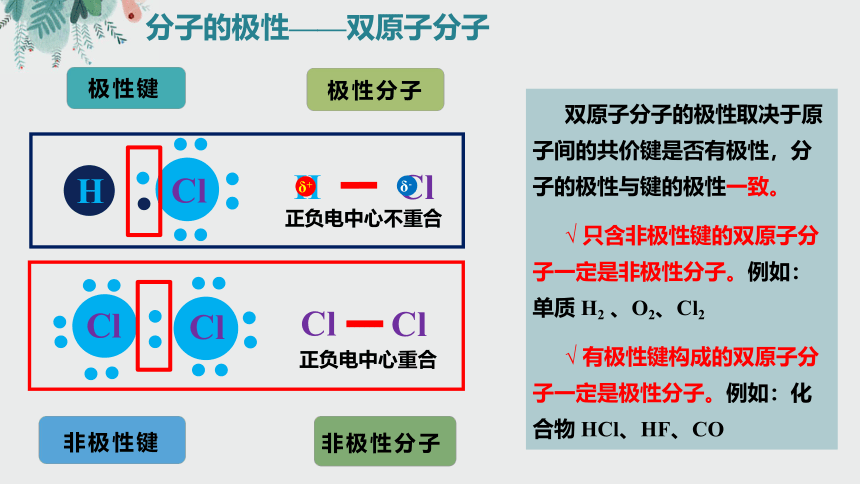
分子的极性——双原子分子
非极性键
极性键
非极性分子
极性分子
Cl
Cl
Cl
Cl
H
Cl
H
Cl
δ+
δ-
正负电中心不重合
正负电中心重合
双原子分子的极性取决于原子间的共价键是否有极性,分子的极性与键的极性一致。
√ 只含非极性键的双原子分子一定是非极性分子。例如:单质 H2 、O2、Cl2
√ 有极性键构成的双原子分子一定是极性分子。例如:化合物 HCl、HF、CO
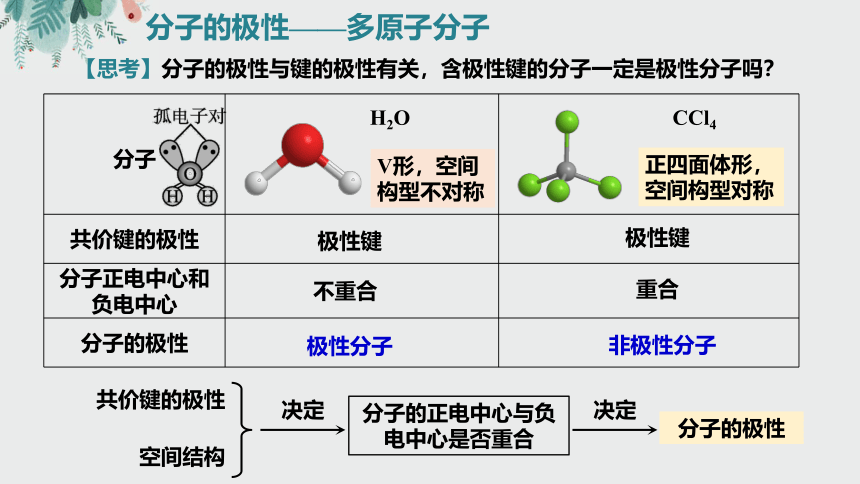
分子的极性——多原子分子
【思考】分子的极性与键的极性有关,含极性键的分子一定是极性分子吗?
分子 H2O CCl4
共价键的极性
分子正电中心和负电中心
分子的极性
极性键
极性键
极性分子
非极性分子
V形,空间构型不对称
正四面体形,空间构型对称
共价键的极性
空间结构
决定
分子的正电中心与负电中心是否重合
决定
分子的极性
不重合
重合
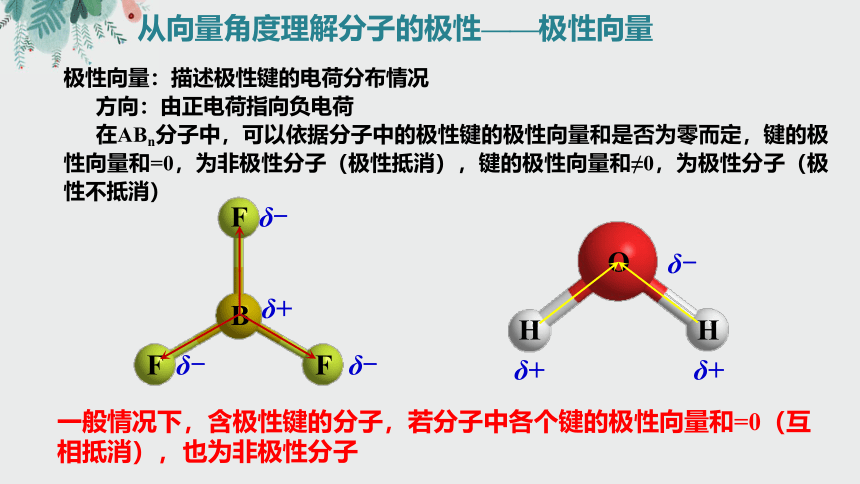
从向量角度理解分子的极性——极性向量
极性向量:描述极性键的电荷分布情况
方向:由正电荷指向负电荷
在ABn分子中,可以依据分子中的极性键的极性向量和是否为零而定,键的极性向量和=0,为非极性分子(极性抵消),键的极性向量和≠0,为极性分子(极性不抵消)
CO2
HCN
正电中心与负电中心重合
非极性分子
大小相等,方向相反
向量和为0
大小不相等,方向相同
向量和不为0
正电中心与负电中心不重合
极性分子
从向量角度理解分子的极性——极性向量
B
F
F
F
δ+
δ-
δ-
δ-
O
H
H
δ+
δ-
δ+
一般情况下,含极性键的分子,若分子中各个键的极性向量和=0(互相抵消),也为非极性分子
极性向量:描述极性键的电荷分布情况
方向:由正电荷指向负电荷
在ABn分子中,可以依据分子中的极性键的极性向量和是否为零而定,键的极性向量和=0,为非极性分子(极性抵消),键的极性向量和≠0,为极性分子(极性不抵消)
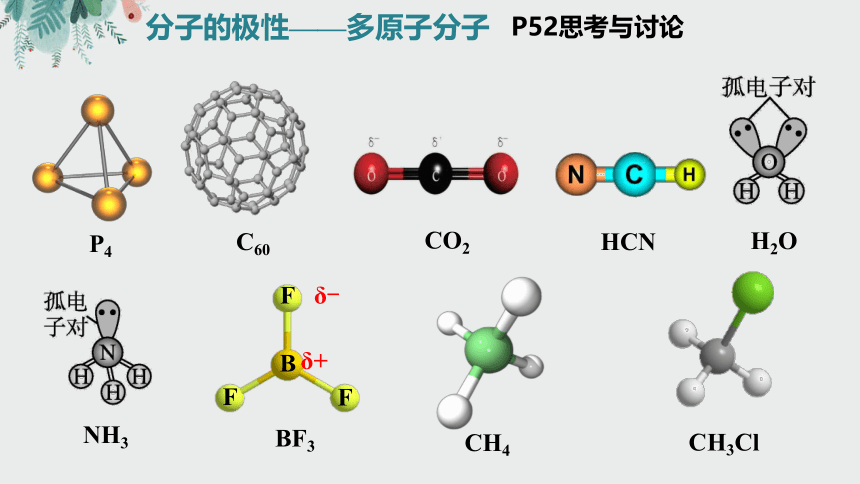
分子的极性——多原子分子
P4
B
F
F
F
CH4
CH3Cl
C60
δ+
δ-
HCN
BF3
NH3
H2O
CO2
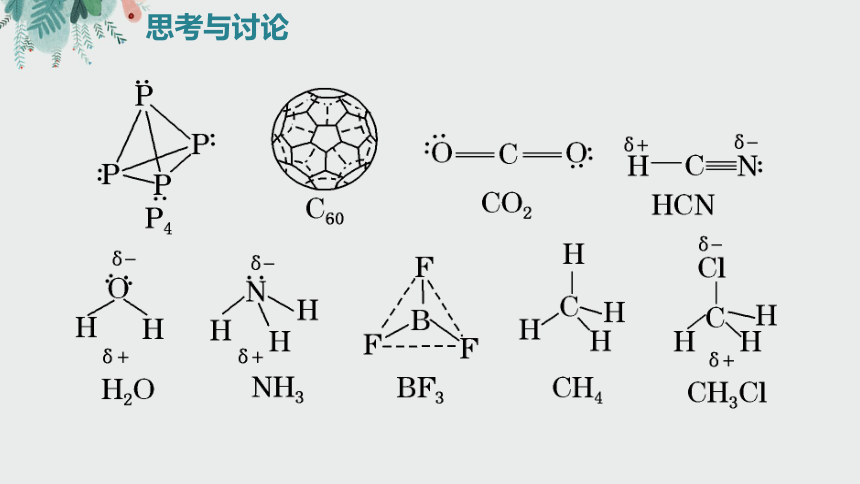
P52思考与讨论
思考与讨论
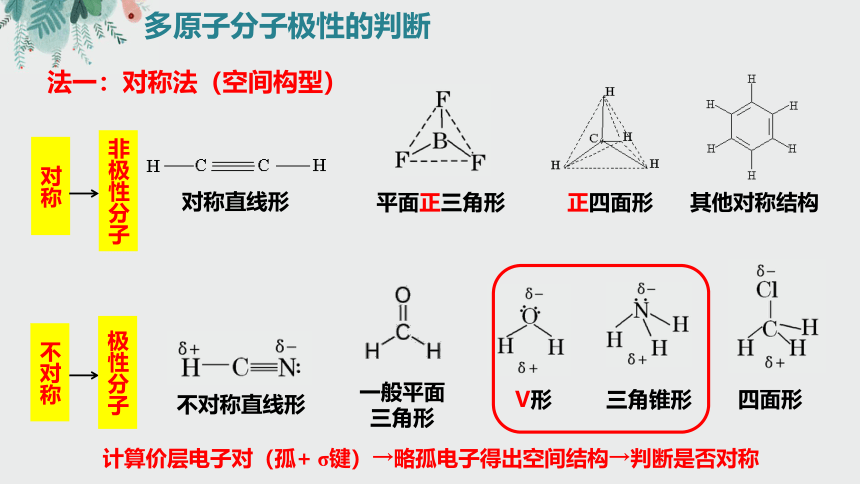
多原子分子极性的判断
对称
法一:对称法(空间构型)
对称直线形
平面正三角形
正四面形
其他对称结构
非极性分子
不对称
极性分子
不对称直线形
一般平面三角形
V形
三角锥形
四面形
计算价层电子对(孤+ σ键)→略孤电子得出空间结构→判断是否对称
①稀有气体分子(He、Ne)是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
特别关注——H2O2与O3的结构
多原子分子极性的判断
法二:化合价法
对于ABn型分子
(1)中心原子的化合价的绝对值=该元素的价电子数,该分子为非极性分子,此时分子的空间结构是对称的。
(2)中心原子的化合价的绝对值 ≠ 其价电子数 ,则分子的空间结构不是对称的,其分子为极性分子。
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
|化合价|
价层电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性分子
极性分子
注意:CFCl3等需要看对不对称
科普小能手
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
明辨是非
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.只含有非极性键的分子一定是非极性分子( )
6.H2O、CO2、CH4都是非极性分子。( )
√
×
×
×
×
√
课堂反馈
1.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
D
A
2.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
素养提升
多原子分子极性的判断
法二:化合价法
对于ABn型分子
(1)中心原子的化合价的绝对值=该元素的价电子数,该分子为非极性分子,此时分子的空间结构是对称的。
(2)中心原子的化合价的绝对值 ≠ 其价电子数 ,则分子的空间结构不是对称的,其分子为极性分子。
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
|化合价|
价层电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性分子
极性分子
注意:CFCl3等需要看对不对称
思考与交流
2Na+2H2O==2NaOH+H2↑
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
键的极性对化学性质的影响
分子的结构
共价键的极性
物质的化学性质
羧酸是一大类含羧基( COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可以用pKa的大小来衡量。
pKa (pKa= lgKa)
pKa越小,酸性越强
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
思考:三氟乙酸的酸性为什么强于三氯乙酸?
δ- δ+
F C C O H
O
F
F
δ- δ+
Cl C C O H
O
Cl
Cl
吸电子基团
吸电子基团
电负性:F>Cl
极性变更大
极性变大
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
思考:三氟乙酸的酸性为什么强于三氯乙酸?
氟的电负性大于氯的电负性,F C的极性>Cl C的极性;使F3C 的极性>Cl3C 的极性,导致三氟乙酸在羧基中的羟基极性增强,易电离出H+。
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
δ- δ+
Cl C C O H
O
吸电子基团
极性变大
Cl原子数目越多,吸引电子能力越大
使羧基中的羟基极性越大
羧酸的酸性越强
酸性:三氯乙酸>二氯乙酸>氯乙酸
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
δ- δ+
R C O H
O
推电子基团
极性变小
烃基越长,推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
酸性:甲酸>乙酸>丙酸
键的极性对化学性质的影响
学以致用
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
课堂反馈
1.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
A
2.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥
C.①④ D.①③④⑤
C
第二章 分子结构与性质
Autumn
第三节 分子结构与物质的性质
第1课时 共价键的极性
共价键
极性共价键
非极性共价键
由不同原子形成的共价键,电子对会发生偏移
由相同原子形成的共价键,电子对不发生偏移
知识回顾——共价键
【思考】化学键存在极性的本质原因是什么?
由于不同的成键电子间的电负性的差异,共用电子对会发生偏移,偏移的程度越大,共价键的极性越强,在反应中越容易发生断裂。
【练习】指出下列物质中的共价键类型
O2 CH4 CO2 H2O2 Na2O2 NaOH
(H-O-O-H)
Cl
:
:
: :
Cl
:
: :
H Cl
:
:
: :
δ+ δ-
分子的极性——双原子分子
非极性键
极性键
非极性分子
极性分子
Cl
Cl
Cl
Cl
H
Cl
H
Cl
δ+
δ-
正负电中心不重合
正负电中心重合
双原子分子的极性取决于原子间的共价键是否有极性,分子的极性与键的极性一致。
√ 只含非极性键的双原子分子一定是非极性分子。例如:单质 H2 、O2、Cl2
√ 有极性键构成的双原子分子一定是极性分子。例如:化合物 HCl、HF、CO
分子的极性——多原子分子
【思考】分子的极性与键的极性有关,含极性键的分子一定是极性分子吗?
分子 H2O CCl4
共价键的极性
分子正电中心和负电中心
分子的极性
极性键
极性键
极性分子
非极性分子
V形,空间构型不对称
正四面体形,空间构型对称
共价键的极性
空间结构
决定
分子的正电中心与负电中心是否重合
决定
分子的极性
不重合
重合
从向量角度理解分子的极性——极性向量
极性向量:描述极性键的电荷分布情况
方向:由正电荷指向负电荷
在ABn分子中,可以依据分子中的极性键的极性向量和是否为零而定,键的极性向量和=0,为非极性分子(极性抵消),键的极性向量和≠0,为极性分子(极性不抵消)
CO2
HCN
正电中心与负电中心重合
非极性分子
大小相等,方向相反
向量和为0
大小不相等,方向相同
向量和不为0
正电中心与负电中心不重合
极性分子
从向量角度理解分子的极性——极性向量
B
F
F
F
δ+
δ-
δ-
δ-
O
H
H
δ+
δ-
δ+
一般情况下,含极性键的分子,若分子中各个键的极性向量和=0(互相抵消),也为非极性分子
极性向量:描述极性键的电荷分布情况
方向:由正电荷指向负电荷
在ABn分子中,可以依据分子中的极性键的极性向量和是否为零而定,键的极性向量和=0,为非极性分子(极性抵消),键的极性向量和≠0,为极性分子(极性不抵消)
分子的极性——多原子分子
P4
B
F
F
F
CH4
CH3Cl
C60
δ+
δ-
HCN
BF3
NH3
H2O
CO2
P52思考与讨论
思考与讨论
多原子分子极性的判断
对称
法一:对称法(空间构型)
对称直线形
平面正三角形
正四面形
其他对称结构
非极性分子
不对称
极性分子
不对称直线形
一般平面三角形
V形
三角锥形
四面形
计算价层电子对(孤+ σ键)→略孤电子得出空间结构→判断是否对称
①稀有气体分子(He、Ne)是非极性分子,但不含共价键
②臭氧是极性分子,共价键为极性键
③H2O2是由极性键和非极性键构成的极性分子
特别关注——H2O2与O3的结构
多原子分子极性的判断
法二:化合价法
对于ABn型分子
(1)中心原子的化合价的绝对值=该元素的价电子数,该分子为非极性分子,此时分子的空间结构是对称的。
(2)中心原子的化合价的绝对值 ≠ 其价电子数 ,则分子的空间结构不是对称的,其分子为极性分子。
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
|化合价|
价层电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性分子
极性分子
注意:CFCl3等需要看对不对称
科普小能手
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
明辨是非
1.极性分子中不可能含有非极性键。 ( )
2.离子化合物中不可能含有非极性键。( )
3.非极性分子中不可能含有极性键。( )
4.极性分子中一定含有极性键。( )
5.只含有非极性键的分子一定是非极性分子( )
6.H2O、CO2、CH4都是非极性分子。( )
√
×
×
×
×
√
课堂反馈
1.在下列物质中,分子中电荷空间分布对称的是( )
①CO2 ②CCl4 ③NH3 ④H2O ⑤HBr
A.①②④ B.②④⑤ C.③⑤ D.①②
D
A
2.下列物质中,由极性键形成的非极性分子是( )
A.CO2 B.Br2 C.CaCl2 D.SO2
共价键
极性键
非极性键
空间不对称
极性分子
双原子分子:HCl、NO、CO
V型分子:H2O、H2S、SO2
三角锥形分子:NH3、PH3
非正四面体:CHCl3
特别地:H2O2、O3
非极性分子
单质分子:Cl2、N2、P4、O2
直线形分子:CO2、CS2、C2H2
正三角形:SO3、BF3
平面形:苯、乙烯
正四面体:CH4、CCl4、SiF4
空间对称
素养提升
多原子分子极性的判断
法二:化合价法
对于ABn型分子
(1)中心原子的化合价的绝对值=该元素的价电子数,该分子为非极性分子,此时分子的空间结构是对称的。
(2)中心原子的化合价的绝对值 ≠ 其价电子数 ,则分子的空间结构不是对称的,其分子为极性分子。
化学式 BF3 CO2 PCl5 SO3 H2O NH3 SO2
|化合价|
价层电子数
分子极性
3
4
5
6
2
3
4
3
4
5
6
6
5
6
非极性分子
极性分子
注意:CFCl3等需要看对不对称
思考与交流
2Na+2H2O==2NaOH+H2↑
2Na+2CH3CH2OH→2CH3CH2ONa+H2↑
钠和水的反应
钠和乙醇的反应
为什么钠和水的反应比钠和乙醇的反应剧烈?
键的极性对化学性质的影响
分子的结构
共价键的极性
物质的化学性质
羧酸是一大类含羧基( COOH)的有机酸,羧基可电离出H+而呈酸性。
羧酸的酸性可以用pKa的大小来衡量。
pKa (pKa= lgKa)
pKa越小,酸性越强
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
思考:三氟乙酸的酸性为什么强于三氯乙酸?
δ- δ+
F C C O H
O
F
F
δ- δ+
Cl C C O H
O
Cl
Cl
吸电子基团
吸电子基团
电负性:F>Cl
极性变更大
极性变大
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
思考:三氟乙酸的酸性为什么强于三氯乙酸?
氟的电负性大于氯的电负性,F C的极性>Cl C的极性;使F3C 的极性>Cl3C 的极性,导致三氟乙酸在羧基中的羟基极性增强,易电离出H+。
键的极性对化学性质的影响
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
δ- δ+
Cl C C O H
O
吸电子基团
极性变大
Cl原子数目越多,吸引电子能力越大
使羧基中的羟基极性越大
羧酸的酸性越强
酸性:三氯乙酸>二氯乙酸>氯乙酸
表2 6 不同羧酸的pKa
羧酸 pKa
丙酸(C2H5COOH)
乙酸(CH3COOH)
甲酸(HCOOH)
氯乙酸(CH2ClCOOH)
二氯乙酸(CHCl2COOH)
三氯乙酸(CCl3COOH)
三氟乙酸(CF3COOH)
4.88
4.76
3.75
2.86
1.29
0.65
0.23
δ- δ+
R C O H
O
推电子基团
极性变小
烃基越长,推电子效应越大
使羧基中的羟基的极性越小
羧酸的酸性越弱
酸性:甲酸>乙酸>丙酸
键的极性对化学性质的影响
学以致用
H
O
H
C2H5
O
H
δ+
δ-
δ+
δ-
乙醇分子中的C2H5—是推电子基团,使得乙醇分子中的电子云向着远离乙基的方向偏移,羟基的极性比水分子中的小,因而钠和乙醇的反应不如钠和水的剧烈。
课堂反馈
1.下列物质中,酸性最强的是( )
A.HCOOH B.HOCOOH
C.CH3COOH D.C6H13COOH
A
2.下列物质:①BeCl2 ②Ar ③白磷 ④BF3 ⑤NH3 ⑥H2O2,其中含极性键的非极性分子是( )
A.①④⑥ B.②③⑥
C.①④ D.①③④⑤
C
