2.3氧化还原的应用3 课件(19张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 2.3氧化还原的应用3 课件(19张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:15:08 | ||
图片预览





文档简介
(共19张PPT)
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
化合价降低,得Ae-×B,发生还原反应
化合价升高,失Ae-×B,发生氧化反应
氧化性
还原性
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
还原产物
氧化产物
A=化合价的变化量,B=个数
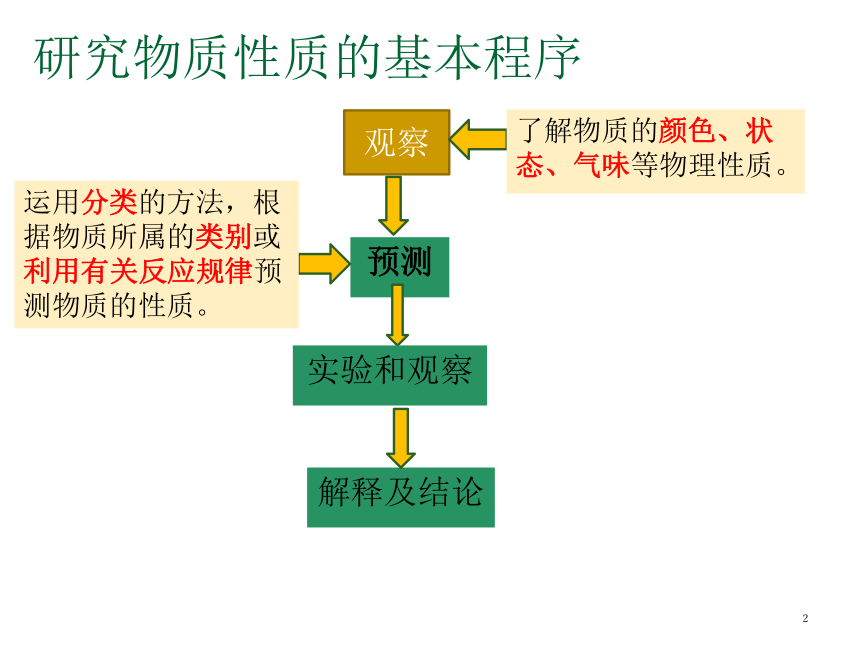
研究物质性质的基本程序
2
观察
了解物质的颜色、状态、气味等物理性质。
预测
运用分类的方法,根据物质所属的类别或利用有关反应规律预测物质的性质。
实验和观察
解释及结论
知识回顾:
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
每天进步一点点,坚持带来大改变!
第3课时 氧化还原反应的应用
学习目标:
1.通过分析物质所含元素化合价升降趋势,
会判断物质的氧化性或还原性(重点)
2.通过实验视频并阅读课本72页,运用氧化
还原反应规律实现物质转化并熟记实验室氯
气制法。(重难点)
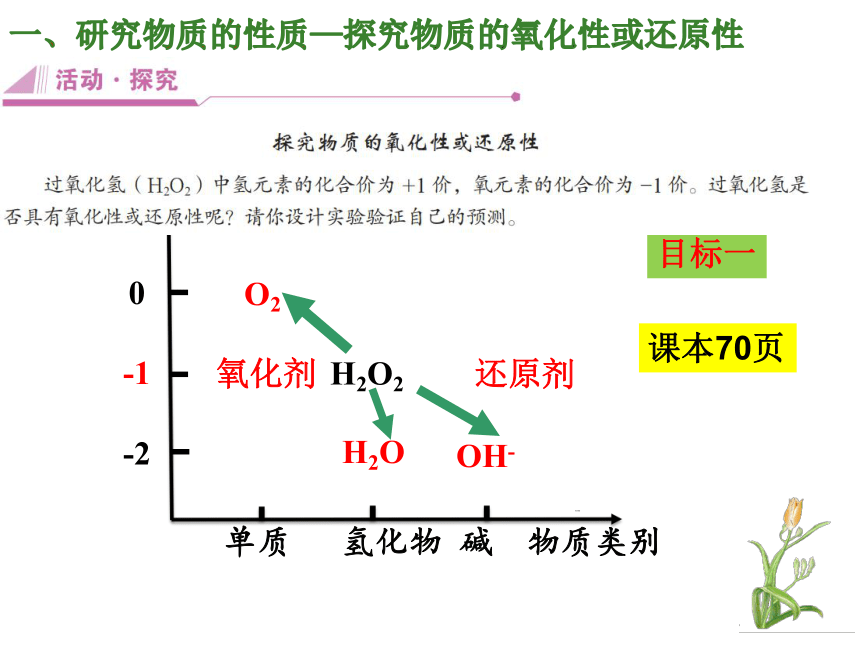
O2
H2O
OH-
氧化剂
还原剂
H2O2
单质 氢化物 碱 物质类别
0
-1
-2
物质类别
氧元素化合价
一、研究物质的性质—探究物质的氧化性或还原性
我们利用氧化还原反应,通过分析物质所含元素化合价的升降趋势,研究物质的还原性或氧化性。
课本70页
目标一
活动·探究
课本70页
实验试剂:5% H2O2溶液,酸性KMnO4溶液,KI溶液,淀粉溶液
实验方案 实验现象 实验结论
取少量KI溶液于小试管中,先滴加5%的H2O2溶液,再滴入几滴淀粉溶液,
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
目标一
实验内容 实验现象 实验结论
取少量KI溶液于小试管中,先滴加5%的H2O2溶液,再滴入几滴淀粉溶液
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
溶液由无色变为黄色,最后变为蓝色
H2O2具有氧化性
溶液紫色变浅直至消失,有无色气泡生成
H2O2具有还原性
目标一
当堂检测
1.FeCl3中铁元素的化合价容易发生变化, 所以Fe是核心元素,从Fe元素化合价分析,
预测FeCl3具有________性2.为了证明FeCl3的该性质,可以选择以下______
反应进行实验。A. Cl2 → Cl-
B. Cu → Cu2+
C. H+ → H2
D. I2 → I-
目标一
氧化
B
1、利用氧化还原反应实现物质的转化
(1)金属的冶炼
热还原法
置换法
电解法
Fe2O3+3CO Fe+3CO2
Fe + CuSO4==== FeSO4 + Cu
2Al2O3 4Al+3O2↑
金红石(TiO2)、
碳单质、氯气
高温
TiCl4
镁、加热
氩气氛围
Ti
二、实现物质的转化与获得能量
冶炼的实质:
将化合态的金属还原成单质
Mn+ + ne- ==M
课本71页
目标二
2、利用氧化还原反应获得能量
(1)利用氧化还原反应获得热能
可燃物
氧化剂
热量
(2)利用氧化还原反应获得电能
目标二
3、非金属单质制备
MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
迁移应用--实验室制氯气
课本72页
目标二
(1)用浓盐酸和二氧化锰制取氯气的反应属于氧化还原反应吗?如果属于氧化还原反应,请指出其中的氧化剂和还原剂;如果不属于氧化还原反应,请说明理由
实验视频
(2)在实验室制取氯气时,常使用NaOH溶液吸收 尾气。写出相关反应的化学方程式,分析氯气在该反应中表现出什么性质。若想获得纯净的氯气,对该装置还要进行哪些改进?
Cl2 + 2NaOH ====NaCl + NaClO + H2O
化合价升高,氧化反应
化合价降低,还原反应
+1
0
-1
氧化性
还原性
请分析:
氯气中可能存在的杂质气体为HCl、水蒸气
(3)在实验室里也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请你预测反应产物,写出该反应的化学方程式。
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
单质硅的制备
SiO2、碳单质
粗硅
SiCl4
Si
氧化还原反应的应用
研究物质
的性质
实现物质转化与获得能量
研究物质氧化性或还原性
比较氧化性或还原性的强弱
当堂检测
1.正确的打“√”,错误的打“×”。(1)用如图所示装置除去氯气中的HCl气体( )(2)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与 还原剂物质的量之比为1∶4( )(3)检验氯气可用湿润的淀粉 KI试纸( )(4)一套完整的制气装置包括:发生装置→净化装置→收集或性质验证装置→尾气处理装置( )
目标二
X
X
√
√
2. 实验室制取干燥、纯净氯气的实验装置:
实验原理:______________________________。
(1)写出下列仪器的名称:A_______,B_________。
(2)写出下列装置中加入的药品:C____________、D____________、F____________。
(3)回答下列装置的作用:C____________、D____________、F____________。
(4)F中反应的化学方程式为____________________。
目标二
氧化剂 + 还原剂 ==== 还原产物 + 氧化产物
化合价降低,得Ae-×B,发生还原反应
化合价升高,失Ae-×B,发生氧化反应
氧化性
还原性
+2
0
0
+1
化合价降低,得2e- ×1 ,还原反应
化合价升高,失1e-×2,氧化反应
CuO + H2 ==== Cu + H2O
△
氧化剂
还原剂
还原产物
氧化产物
A=化合价的变化量,B=个数
研究物质性质的基本程序
2
观察
了解物质的颜色、状态、气味等物理性质。
预测
运用分类的方法,根据物质所属的类别或利用有关反应规律预测物质的性质。
实验和观察
解释及结论
知识回顾:
最高价态元素的物质只具有氧化性;
最低价态元素的物质只具有还原性;
中间价态元素的物质既有氧化性,又有还原性
每天进步一点点,坚持带来大改变!
第3课时 氧化还原反应的应用
学习目标:
1.通过分析物质所含元素化合价升降趋势,
会判断物质的氧化性或还原性(重点)
2.通过实验视频并阅读课本72页,运用氧化
还原反应规律实现物质转化并熟记实验室氯
气制法。(重难点)
O2
H2O
OH-
氧化剂
还原剂
H2O2
单质 氢化物 碱 物质类别
0
-1
-2
物质类别
氧元素化合价
一、研究物质的性质—探究物质的氧化性或还原性
我们利用氧化还原反应,通过分析物质所含元素化合价的升降趋势,研究物质的还原性或氧化性。
课本70页
目标一
活动·探究
课本70页
实验试剂:5% H2O2溶液,酸性KMnO4溶液,KI溶液,淀粉溶液
实验方案 实验现象 实验结论
取少量KI溶液于小试管中,先滴加5%的H2O2溶液,再滴入几滴淀粉溶液,
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
目标一
实验内容 实验现象 实验结论
取少量KI溶液于小试管中,先滴加5%的H2O2溶液,再滴入几滴淀粉溶液
取少量酸性KMnO4溶液小试管中,再滴加5%的H2O2溶液。
溶液由无色变为黄色,最后变为蓝色
H2O2具有氧化性
溶液紫色变浅直至消失,有无色气泡生成
H2O2具有还原性
目标一
当堂检测
1.FeCl3中铁元素的化合价容易发生变化, 所以Fe是核心元素,从Fe元素化合价分析,
预测FeCl3具有________性2.为了证明FeCl3的该性质,可以选择以下______
反应进行实验。A. Cl2 → Cl-
B. Cu → Cu2+
C. H+ → H2
D. I2 → I-
目标一
氧化
B
1、利用氧化还原反应实现物质的转化
(1)金属的冶炼
热还原法
置换法
电解法
Fe2O3+3CO Fe+3CO2
Fe + CuSO4==== FeSO4 + Cu
2Al2O3 4Al+3O2↑
金红石(TiO2)、
碳单质、氯气
高温
TiCl4
镁、加热
氩气氛围
Ti
二、实现物质的转化与获得能量
冶炼的实质:
将化合态的金属还原成单质
Mn+ + ne- ==M
课本71页
目标二
2、利用氧化还原反应获得能量
(1)利用氧化还原反应获得热能
可燃物
氧化剂
热量
(2)利用氧化还原反应获得电能
目标二
3、非金属单质制备
MnO2+ 4HCl(浓) MnCl2 + Cl2 ↑ + 2H2O
迁移应用--实验室制氯气
课本72页
目标二
(1)用浓盐酸和二氧化锰制取氯气的反应属于氧化还原反应吗?如果属于氧化还原反应,请指出其中的氧化剂和还原剂;如果不属于氧化还原反应,请说明理由
实验视频
(2)在实验室制取氯气时,常使用NaOH溶液吸收 尾气。写出相关反应的化学方程式,分析氯气在该反应中表现出什么性质。若想获得纯净的氯气,对该装置还要进行哪些改进?
Cl2 + 2NaOH ====NaCl + NaClO + H2O
化合价升高,氧化反应
化合价降低,还原反应
+1
0
-1
氧化性
还原性
请分析:
氯气中可能存在的杂质气体为HCl、水蒸气
(3)在实验室里也可以利用高锰酸钾与浓盐酸在常温下反应制取氯气,请你预测反应产物,写出该反应的化学方程式。
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O
单质硅的制备
SiO2、碳单质
粗硅
SiCl4
Si
氧化还原反应的应用
研究物质
的性质
实现物质转化与获得能量
研究物质氧化性或还原性
比较氧化性或还原性的强弱
当堂检测
1.正确的打“√”,错误的打“×”。(1)用如图所示装置除去氯气中的HCl气体( )(2)用MnO2和浓盐酸制取Cl2的反应中,氧化剂与 还原剂物质的量之比为1∶4( )(3)检验氯气可用湿润的淀粉 KI试纸( )(4)一套完整的制气装置包括:发生装置→净化装置→收集或性质验证装置→尾气处理装置( )
目标二
X
X
√
√
2. 实验室制取干燥、纯净氯气的实验装置:
实验原理:______________________________。
(1)写出下列仪器的名称:A_______,B_________。
(2)写出下列装置中加入的药品:C____________、D____________、F____________。
(3)回答下列装置的作用:C____________、D____________、F____________。
(4)F中反应的化学方程式为____________________。
目标二
