3.3.1氮的循环第一课时 自然界中的氮循环 课件(15张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.3.1氮的循环第一课时 自然界中的氮循环 课件(15张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:15:58 | ||
图片预览





文档简介
(共15张PPT)
第三节 氮的循环
第1课时 自然界中的氮循环、氮气、氮的氧化物
学习目标
1、通过阅读课本110页,能说出氮循环的基本 过程以及氮循环中的基本物质;
2、通过氮循环中物质的性质及物质之间的转化,能说出氮气、一氧化氮、二氧化氮的物理化学性质,并能写出相关方程式。(重难点)
一、自然界中氮的循环
氮的循环涉及地球上生物圈的方方面面。
课本110页
目标一
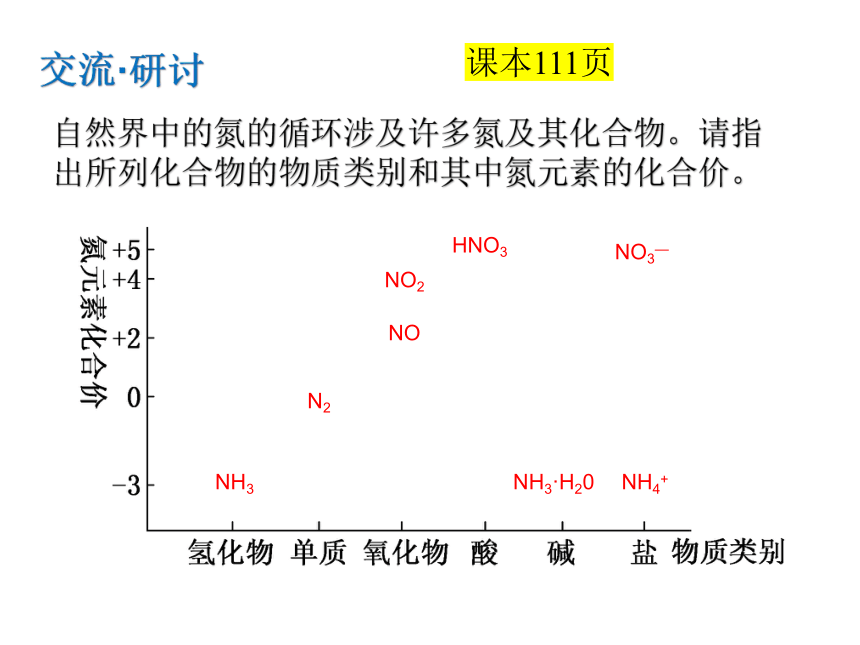
自然界中的氮的循环涉及许多氮及其化合物。请指出所列化合物的物质类别和其中氮元素的化合价。
交流·研讨
NH3
N2
NO
NO2
HNO3
NH3·H20
NH4+
NO3—
课本111页
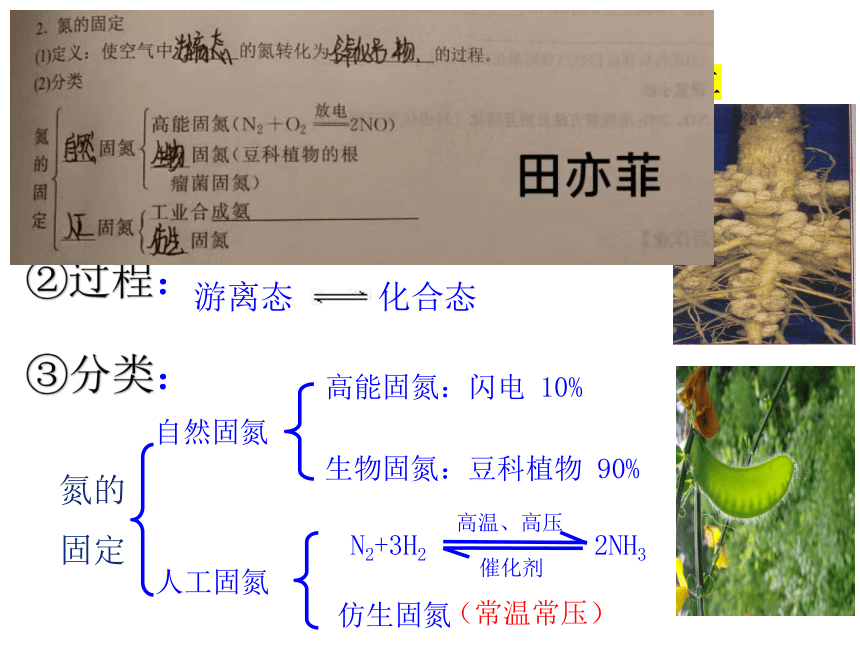
①概念:
将空气中游离态的氮转化为含氮化合物
游离态 化合态
②过程:
1、氮的固定
③分类:
氮的固定
人工固氮
自然固氮
高能固氮:闪电 10%
生物固氮:豆科植物 90%
催化剂
N2+3H2 2NH3
高温、高压
仿生固氮
(常温常压)
二、氮循环中的物质及物质之间的转化
目标二
课本112页
2、氮气
(1)物理性质
颜色 气味 状态 溶解性 密度
无色
无味
密度比空气稍小
气体
难溶于水
目标二
课本113页
(2)氮气的化学性质
N2+O2 N0
与氧气反应
②与氢气反应
N2+3H2 2NH3
高温、高压
催化剂
可逆反应:相同条件下,同时向正反两个方向进行的反应。
特征:不能进行到底,反应物、生成物同时存在
目标二
3.一氧化氮和二氧化氮
氮的 氧化物 颜色 气味 状态 毒性 溶解度
NO
NO2
(1)物理性质
无色
无味
气体
有毒
难溶于水
红棕色
刺激性
有毒
易溶于水
气体
目标二
课本113页
(2)化学性质
a.一氧化氮易与氧气反应生成二氧化氮。
2NO+O2 == 2NO2
b.二氧化氮能与水反应生成一氧化氮和
硝酸(工业上利用这一原理制取硝酸)
3NO2+H2O == 2HNO3+NO
当堂检测:
判断正误(1)实验室能用排空气法收集N2、NO和NO2( )(2)工业上合成氨及生产尿素均为氮的固定( )(3)N2在通常情况下与O2反应生成NO2( )(4)向一定容积容器中充入1 mol N2和3 mol H2,充分反应能得到2 mol NH3( )
与氢气
氮循环中
的重要物质
氮气
氮的氧化物
氮的固定
物理性质
化学性质
二氧化氮与
水的反应
与氧气
物理性质
课堂小结
B
1.关于氮气的性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧生成一氧化氮
C.氮气的化学性质比较稳定,其原因是两原子间的
结合比较牢固
D.跟氢气在一定条件下发生反应,氮气是氧化剂
当堂检测
2.NO2与水的反应可表示为:3NO2+H2O====2HNO3+NO,
关于此反应的下列说法中正确的是( )
A.氮元素的化合价没有发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂,又是还原剂
D
3. NO有毒,会结合血红蛋白造成人体缺氧。不过,人
们发现它可作为一种传递神经信息的“信使分子”,在
使血管扩张、免疫、增强记忆力等方面有着极其重要的
作用。下列关于NO的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
C
第三节 氮的循环
第1课时 自然界中的氮循环、氮气、氮的氧化物
学习目标
1、通过阅读课本110页,能说出氮循环的基本 过程以及氮循环中的基本物质;
2、通过氮循环中物质的性质及物质之间的转化,能说出氮气、一氧化氮、二氧化氮的物理化学性质,并能写出相关方程式。(重难点)
一、自然界中氮的循环
氮的循环涉及地球上生物圈的方方面面。
课本110页
目标一
自然界中的氮的循环涉及许多氮及其化合物。请指出所列化合物的物质类别和其中氮元素的化合价。
交流·研讨
NH3
N2
NO
NO2
HNO3
NH3·H20
NH4+
NO3—
课本111页
①概念:
将空气中游离态的氮转化为含氮化合物
游离态 化合态
②过程:
1、氮的固定
③分类:
氮的固定
人工固氮
自然固氮
高能固氮:闪电 10%
生物固氮:豆科植物 90%
催化剂
N2+3H2 2NH3
高温、高压
仿生固氮
(常温常压)
二、氮循环中的物质及物质之间的转化
目标二
课本112页
2、氮气
(1)物理性质
颜色 气味 状态 溶解性 密度
无色
无味
密度比空气稍小
气体
难溶于水
目标二
课本113页
(2)氮气的化学性质
N2+O2 N0
与氧气反应
②与氢气反应
N2+3H2 2NH3
高温、高压
催化剂
可逆反应:相同条件下,同时向正反两个方向进行的反应。
特征:不能进行到底,反应物、生成物同时存在
目标二
3.一氧化氮和二氧化氮
氮的 氧化物 颜色 气味 状态 毒性 溶解度
NO
NO2
(1)物理性质
无色
无味
气体
有毒
难溶于水
红棕色
刺激性
有毒
易溶于水
气体
目标二
课本113页
(2)化学性质
a.一氧化氮易与氧气反应生成二氧化氮。
2NO+O2 == 2NO2
b.二氧化氮能与水反应生成一氧化氮和
硝酸(工业上利用这一原理制取硝酸)
3NO2+H2O == 2HNO3+NO
当堂检测:
判断正误(1)实验室能用排空气法收集N2、NO和NO2( )(2)工业上合成氨及生产尿素均为氮的固定( )(3)N2在通常情况下与O2反应生成NO2( )(4)向一定容积容器中充入1 mol N2和3 mol H2,充分反应能得到2 mol NH3( )
与氢气
氮循环中
的重要物质
氮气
氮的氧化物
氮的固定
物理性质
化学性质
二氧化氮与
水的反应
与氧气
物理性质
课堂小结
B
1.关于氮气的性质的说法中,错误的是( )
A.通常情况下,氮气性质很不活泼
B.可在氧气中燃烧生成一氧化氮
C.氮气的化学性质比较稳定,其原因是两原子间的
结合比较牢固
D.跟氢气在一定条件下发生反应,氮气是氧化剂
当堂检测
2.NO2与水的反应可表示为:3NO2+H2O====2HNO3+NO,
关于此反应的下列说法中正确的是( )
A.氮元素的化合价没有发生变化
B.NO2只是氧化剂
C.NO2只是还原剂
D.NO2既是氧化剂,又是还原剂
D
3. NO有毒,会结合血红蛋白造成人体缺氧。不过,人
们发现它可作为一种传递神经信息的“信使分子”,在
使血管扩张、免疫、增强记忆力等方面有着极其重要的
作用。下列关于NO的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.一氧化氮可由氮气和氧气在放电条件下直接化合得到
D.一氧化氮易溶于水,不能用排水法收集
C
