3.2.3硫酸 酸雨及其防治 课件(21张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2.3硫酸 酸雨及其防治 课件(21张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:18:07 | ||
图片预览





文档简介
(共21张PPT)
浓硫酸98.3%
稀释,方法?
主要以硫酸分子形式存在
H2SO4
?
?
?
第3章物质的性质与转化
第2节 硫的转化
第3课时 硫酸 酸雨及其防治
学习目标
1.通过观看实验视频,能说出硫酸的主要性质,并会书写相关化学方程式;(重难点)
2.通过结合真实情境,能说出酸雨的形成原因,知道其对生态环境的影响。
无色、油状液体、难挥发
易溶于水,以任意比与水混溶,放出大量的热
一、浓硫酸物理性质
目标一
课本103页
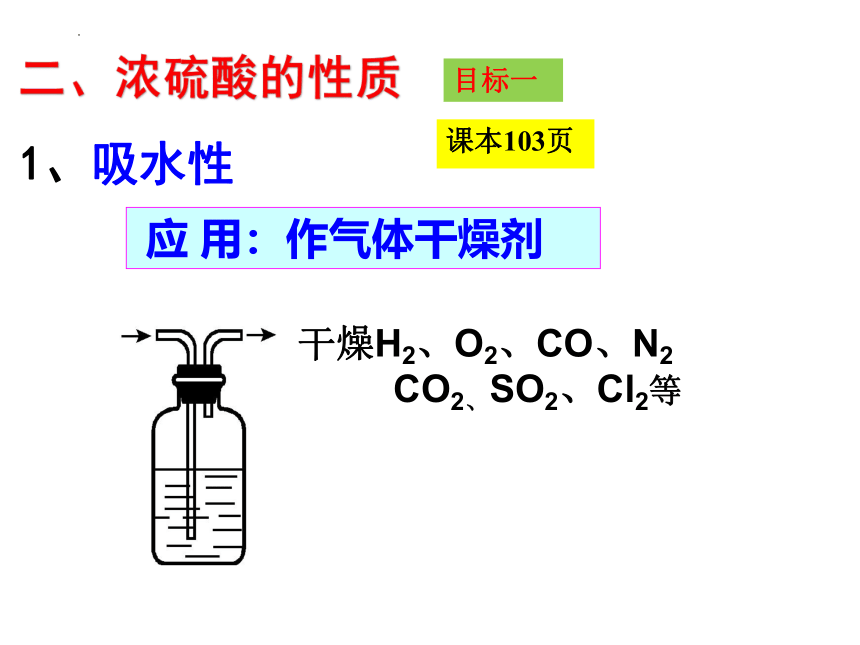
干燥H2、O2、CO、N2
CO2、SO2、Cl2等
应 用:作气体干燥剂
二、浓硫酸的性质
1、吸水性
目标一
课本103页
“黑面包”实验
取20g蔗糖(C12H22O11)放入小烧杯中,滴加几滴水,再加入15mL浓硫酸,迅速搅拌。
二、浓硫酸的性质
2、脱水性
目标一
课本103页
【实验总结与反思1】
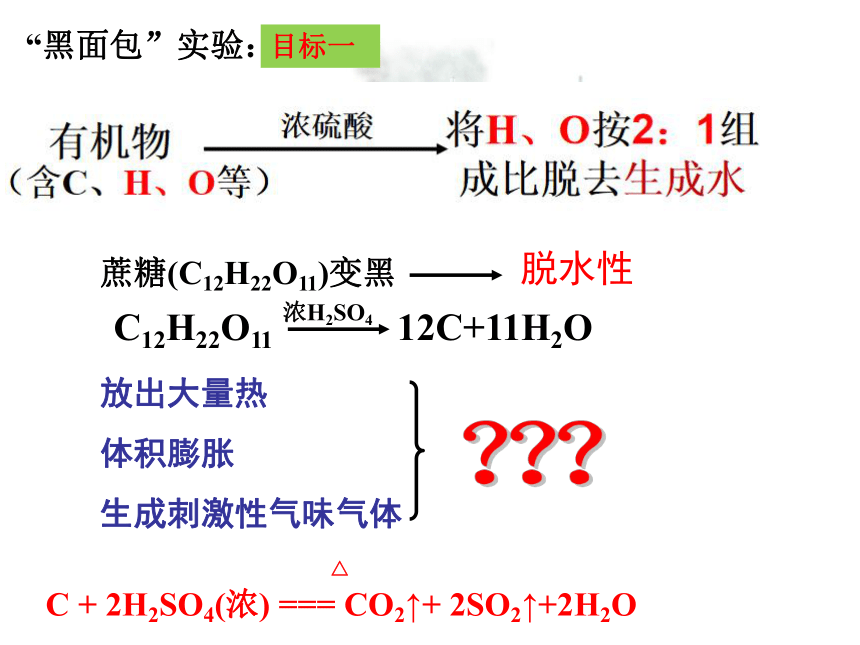
蔗糖(C12H22O11)变黑
放出大量热
体积膨胀
生成刺激性气味气体
脱水性
?
?
?
C12H22O11 12C+11H2O
浓H2SO4
“黑面包”实验:
C + 2H2SO4(浓) === CO2↑+ 2SO2↑+2H2O
△
目标一
C+ 2H2SO4(浓)==CO2 ↑ + 2SO2 ↑ + 2H2O
+4
0
+4
化合价升高 失4e- 氧化反应
化合价降低 得4e- 还原反应
还原剂
氧化剂
+6
3、浓H2SO4的强氧化性
(1)与非金属反应
注意
(1)参加反应的浓硫酸全部被还原;
(2)浓硫酸只表现氧化性.
氧化产物
还原产物
目标一
课本103页
+6
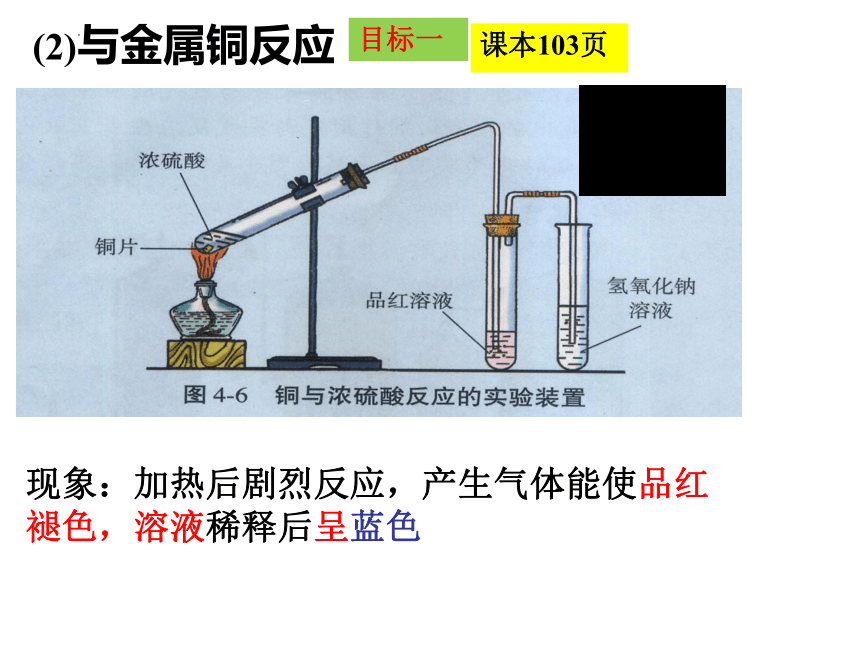
(2)与金属铜反应
现象:加热后剧烈反应,产生气体能使品红褪色,溶液稀释后呈蓝色
目标一
课本103页
Cu + 2H2SO4(浓)==CuSO4 + SO2 ↑ + 2H2O
+6
+4
+6
0
+2
化合价升高 失2e— 氧化反应
化合价降低 得2e— 还原反应
还原剂
氧化剂
注 意
(1)加热时:浓硫酸可以与除铂、金之外的 所有金属反应。
(2)还原产物一般为SO2 ,不生成H2
(3)浓硫酸体现强氧化性和酸性;
氧化产物
还原产物
(2)与金属铜反应
目标一
课本103页
二、浓硫酸的强氧化性
钝化
(3)常温与铁和铝反应
工业上用铁或铝槽车盛放、运输浓硫酸
注意
钝化属于化学变化
目标一
课本103页
1.下列反应中浓H2SO4只起氧化作用的是______,既起氧化作用,又起酸的作用的是
。
A.铜跟浓H2SO4共热
B.固体NaCl跟浓H2SO4共热
C.木炭跟浓H2SO4共热
D.浓H2SO4跟硫化氢反应
CD
A
【当堂检测】
目标一
三、浓硫酸的用途
课本104页
2. 下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.蓝色胆矾晶体滴加浓硫酸时变为白色固体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.常温下,浓硫酸不与铁、铝反应,所以可以用铁、铝制容器盛装浓硫酸
B
注意:常温下,铁、铝遇浓H2SO4发生“钝化”,“钝化”并不是不反应,而是浓H2SO4 强氧化性的体现。
【当堂检测】
目标一
比较:稀硫酸和浓硫酸和组成和性质
名称 稀硫酸 浓硫酸
存在的粒子
和铁、铝
和铜
和碳
体现氧化性的元素
还原产物
氧化性强弱
特性
H2SO4分子
H+、SO42-
常温钝化,加热反应
反应生成H2
不反应
加热反应
加热反应
不反应
+6
S
H
+1
SO2
H2
强
弱
酸的通性
吸水性 脱水性 强氧化性
1. 酸雨的形成:排入空气中的________在______和_________的共同作用下形成酸雾。
硫的氧化物形成酸雨的主要反应有:
①________________________;
②________________________;
③________________________;
④________________________。
2. 酸雨的防治措施:从实际情况出发,对 _____
的排放加以控制;改变能源结构,开发利用____________ 等清洁能源,从根本上解决问题。
二氧化硫
氧气
水蒸气
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
酸性物质
氢能、风能、太阳能
四、酸雨及其防治
催化剂
△
2SO2 + O2
2SO3
SO2+H2O H2SO3
目标二
课本105页
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
浓硫酸对水的告白
小结:
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
1.导致下列现象的主要原因与排放SO2有关的是( )
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
2.若下列物质长期存放在敞口容器中,质量一定会增加的是( )
A.浓硫酸 B.浓盐酸
C.胆矾晶体 D.Na2CO3·10H2O
3.下列关于浓硫酸和稀硫酸的叙述正确的是( )
A.常温时都能与铁发生反应,放出气体
B.加热时都能与铜发生反应
C.都能做气体干燥剂
D.硫元素的化合价都是+6价
A
A
D
当堂检测
目标一
目标一
目标二
4. 关于浓硫酸与Cu反应的叙述正确的是( )
A.在反应中,浓硫酸只表现出氧化性
B.该反应中还原剂与氧化剂物质的量之比为1∶2
C.在反应中,浓硫酸既表现出氧化性,又表现出酸性
D.每1 mol 铜参加反应就有2 mol浓硫酸被还原,同时生成2 mol SO2
C
当堂检测
目标一
5. 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认生成了CuSO4,向①中加水,观察颜色
解析:上下移动①中铜丝,可使反应随时发生和停止,A项合理;SO2可使品红溶液褪色,B项合理;
2NaOH+SO2===Na2SO3+H2O,C项合理;①中有过量的浓硫酸,直接向①中加水,水易沸腾溅出而引发实验事故,D项不合理。
D
当堂检测
目标一
浓硫酸98.3%
稀释,方法?
主要以硫酸分子形式存在
H2SO4
?
?
?
第3章物质的性质与转化
第2节 硫的转化
第3课时 硫酸 酸雨及其防治
学习目标
1.通过观看实验视频,能说出硫酸的主要性质,并会书写相关化学方程式;(重难点)
2.通过结合真实情境,能说出酸雨的形成原因,知道其对生态环境的影响。
无色、油状液体、难挥发
易溶于水,以任意比与水混溶,放出大量的热
一、浓硫酸物理性质
目标一
课本103页
干燥H2、O2、CO、N2
CO2、SO2、Cl2等
应 用:作气体干燥剂
二、浓硫酸的性质
1、吸水性
目标一
课本103页
“黑面包”实验
取20g蔗糖(C12H22O11)放入小烧杯中,滴加几滴水,再加入15mL浓硫酸,迅速搅拌。
二、浓硫酸的性质
2、脱水性
目标一
课本103页
【实验总结与反思1】
蔗糖(C12H22O11)变黑
放出大量热
体积膨胀
生成刺激性气味气体
脱水性
?
?
?
C12H22O11 12C+11H2O
浓H2SO4
“黑面包”实验:
C + 2H2SO4(浓) === CO2↑+ 2SO2↑+2H2O
△
目标一
C+ 2H2SO4(浓)==CO2 ↑ + 2SO2 ↑ + 2H2O
+4
0
+4
化合价升高 失4e- 氧化反应
化合价降低 得4e- 还原反应
还原剂
氧化剂
+6
3、浓H2SO4的强氧化性
(1)与非金属反应
注意
(1)参加反应的浓硫酸全部被还原;
(2)浓硫酸只表现氧化性.
氧化产物
还原产物
目标一
课本103页
+6
(2)与金属铜反应
现象:加热后剧烈反应,产生气体能使品红褪色,溶液稀释后呈蓝色
目标一
课本103页
Cu + 2H2SO4(浓)==CuSO4 + SO2 ↑ + 2H2O
+6
+4
+6
0
+2
化合价升高 失2e— 氧化反应
化合价降低 得2e— 还原反应
还原剂
氧化剂
注 意
(1)加热时:浓硫酸可以与除铂、金之外的 所有金属反应。
(2)还原产物一般为SO2 ,不生成H2
(3)浓硫酸体现强氧化性和酸性;
氧化产物
还原产物
(2)与金属铜反应
目标一
课本103页
二、浓硫酸的强氧化性
钝化
(3)常温与铁和铝反应
工业上用铁或铝槽车盛放、运输浓硫酸
注意
钝化属于化学变化
目标一
课本103页
1.下列反应中浓H2SO4只起氧化作用的是______,既起氧化作用,又起酸的作用的是
。
A.铜跟浓H2SO4共热
B.固体NaCl跟浓H2SO4共热
C.木炭跟浓H2SO4共热
D.浓H2SO4跟硫化氢反应
CD
A
【当堂检测】
目标一
三、浓硫酸的用途
课本104页
2. 下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.蓝色胆矾晶体滴加浓硫酸时变为白色固体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.常温下,浓硫酸不与铁、铝反应,所以可以用铁、铝制容器盛装浓硫酸
B
注意:常温下,铁、铝遇浓H2SO4发生“钝化”,“钝化”并不是不反应,而是浓H2SO4 强氧化性的体现。
【当堂检测】
目标一
比较:稀硫酸和浓硫酸和组成和性质
名称 稀硫酸 浓硫酸
存在的粒子
和铁、铝
和铜
和碳
体现氧化性的元素
还原产物
氧化性强弱
特性
H2SO4分子
H+、SO42-
常温钝化,加热反应
反应生成H2
不反应
加热反应
加热反应
不反应
+6
S
H
+1
SO2
H2
强
弱
酸的通性
吸水性 脱水性 强氧化性
1. 酸雨的形成:排入空气中的________在______和_________的共同作用下形成酸雾。
硫的氧化物形成酸雨的主要反应有:
①________________________;
②________________________;
③________________________;
④________________________。
2. 酸雨的防治措施:从实际情况出发,对 _____
的排放加以控制;改变能源结构,开发利用____________ 等清洁能源,从根本上解决问题。
二氧化硫
氧气
水蒸气
SO3+H2O===H2SO4
2H2SO3+O2===2H2SO4
酸性物质
氢能、风能、太阳能
四、酸雨及其防治
催化剂
△
2SO2 + O2
2SO3
SO2+H2O H2SO3
目标二
课本105页
亲爱的水:
请允许我这样叫你,每当我遇见你,我就有一种沸腾的感觉,全身会放出大量的热。当我见不到你时,我甚至会在空气中寻找你的气息,就算你让我变成稀硫酸,我对你的心也不会改变,因为我是不挥发的,这点我比硝酸强,请你不要逃避。水,没有了你,虽然我也和铁,铝接触过,但我选择了拒绝,虽然别人认为我的脾气不好,他们说我欺负金属,欺负硫化氢和硫。
浓硫酸对水的告白
小结:
天地可以证明,我只要两个电子,但这是由+6价的中心硫原子决定的,我无法改变我的脾气,我从来不欺负我的小弟二氧化硫,尽管他比我更弱,但我像对待小弟弟一样对待他,还说我欺负氢氧化钠、碳酸钠,那是因为遇到它们,可以得到你!水,请你不要再逃避,就是逃到有机物中,我也会夺取氢氧重新合成你,你逃到天涯海角,我也会找到你,水,我可以对门捷列夫发誓,我会追随你一辈子!
愿和你在一起的:98.3%浓硫酸
1.导致下列现象的主要原因与排放SO2有关的是( )
A.酸雨 B.光化学烟雾
C.臭氧空洞 D.温室效应
2.若下列物质长期存放在敞口容器中,质量一定会增加的是( )
A.浓硫酸 B.浓盐酸
C.胆矾晶体 D.Na2CO3·10H2O
3.下列关于浓硫酸和稀硫酸的叙述正确的是( )
A.常温时都能与铁发生反应,放出气体
B.加热时都能与铜发生反应
C.都能做气体干燥剂
D.硫元素的化合价都是+6价
A
A
D
当堂检测
目标一
目标一
目标二
4. 关于浓硫酸与Cu反应的叙述正确的是( )
A.在反应中,浓硫酸只表现出氧化性
B.该反应中还原剂与氧化剂物质的量之比为1∶2
C.在反应中,浓硫酸既表现出氧化性,又表现出酸性
D.每1 mol 铜参加反应就有2 mol浓硫酸被还原,同时生成2 mol SO2
C
当堂检测
目标一
5. 用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制生成SO2的量
B.②中选用品红溶液验证SO2的生成
C.③中选用NaOH溶液吸收多余的SO2
D.为确认生成了CuSO4,向①中加水,观察颜色
解析:上下移动①中铜丝,可使反应随时发生和停止,A项合理;SO2可使品红溶液褪色,B项合理;
2NaOH+SO2===Na2SO3+H2O,C项合理;①中有过量的浓硫酸,直接向①中加水,水易沸腾溅出而引发实验事故,D项不合理。
D
当堂检测
目标一
