3.2.2二氧化硫的性质 课件(21张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 3.2.2二氧化硫的性质 课件(21张)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 11.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 09:19:02 | ||
图片预览






文档简介
(共21张PPT)
第2节 硫的转化
第2课时 二氧化硫
学习目标
1. 通过阅读课本101页,能说出硫元素在物质中具有不同的价态,学会利用氧化还原反应分析不同价态硫元素的物质之间的相互转化 ; 2.通过实验探究,学会分析归纳二氧化硫的化学性质,并能够写出相关方程式; 3. 通过探究二氧化硫的主要性质,养成认真细致和严谨求实的科学态度。
(重难点)
目标一
课本100页
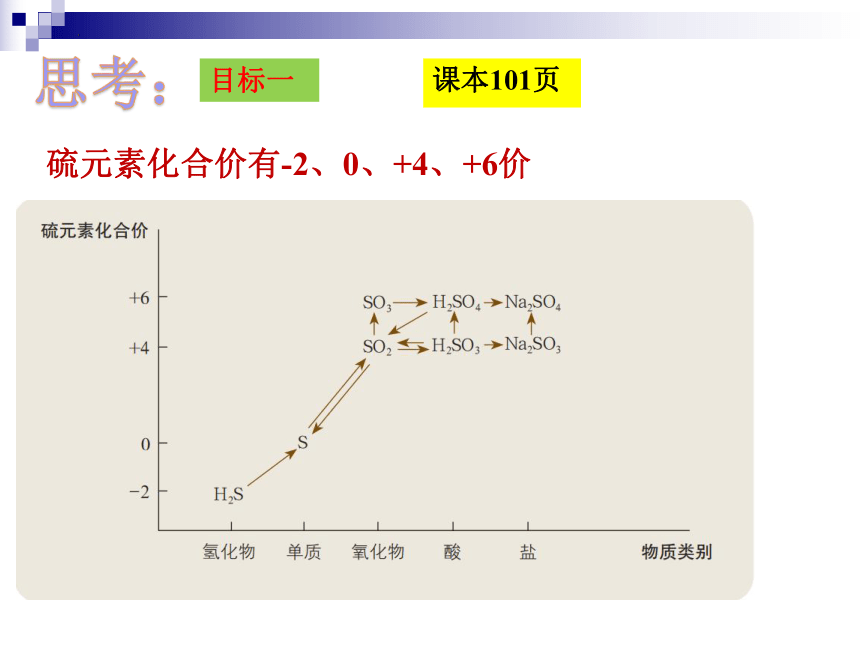
思考:
硫元素化合价有-2、0、+4、+6价
1. 哪些含硫元素的物质只具有氧化性?
2. 哪些含硫元素的物质只具有还原性?
3. 哪些含硫元素的物质既具有氧化性又具有还原性?
目标一
课本101页
无色
气体
有刺激性
有毒
比空气大
易溶于水(常温、常压下, 1 : 40)
颜色:
状态:
气味:
毒性:
密度:
溶解度:
一、SO2 物理性质:
目标二
课本102页
思考:根据SO2中S元素的化合价从氧化还原角度推测它应该具有怎样的化学性质?
可降
可升
可降
SO2既具有还原性又具有氧化性。
理论推断:
目标二
——SO2的氧化性和还原性实验探究
二、SO2 化学性质:
目的 探究SO2的还原性 探究SO2的氧化性
试剂 SO2、KMnO4溶液(或氯水)、稀盐酸、BaCl2溶液 SO2、氢硫酸
方案 将SO2通入KMnO4溶液(或氯水)中,再加入BaCl2溶液,最后加入稀盐酸 SO2通入氢硫酸中
现象 KMnO4溶液(或氯水)褪色,加入BaCl2溶液有白色沉淀生成,加入稀盐酸,沉淀不溶解 出现浅黄色浑浊
转化
结论
SO2 → SO42-
SO2 → S
目标二
课本101页
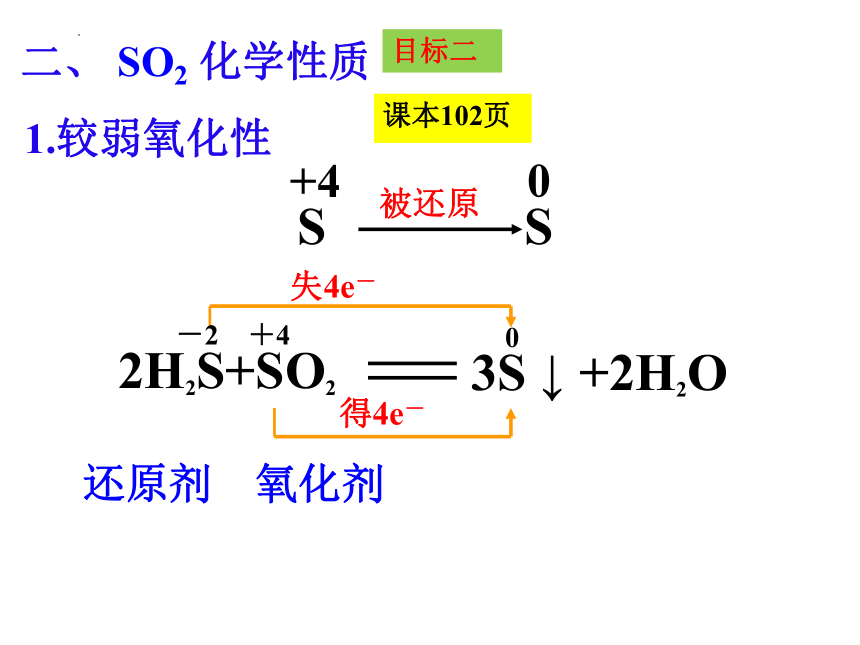
1.较弱氧化性
2H2S+SO2
失4e-
-2 +4
得4e-
还原剂 氧化剂
二、 SO2 化学性质
+4
S
被还原
0
S
3S ↓ +2H2O
0
目标二
课本102页
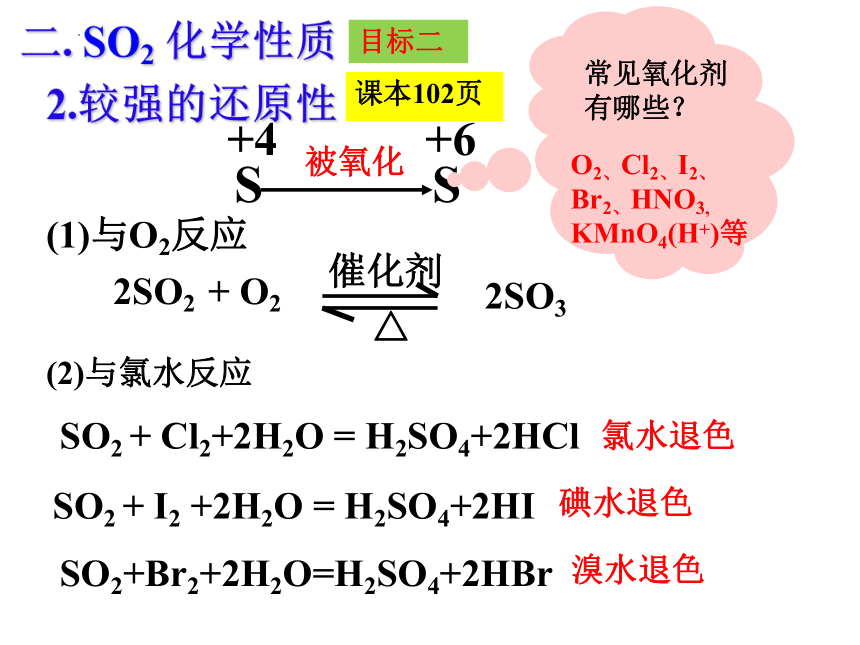
+4
S
+6
S
被氧化
二. SO2 化学性质
催化剂
△
2SO2 + O2
常见氧化剂
有哪些?
O2、Cl2、I2、
Br2、HNO3,
KMnO4(H+)等
(1)与O2反应
(2)与氯水反应
SO2 + I2 +2H2O = H2SO4+2HI
2SO3
SO2 + Cl2+2H2O = H2SO4+2HCl
2.较强的还原性
碘水退色
氯水退色
SO2+Br2+2H2O=H2SO4+2HBr
溴水退色
目标二
课本102页
现象:紫色的高锰酸钾退色
注意:这个反应体现的是SO2的还原性,
而不是漂白性
2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+
(3)与酸性的高锰酸钾溶液反应
目标二
课本102页
D
2.下列现象说明SO2具有氧化性的是( )A .SO2通入酸性高锰酸钾溶液中使之褪色B.SO2通入石蕊溶液中使之变为红色C.SO2通入氯水中使之褪色D.SO2通入饱和H2S溶液中析出浅黄色沉淀
D
【当堂检测】
目标二
二、SO2 化学性质:
(2)与碱反应 :
3.具有酸性氧化物通性(与CO2相似)
SO2 + Ca(OH)2 = CaSO3↓+H2O
(1)与水反应:
CO2与SO2都能使澄清石灰水变浑浊,那么如何区别它们呢?
SO2+H2O H2SO3(亚硫酸)
SO2+2OH- = SO32-+H2O
(3)与碱性氧化物反应:
SO2+Na2O = Na2SO3
(亚硫酸钠)
目标二
课本102页
银耳为什么这样白?
利用二氧化硫的漂白性
二、SO2 化学性质:
4. 漂白性
现象:品红溶液退色,加热后溶液又恢复到红色溶液
H2SO3+品红=无色物质
不稳定
SO2+H2O H2SO3(亚硫酸)
应用:用于检验二氧化硫
与氯水的漂白原理相同吗?
目标二
课本102页
品红溶液
通入Cl2
退色
退色
红色
加热至沸
不显红色
通入SO2
加热至沸
紫色石蕊
通入SO2
通入Cl2
变成红色
先变红后退色
注意:二氧化硫不能漂白指示剂,即使紫色石蕊试液变红,但是不能使其退色。
目标二
*常见的漂白剂及漂白原理比较
漂白剂 HClO、H2O2、Na2O2、O3 SO2 活性炭
胶体
漂白原理
特点
与品红溶液作用
变化
具有强氧化性,将有色物质氧化成无色物质
SO2能与某些有色物质化合成不稳定的无色物质
吸附有
色物质
稳定的,不可逆
不稳定,可逆
化学变化
化学变化
物理变化
退 色
退色、加热后又变红
退 色
稳定的,不可逆
1. 下列实验报告记录的实验现象正确的是( )
B
2.下列说法正确的是( )
A.SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂
B.活性炭、胶体、H2O2、O3等都有漂白性
C.氯气具有漂白性
D.Na2O2也有漂白性,其漂白原理和SO2相似
B
【当堂检测】
目标二
SO2
漂白性
特 性
重视环境保护,防止酸雨危害环境!
与H2O反应
与碱反应
酸性氧
化物
与碱性氧化物
氧化性
还原性
+4价
课堂小结
1. 下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②新制氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.③④⑥
C
2.下列说法中不正确的是( )
A.SO2通入酸性高锰酸钾溶液中紫红色退去
B.SO2通入Ba(OH)2溶液中产生白色沉淀
C.久置的Na2SO3溶液中加入盐酸酸化的BaCl2溶液产生白色沉淀
D.SO2通入氯水中无明显现象
D
【当堂检测】
目标二
3. 某化学研究性学习小组,开展实验探究常温下非金属氧化物形成的某未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入,发现浑浊又变澄清。由此该小组成员对气体的成分提出猜想。
提出猜想
猜想1:气体可能为CO2;
猜想2:________________________________________;
猜想3:_______________________________________。
为了验证猜想,该小组设计实验进一步探究。
气体可能为SO2
气体可能为CO2和SO2的混合物
【当堂检测】
实验探究 该小组利用如图所示装置,将气体从a端通入,则:
(1)B中盛装的试剂应为________(填字母)。
A.NaCl溶液 B.酸性KMnO4溶液
C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是___________________________________。
(3)D中澄清石灰水的作用是_________________________________。
得出结论 通过该实验,小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
由上述现象小组同学可确认该气体的成分是__________________。
B
检验SO2气体
检验CO2气体
SO2和CO2
第2节 硫的转化
第2课时 二氧化硫
学习目标
1. 通过阅读课本101页,能说出硫元素在物质中具有不同的价态,学会利用氧化还原反应分析不同价态硫元素的物质之间的相互转化 ; 2.通过实验探究,学会分析归纳二氧化硫的化学性质,并能够写出相关方程式; 3. 通过探究二氧化硫的主要性质,养成认真细致和严谨求实的科学态度。
(重难点)
目标一
课本100页
思考:
硫元素化合价有-2、0、+4、+6价
1. 哪些含硫元素的物质只具有氧化性?
2. 哪些含硫元素的物质只具有还原性?
3. 哪些含硫元素的物质既具有氧化性又具有还原性?
目标一
课本101页
无色
气体
有刺激性
有毒
比空气大
易溶于水(常温、常压下, 1 : 40)
颜色:
状态:
气味:
毒性:
密度:
溶解度:
一、SO2 物理性质:
目标二
课本102页
思考:根据SO2中S元素的化合价从氧化还原角度推测它应该具有怎样的化学性质?
可降
可升
可降
SO2既具有还原性又具有氧化性。
理论推断:
目标二
——SO2的氧化性和还原性实验探究
二、SO2 化学性质:
目的 探究SO2的还原性 探究SO2的氧化性
试剂 SO2、KMnO4溶液(或氯水)、稀盐酸、BaCl2溶液 SO2、氢硫酸
方案 将SO2通入KMnO4溶液(或氯水)中,再加入BaCl2溶液,最后加入稀盐酸 SO2通入氢硫酸中
现象 KMnO4溶液(或氯水)褪色,加入BaCl2溶液有白色沉淀生成,加入稀盐酸,沉淀不溶解 出现浅黄色浑浊
转化
结论
SO2 → SO42-
SO2 → S
目标二
课本101页
1.较弱氧化性
2H2S+SO2
失4e-
-2 +4
得4e-
还原剂 氧化剂
二、 SO2 化学性质
+4
S
被还原
0
S
3S ↓ +2H2O
0
目标二
课本102页
+4
S
+6
S
被氧化
二. SO2 化学性质
催化剂
△
2SO2 + O2
常见氧化剂
有哪些?
O2、Cl2、I2、
Br2、HNO3,
KMnO4(H+)等
(1)与O2反应
(2)与氯水反应
SO2 + I2 +2H2O = H2SO4+2HI
2SO3
SO2 + Cl2+2H2O = H2SO4+2HCl
2.较强的还原性
碘水退色
氯水退色
SO2+Br2+2H2O=H2SO4+2HBr
溴水退色
目标二
课本102页
现象:紫色的高锰酸钾退色
注意:这个反应体现的是SO2的还原性,
而不是漂白性
2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+
(3)与酸性的高锰酸钾溶液反应
目标二
课本102页
D
2.下列现象说明SO2具有氧化性的是( )A .SO2通入酸性高锰酸钾溶液中使之褪色B.SO2通入石蕊溶液中使之变为红色C.SO2通入氯水中使之褪色D.SO2通入饱和H2S溶液中析出浅黄色沉淀
D
【当堂检测】
目标二
二、SO2 化学性质:
(2)与碱反应 :
3.具有酸性氧化物通性(与CO2相似)
SO2 + Ca(OH)2 = CaSO3↓+H2O
(1)与水反应:
CO2与SO2都能使澄清石灰水变浑浊,那么如何区别它们呢?
SO2+H2O H2SO3(亚硫酸)
SO2+2OH- = SO32-+H2O
(3)与碱性氧化物反应:
SO2+Na2O = Na2SO3
(亚硫酸钠)
目标二
课本102页
银耳为什么这样白?
利用二氧化硫的漂白性
二、SO2 化学性质:
4. 漂白性
现象:品红溶液退色,加热后溶液又恢复到红色溶液
H2SO3+品红=无色物质
不稳定
SO2+H2O H2SO3(亚硫酸)
应用:用于检验二氧化硫
与氯水的漂白原理相同吗?
目标二
课本102页
品红溶液
通入Cl2
退色
退色
红色
加热至沸
不显红色
通入SO2
加热至沸
紫色石蕊
通入SO2
通入Cl2
变成红色
先变红后退色
注意:二氧化硫不能漂白指示剂,即使紫色石蕊试液变红,但是不能使其退色。
目标二
*常见的漂白剂及漂白原理比较
漂白剂 HClO、H2O2、Na2O2、O3 SO2 活性炭
胶体
漂白原理
特点
与品红溶液作用
变化
具有强氧化性,将有色物质氧化成无色物质
SO2能与某些有色物质化合成不稳定的无色物质
吸附有
色物质
稳定的,不可逆
不稳定,可逆
化学变化
化学变化
物理变化
退 色
退色、加热后又变红
退 色
稳定的,不可逆
1. 下列实验报告记录的实验现象正确的是( )
B
2.下列说法正确的是( )
A.SO2具有漂白性,能使品红溶液和酸性KMnO4溶液褪色且常作食品的漂白剂
B.活性炭、胶体、H2O2、O3等都有漂白性
C.氯气具有漂白性
D.Na2O2也有漂白性,其漂白原理和SO2相似
B
【当堂检测】
目标二
SO2
漂白性
特 性
重视环境保护,防止酸雨危害环境!
与H2O反应
与碱反应
酸性氧
化物
与碱性氧化物
氧化性
还原性
+4价
课堂小结
1. 下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②新制氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.③④⑥
C
2.下列说法中不正确的是( )
A.SO2通入酸性高锰酸钾溶液中紫红色退去
B.SO2通入Ba(OH)2溶液中产生白色沉淀
C.久置的Na2SO3溶液中加入盐酸酸化的BaCl2溶液产生白色沉淀
D.SO2通入氯水中无明显现象
D
【当堂检测】
目标二
3. 某化学研究性学习小组,开展实验探究常温下非金属氧化物形成的某未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入,发现浑浊又变澄清。由此该小组成员对气体的成分提出猜想。
提出猜想
猜想1:气体可能为CO2;
猜想2:________________________________________;
猜想3:_______________________________________。
为了验证猜想,该小组设计实验进一步探究。
气体可能为SO2
气体可能为CO2和SO2的混合物
【当堂检测】
实验探究 该小组利用如图所示装置,将气体从a端通入,则:
(1)B中盛装的试剂应为________(填字母)。
A.NaCl溶液 B.酸性KMnO4溶液
C.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是___________________________________。
(3)D中澄清石灰水的作用是_________________________________。
得出结论 通过该实验,小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
由上述现象小组同学可确认该气体的成分是__________________。
B
检验SO2气体
检验CO2气体
SO2和CO2
