化学人教版(2019)选择性必修2 3.3.2离子晶体(共18张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.3.2离子晶体(共18张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 11:49:41 | ||
图片预览



文档简介
(共18张PPT)
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
离子晶体
下列晶体构成微粒有什么共同点?微粒之间存在哪种相同的作用力?
离子晶体
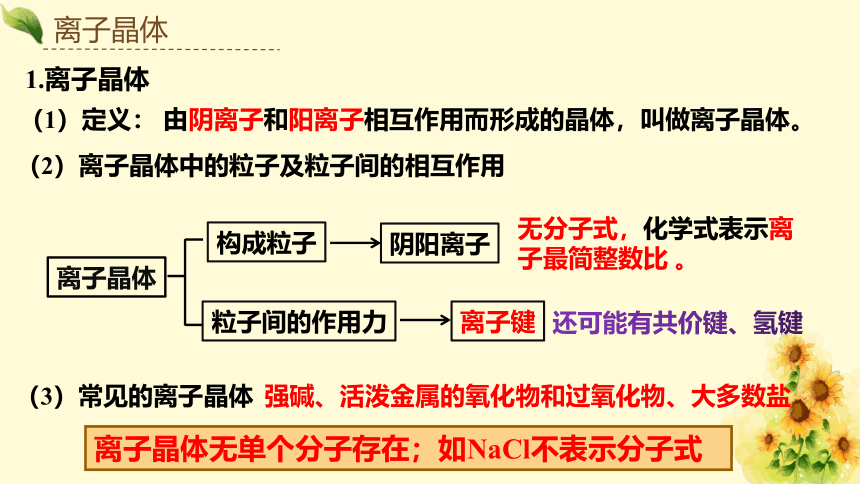
1.离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
(1)定义:
(3)常见的离子晶体
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
(2)离子晶体中的粒子及粒子间的相互作用
无分子式,化学式表示离子最简整数比 。
还可能有共价键、氢键
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体。
离子晶体无单个分子存在;如NaCl不表示分子式
离子晶体
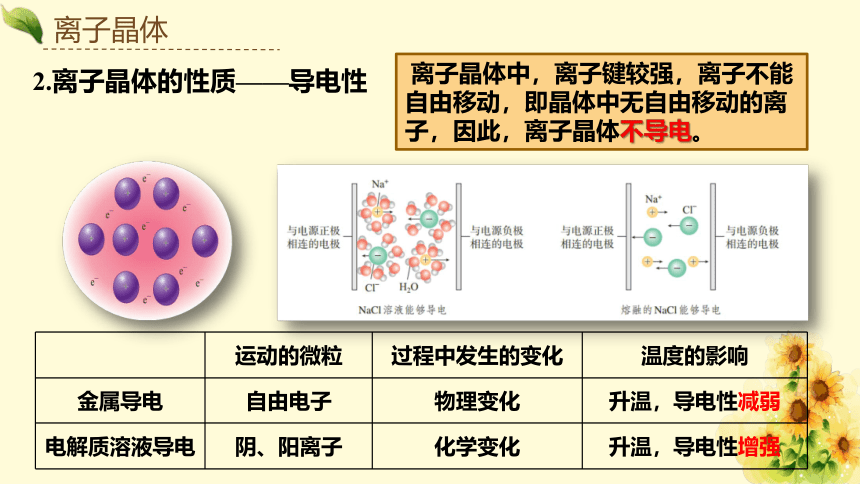
2.离子晶体的性质——导电性
运动的微粒 过程中发生的变化 温度的影响
金属导电 自由电子 物理变化 升温,导电性减弱
电解质溶液导电 阴、阳离子 化学变化 升温,导电性增强
离子晶体中,离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
离子晶体
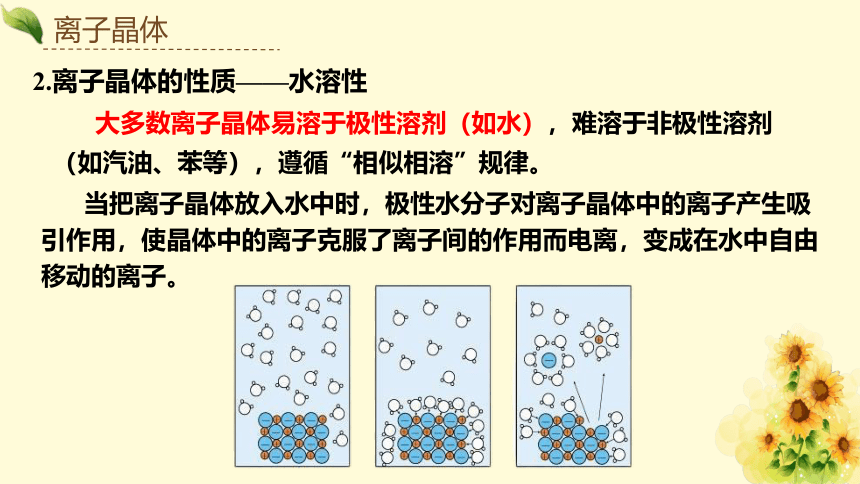
2.离子晶体的性质——水溶性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
离子晶体
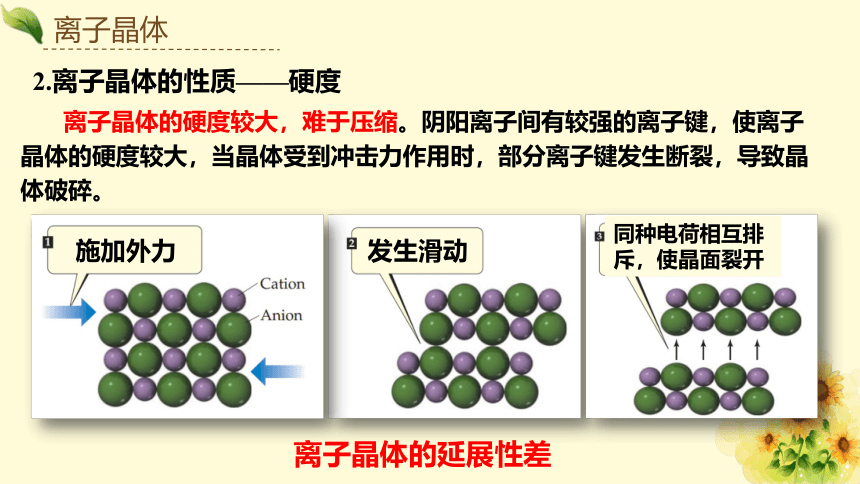
2.离子晶体的性质——硬度
离子晶体的硬度较大,难于压缩。阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
同种电荷相互排斥,使晶面裂开
离子晶体的延展性差
离子晶体
2.离子晶体的性质——熔沸点
离子晶体一般具有较高的熔、沸点和难挥发的性质。
离子晶体的熔点差距也较大
化合物 熔点 /℃ 化合物 熔点 /℃
CaO 2613 Na2SO4 884
CuCl2 1326 Ca2SiO4 2130
NH4NO3 169.6 Na3PO4 340
BaSO4 1580 CH3COOCs 194
LiPF6 200分解温度 NaNO2 270
P88【思考与讨论】 我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(1)特征:离子键没有方向性和饱和性。
(2)影响因素:一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大。
3.离子键
离子晶体
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
NaCl晶胞
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
离子晶体
4.常见离子晶体的结构
Cl
Na+
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构型是 。
正八面体
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
NaCl晶胞
离子晶体
4.常见离子晶体的结构
Na+:体心和棱心。 Cl :顶点和面心
CsCl晶胞
离子晶体
4.常见离子晶体的结构
(1)每个晶胞含铯离子、氯离子的个数:
Cs+:1
Cl-:8×=1
(2)配位数
每个Cs+周围与之等距且距离最近的Cl-有____个。
它们所围成的空间几何构型是 。
CsCl晶胞
8
正六面体
离子晶体
4.常见离子晶体的结构
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
Cl-
Cs+
离子晶体
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。有的还存在电中性分子( H2O、NH3等)。
如CuSO4 5H2O中还存在共价键、分子间作用力,有些还有氢键等,但主体是离子键。
有些离子组成的物质在常温下甚至以液态形式存在。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
C2H5NH3NO3 12
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
离子晶体 共价晶体 分子晶体 金属晶体
存在微粒 阴阳离子 原子 分子 金属离子、自由电子
微粒间作用 离子键 共价键 分子间作用力 金属键
主要性质 硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 硬度小,水溶液能够导电,溶沸点低 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
课堂小结
明辨是非
(1) 离子晶体中一定含有金属元素( )
(2) 由金属元素和非金属元素组成的晶体一定是离子晶体( )
(3) 有些离子晶体中除含离子键外还存在共价键( )
(4) 离子晶体的熔点一定低于共价晶体的熔点( )
(5) 离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(6) 某些离子晶体受热失去结晶水,属于物理变化( )
(7)任何晶体中,若含有阳离子也一定含有阴离子( )
(8)离子晶体的结构中不可能存在电中性的分子( )
(9)离子晶体中一定存在离子键( )
×
×
√
×
×
×
×
×
√
1.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,进行下列实验。其中合理、可靠的是( )
A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
B
课堂练习
晶体 熔点/℃
NaCl 801
CuCl 426
2.已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
② Cu+和Cl-的空间位置关系?
① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?
离子 r/pm
Na+ 102
Cu+ 60
③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
4
课堂练习
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
归纳小结
第三章 晶体结构与性质
第三节 金属晶体与离子晶体
第2课时 离子晶体
胆矾
萤石
重晶石
烧碱
CuSO4·5H2O
CaF2
BaSO4
NaOH
离子晶体
下列晶体构成微粒有什么共同点?微粒之间存在哪种相同的作用力?
离子晶体
1.离子晶体
强碱、活泼金属的氧化物和过氧化物、大多数盐
(1)定义:
(3)常见的离子晶体
构成粒子
离子晶体
阴阳离子
粒子间的作用力
离子键
(2)离子晶体中的粒子及粒子间的相互作用
无分子式,化学式表示离子最简整数比 。
还可能有共价键、氢键
由阴离子和阳离子相互作用而形成的晶体,叫做离子晶体。
离子晶体无单个分子存在;如NaCl不表示分子式
离子晶体
2.离子晶体的性质——导电性
运动的微粒 过程中发生的变化 温度的影响
金属导电 自由电子 物理变化 升温,导电性减弱
电解质溶液导电 阴、阳离子 化学变化 升温,导电性增强
离子晶体中,离子键较强,离子不能自由移动,即晶体中无自由移动的离子,因此,离子晶体不导电。
离子晶体
2.离子晶体的性质——水溶性
大多数离子晶体易溶于极性溶剂(如水),难溶于非极性溶剂(如汽油、苯等),遵循“相似相溶”规律。
当把离子晶体放入水中时,极性水分子对离子晶体中的离子产生吸引作用,使晶体中的离子克服了离子间的作用而电离,变成在水中自由移动的离子。
离子晶体
2.离子晶体的性质——硬度
离子晶体的硬度较大,难于压缩。阴阳离子间有较强的离子键,使离子晶体的硬度较大,当晶体受到冲击力作用时,部分离子键发生断裂,导致晶体破碎。
发生滑动
施加外力
同种电荷相互排斥,使晶面裂开
离子晶体的延展性差
离子晶体
2.离子晶体的性质——熔沸点
离子晶体一般具有较高的熔、沸点和难挥发的性质。
离子晶体的熔点差距也较大
化合物 熔点 /℃ 化合物 熔点 /℃
CaO 2613 Na2SO4 884
CuCl2 1326 Ca2SiO4 2130
NH4NO3 169.6 Na3PO4 340
BaSO4 1580 CH3COOCs 194
LiPF6 200分解温度 NaNO2 270
P88【思考与讨论】 我们知道,金属的熔点差异很大,如钨的熔点为 3410 ℃。而常温下,汞却是液体。离子晶体的熔点是不是也差异很大呢?
阴阳离子间通过静电作用所形成的强烈的相互作用叫做离子键。
成键粒子
键的本质
静电引力和斥力
(1)特征:离子键没有方向性和饱和性。
(2)影响因素:一般说来,阴、阳离子的电荷数越多,离子半径越小,离子键越强,离子晶体的熔、沸点越高,硬度越大。
3.离子键
离子晶体
硬度 熔点 沸点
NaCl 大 801℃ 1413℃
CsCl 645℃ 645℃
NaCl晶胞
(1)每个晶胞含钠离子、氯离子的个数:
Na+:12×+1=4
Cl-:8×+6×=4
离子晶体
4.常见离子晶体的结构
Cl
Na+
(2)配位数
一种离子周围最邻近的带相反电荷的离子数目
每个Na+周围与之等距且距离最近的Cl-有____个。
6
它们所围成的空间几何构型是 。
正八面体
(3)每个Na+周围与之等距且距离最近的Cl-有___个,Na+有___个。
每个Cl-周围与之等距且距离最近的Na+有____个,Cl-有____个。
Cl-
Na+
6
12
6
12
NaCl晶胞
离子晶体
4.常见离子晶体的结构
Na+:体心和棱心。 Cl :顶点和面心
CsCl晶胞
离子晶体
4.常见离子晶体的结构
(1)每个晶胞含铯离子、氯离子的个数:
Cs+:1
Cl-:8×=1
(2)配位数
每个Cs+周围与之等距且距离最近的Cl-有____个。
它们所围成的空间几何构型是 。
CsCl晶胞
8
正六面体
离子晶体
4.常见离子晶体的结构
(3)每个Cs+周围与之等距且距离最近的Cl-有___个,Cs+有___个。
每个Cl-周围与之等距且距离最近的Cs+有____个,Cl-有____个。
8
6
8
6
Cl-
Cs+
离子晶体
实际上,大量离子晶体中的阴离子或阳离子不是单原子离子。有的还存在电中性分子( H2O、NH3等)。
如CuSO4 5H2O中还存在共价键、分子间作用力,有些还有氢键等,但主体是离子键。
有些离子组成的物质在常温下甚至以液态形式存在。
化合物 熔点/℃
NH4NO3 169.6
Ca(H2PO4)2 109
C2H5NH3NO3 12
离子液体:熔点低、稳定性强、是优良的绿色溶剂等优点
离子晶体 共价晶体 分子晶体 金属晶体
存在微粒 阴阳离子 原子 分子 金属离子、自由电子
微粒间作用 离子键 共价键 分子间作用力 金属键
主要性质 硬而脆,易溶于极性溶剂,熔化时能够导电,溶沸点高 质地硬,不溶于大多数溶剂,导电性差,熔沸点很高 硬度小,水溶液能够导电,溶沸点低 金属光泽,是电和热的良导体,熔沸点高或低
实例 食盐晶体 金刚石 NH3、HCl 镁、铝
课堂小结
明辨是非
(1) 离子晶体中一定含有金属元素( )
(2) 由金属元素和非金属元素组成的晶体一定是离子晶体( )
(3) 有些离子晶体中除含离子键外还存在共价键( )
(4) 离子晶体的熔点一定低于共价晶体的熔点( )
(5) 离子晶体受热熔化,破坏化学键,吸收能量,属于化学变化( )
(6) 某些离子晶体受热失去结晶水,属于物理变化( )
(7)任何晶体中,若含有阳离子也一定含有阴离子( )
(8)离子晶体的结构中不可能存在电中性的分子( )
(9)离子晶体中一定存在离子键( )
×
×
√
×
×
×
×
×
√
1.为了确定SbCl3、SbCl5、SnCl4是否为离子化合物,进行下列实验。其中合理、可靠的是( )
A.观察常温下的状态,SbCl5是苍黄色液体,SnCl4为无色液体。结论:SbCl5和SnCl4都是离子化合物
B.测定SbCl3、SbCl5、SnCl4的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:SbCl3、SbCl5、SnCl4都不是离子化合物
C.将SbCl3、SbCl5、SnCl4溶解于水中,滴入HNO3酸化的AgNO3溶液,产生白色沉淀。结论:SbCl3、SbCl5、SnCl4都是离子化合物
D.测定SbCl3、SbCl5、SnCl4水溶液的导电性,发现它们都可以导电。结论:SbCl3、SbCl5、SnCl4都是离子化合物
B
课堂练习
晶体 熔点/℃
NaCl 801
CuCl 426
2.已知氯化亚铜(CuCl)的晶胞结构如图所示,试分析:
② Cu+和Cl-的空间位置关系?
① Cu+周围等距离且最近的Cl-? Cl-周围等距离且最近的Cu+ ?
离子 r/pm
Na+ 102
Cu+ 60
③ 试根据NaCl 和CuCl中Na+和Cu+半径推测两种晶体熔点高低?
4
课堂练习
事实上,纯粹的典型晶体是不多的,大多数晶体是它们之间的过渡晶体。
首先看物质的状态,一般情况下是固体>液体>气体;再看物质所属类型,一般是共价晶体>离子晶体>分子晶体(注意:不是绝对的,如氧化铝的熔点大于晶体硅),结构类型相同时再根据相应规律进行判断。同类晶体熔、沸点比较思路:共价晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径;金属晶体→金属键强弱→金属阳离子所带电荷、金属阳离子半径。
比较不同晶体熔、沸点的基本思路
归纳小结
