化学人教版(2019)必修第二册8.1.1金属矿物、海水资源的开发利用(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册8.1.1金属矿物、海水资源的开发利用(共17张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 18:39:26 | ||
图片预览




文档简介
(共17张PPT)
第八章 化学与可持续发展
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
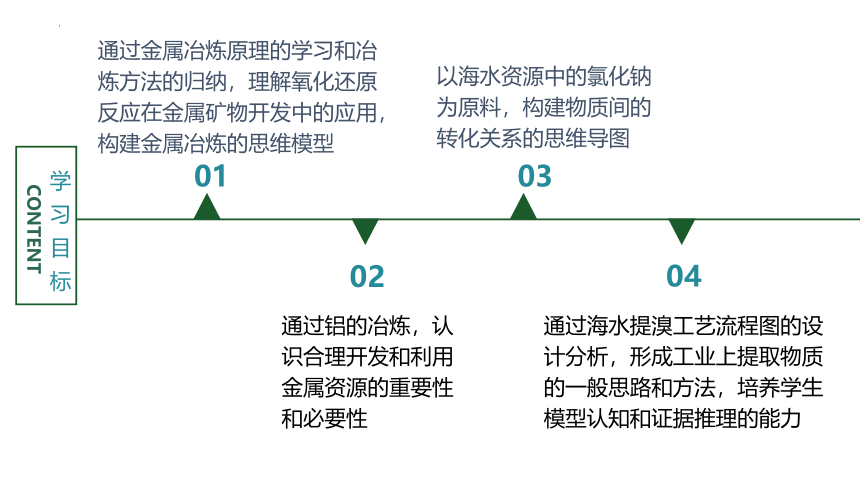
学习目标
CONTENT
01
02
03
04
通过金属冶炼原理的学习和冶炼方法的归纳,理解氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模型
通过铝的冶炼,认识合理开发和利用金属资源的重要性和必要性
以海水资源中的氯化钠为原料,构建物质间的转化关系的思维导图
通过海水提溴工艺流程图的设计分析,形成工业上提取物质的一般思路和方法,培养学生模型认知和证据推理的能力
知识点一、金属矿物的开发利用
1.金属元素的存在:
除了金、铂等极少数金属外,绝大多数金属以化合物的形式存在于自然界。
是用还原的方法使金属化合物中的金属离子得到电子变成金属原子。
n+
M
得电子
M
(被还原)
2 .金属的冶炼
要根据金属的活动性顺序不同,采取不同的冶炼方法
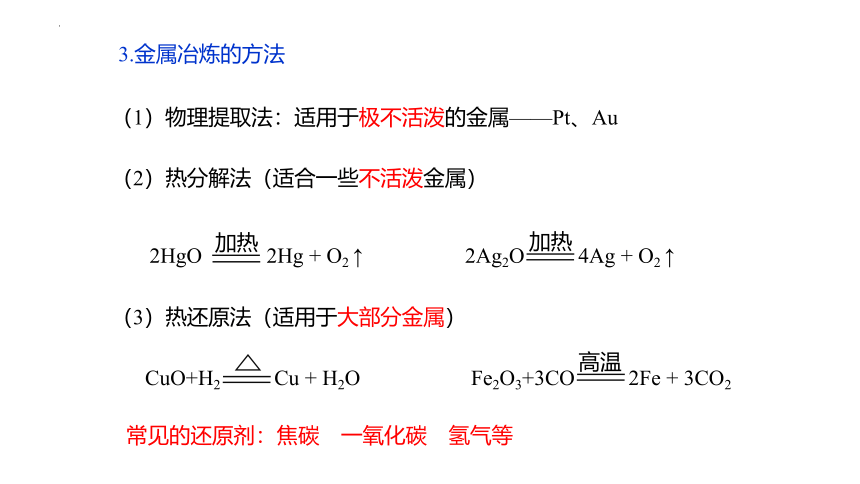
(2)热分解法(适合一些不活泼金属)
(1)物理提取法:适用于极不活泼的金属——Pt、Au
3.金属冶炼的方法
(3)热还原法(适用于大部分金属)
常见的还原剂:焦碳 一氧化碳 氢气等
2HgO 2Hg + O2 ↑
加热
2Ag2O 4Ag + O2 ↑
加热
CuO+H2 Cu + H2O
Fe2O3+3CO 2Fe + 3CO2
高温
(4)热电解法(适合一些非常活泼金属)
拓展视野
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。然而自从美国青年化学家霍尔发明电解制铝法后,制铝工 艺不断改进,现在人们已经熟练掌握了从铝土矿(主要成 分是Al2O3,当然还是有很多其它杂质的)中冶炼铝的技术了,使得制铝成本大大下降,铝的价格也一降千丈,走入千家万户。
MgCl2 (熔融) Mg + Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
冰晶石
电解
2NaCl (熔融) 2Na + Cl2 ↑
电解
4.铝热反应
反应现象:镁条剧烈燃烧,放出大量热,发出耀眼白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al ==== 2Fe + Al2O3
高温
铝热剂
3MnO2+4Al ==== 3Mn+ 2Al2O3
高温
Cr2O3+2Al ==== 2Cr + Al2O3
高温
3Co3O4+8Al ==== 9Co + 4Al2O3
高温
其他的铝热反应:
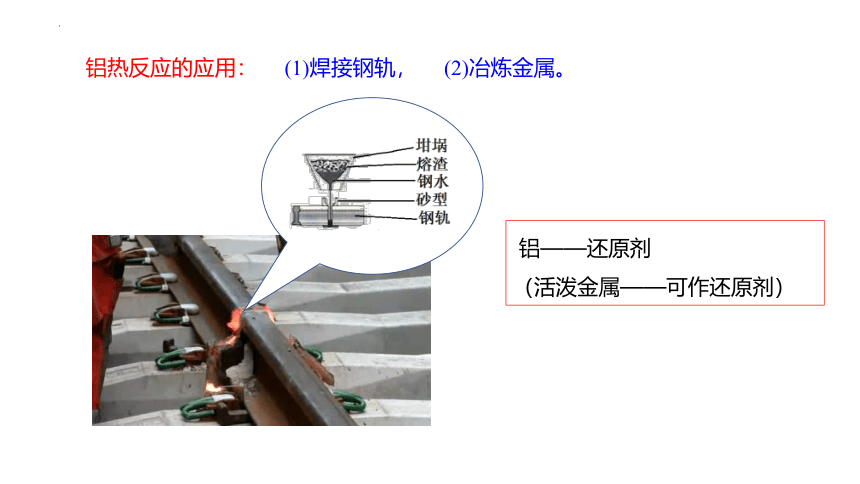
铝热反应的应用: (1)焊接钢轨, (2)冶炼金属。
铝——还原剂
(活泼金属——可作还原剂)
5.合理开发和利用矿物资源
合理开发和利用矿物资源,主要途径有:
(1)提高金属矿物的利用率
(2)减少金属的使用量
(3)加强金属资源的回收和再利用
(4)使用其他材料代替金属材料
金属铝的回收与利用
知识点二、海水资源的开发利用
1.海水淡化
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
海水蒸馏原理示意图
原理:
加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸汽冷凝得到淡水。
2.海水制盐
从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。
盐场工人们在盐田晒盐
收获
3.海水提镁
海水
熟石灰
过滤
Mg(OH)2
盐酸
MgCl2溶液
蒸发浓缩,冷却结晶,过滤
MgCl2.6H2O
HCl干燥气流
加热
MgCl2
熔融
电解
Mg
以海水为原料,写出MgCl2的提取和Mg的制备流程。
请写出有关的化学反应方程式:
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2 (熔融) Mg + Cl2 ↑
电解
4.海水提溴
操作步骤:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
请写出有关的化学反应方程式:
Cl2+2NaBr=Br2+2NaCl
Br2+SO2+2H2O=2HBr+H2SO4
Cl2+2HBr=Br2+2HCl
海水
浓缩酸化
浓缩海水 Br—
通入Cl2
海水
( Cl— 、Br2 )
通入空气
吹出溴蒸汽
吸收塔
(SO2吸收剂 )
反应后
富集溴气
Br—、SO42-
通入Cl2
( Br2 、 Cl— )
萃取分液
单质溴
5.海水提碘
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
2KI + H2O2 + H2SO4=== I2+ K2SO4 + 2H2O
当堂训练
1.下列金属适合用热分解法冶炼的是( )
A.Na B.Al C.Fe D.Ag
解析:金属活动性顺序表中Al及位于Al之前的金属采用电解法冶炼,位于Al之后Hg之前的金属采用热还原法冶炼,Hg、Ag采用热分解法冶炼,Pt、Au采用富集法来获取,故D正确。
D
当堂训练
2.以下方法可用于工业冶炼金属的是( )
A.电解熔融AlCl3获取金属铝 B.电解MgCl2溶液获取金属镁
C.用CO还原铁矿石来获取金属铁 D.电解饱和食盐水来获取金属钠
解析:A项,AlCl3是共价化合物,熔融态不导电,工业上是电解熔融Al2O3获取金属铝,错误;B项,电解熔融MgCl2可以获取金属镁,电解MgCl2溶液得到的是氢氧化镁、氢气和氯气,错误;C项,用CO还原铁矿石来获取金属铁是工业炼铁的原理,属于热还原法,正确;D项,电解饱和食盐水得到的是氢氧化钠、氢气和氯气,电解熔融的氯化钠可以冶炼金属钠,错误。
C
当堂训练
3.许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
解析:海水中的各种元素都以化合态存在,要生成单质必然发生化学反应,A、B、C均错。海水晒盐得NaCl,蒸馏海水得淡水只发生物理变化。
D
4.海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
当堂训练
解析:A项,海水中通入氯气可置换出溴,正确;B项,粗盐提纯包括溶解、除杂、过滤、结晶、重结晶等,正确;C项,氢氧化钠成本较高,工业上常选用生石灰或石灰水作沉淀剂,错误;D项,先吹出溴再用SO2吸收可实现溴的富集,正确。故选C项。
C
第八章 化学与可持续发展
第一节 自然资源的开发利用
第1课时 金属矿物、海水资源的开发利用
学习目标
CONTENT
01
02
03
04
通过金属冶炼原理的学习和冶炼方法的归纳,理解氧化还原反应在金属矿物开发中的应用,构建金属冶炼的思维模型
通过铝的冶炼,认识合理开发和利用金属资源的重要性和必要性
以海水资源中的氯化钠为原料,构建物质间的转化关系的思维导图
通过海水提溴工艺流程图的设计分析,形成工业上提取物质的一般思路和方法,培养学生模型认知和证据推理的能力
知识点一、金属矿物的开发利用
1.金属元素的存在:
除了金、铂等极少数金属外,绝大多数金属以化合物的形式存在于自然界。
是用还原的方法使金属化合物中的金属离子得到电子变成金属原子。
n+
M
得电子
M
(被还原)
2 .金属的冶炼
要根据金属的活动性顺序不同,采取不同的冶炼方法
(2)热分解法(适合一些不活泼金属)
(1)物理提取法:适用于极不活泼的金属——Pt、Au
3.金属冶炼的方法
(3)热还原法(适用于大部分金属)
常见的还原剂:焦碳 一氧化碳 氢气等
2HgO 2Hg + O2 ↑
加热
2Ag2O 4Ag + O2 ↑
加热
CuO+H2 Cu + H2O
Fe2O3+3CO 2Fe + 3CO2
高温
(4)热电解法(适合一些非常活泼金属)
拓展视野
由于早期炼铝十分困难,所以铝的价格十分昂贵,一度超越金银之上,直至19世纪上半叶,铝还是欧洲许多高级珠宝店的高档货。然而自从美国青年化学家霍尔发明电解制铝法后,制铝工 艺不断改进,现在人们已经熟练掌握了从铝土矿(主要成 分是Al2O3,当然还是有很多其它杂质的)中冶炼铝的技术了,使得制铝成本大大下降,铝的价格也一降千丈,走入千家万户。
MgCl2 (熔融) Mg + Cl2 ↑
电解
2Al2O3 (熔融) 4Al + 3O2 ↑
冰晶石
电解
2NaCl (熔融) 2Na + Cl2 ↑
电解
4.铝热反应
反应现象:镁条剧烈燃烧,放出大量热,发出耀眼白光,纸漏斗内剧烈反应,纸漏斗被烧穿,有熔融物落入沙中。
Fe2O3+2Al ==== 2Fe + Al2O3
高温
铝热剂
3MnO2+4Al ==== 3Mn+ 2Al2O3
高温
Cr2O3+2Al ==== 2Cr + Al2O3
高温
3Co3O4+8Al ==== 9Co + 4Al2O3
高温
其他的铝热反应:
铝热反应的应用: (1)焊接钢轨, (2)冶炼金属。
铝——还原剂
(活泼金属——可作还原剂)
5.合理开发和利用矿物资源
合理开发和利用矿物资源,主要途径有:
(1)提高金属矿物的利用率
(2)减少金属的使用量
(3)加强金属资源的回收和再利用
(4)使用其他材料代替金属材料
金属铝的回收与利用
知识点二、海水资源的开发利用
1.海水淡化
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。
海水蒸馏原理示意图
原理:
加热到水的沸点,液态水变为水蒸气与海水中的盐分离,水蒸汽冷凝得到淡水。
2.海水制盐
从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。
盐场工人们在盐田晒盐
收获
3.海水提镁
海水
熟石灰
过滤
Mg(OH)2
盐酸
MgCl2溶液
蒸发浓缩,冷却结晶,过滤
MgCl2.6H2O
HCl干燥气流
加热
MgCl2
熔融
电解
Mg
以海水为原料,写出MgCl2的提取和Mg的制备流程。
请写出有关的化学反应方程式:
Mg(OH)2+2HCl===MgCl2+2H2O
MgCl2 (熔融) Mg + Cl2 ↑
电解
4.海水提溴
操作步骤:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸气,将溴单质吹入盛有二氧化硫溶液的吸收塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
请写出有关的化学反应方程式:
Cl2+2NaBr=Br2+2NaCl
Br2+SO2+2H2O=2HBr+H2SO4
Cl2+2HBr=Br2+2HCl
海水
浓缩酸化
浓缩海水 Br—
通入Cl2
海水
( Cl— 、Br2 )
通入空气
吹出溴蒸汽
吸收塔
(SO2吸收剂 )
反应后
富集溴气
Br—、SO42-
通入Cl2
( Br2 、 Cl— )
萃取分液
单质溴
5.海水提碘
海带
海带灰
溶解过滤
灼烧
残渣
含I-的溶液
稀H2SO4
H2O2
含I2的溶液
含I2的有机溶液
萃取
2KI + H2O2 + H2SO4=== I2+ K2SO4 + 2H2O
当堂训练
1.下列金属适合用热分解法冶炼的是( )
A.Na B.Al C.Fe D.Ag
解析:金属活动性顺序表中Al及位于Al之前的金属采用电解法冶炼,位于Al之后Hg之前的金属采用热还原法冶炼,Hg、Ag采用热分解法冶炼,Pt、Au采用富集法来获取,故D正确。
D
当堂训练
2.以下方法可用于工业冶炼金属的是( )
A.电解熔融AlCl3获取金属铝 B.电解MgCl2溶液获取金属镁
C.用CO还原铁矿石来获取金属铁 D.电解饱和食盐水来获取金属钠
解析:A项,AlCl3是共价化合物,熔融态不导电,工业上是电解熔融Al2O3获取金属铝,错误;B项,电解熔融MgCl2可以获取金属镁,电解MgCl2溶液得到的是氢氧化镁、氢气和氯气,错误;C项,用CO还原铁矿石来获取金属铁是工业炼铁的原理,属于热还原法,正确;D项,电解饱和食盐水得到的是氢氧化钠、氢气和氯气,电解熔融的氯化钠可以冶炼金属钠,错误。
C
当堂训练
3.许多国家十分重视海水资源的综合利用,不需要化学变化就能够从海水中获得的物质是( )
A.氯、溴、碘 B.钠、镁、铝
C.烧碱、氢气 D.食盐、淡水
解析:海水中的各种元素都以化合态存在,要生成单质必然发生化学反应,A、B、C均错。海水晒盐得NaCl,蒸馏海水得淡水只发生物理变化。
D
4.海水开发利用的部分过程如图所示。下列说法错误的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
当堂训练
解析:A项,海水中通入氯气可置换出溴,正确;B项,粗盐提纯包括溶解、除杂、过滤、结晶、重结晶等,正确;C项,氢氧化钠成本较高,工业上常选用生石灰或石灰水作沉淀剂,错误;D项,先吹出溴再用SO2吸收可实现溴的富集,正确。故选C项。
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
