化学人教版(2019)必修第二册7.3.2乙酸(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.2乙酸(共26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 12.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 11:29:16 | ||
图片预览






文档简介
(共26张PPT)
乙 酸
第七章 第三节 乙醇与乙酸
学习目标
核心素养
1.从官能团的角度认识乙酸的组成、结构、性质,形成宏观辨识与微观探析的化学核心素养。
2.从乙酸分子内化学键的变化预测陌生物质的性质,形成“结构决定性质”的观念。
3. 设计实验探究乙酸的结构与性质的关系,形成实验创新与科学探究的化学核心素养。
1.了解乙酸的分子组成、结构、官能团。
2.了解乙酸的物理性质,掌握其化学性质。
3.掌握酯化反应的原理和实质。
有强烈刺激性气味的无色液体
易溶于水和乙醇
熔点:16.6℃ 沸点:118℃
当温度低于熔点时,乙酸可凝结成类似冰一样的晶体,所以纯净的乙酸又称冰醋酸。
一、乙酸
(一)物理性质
知识梳理
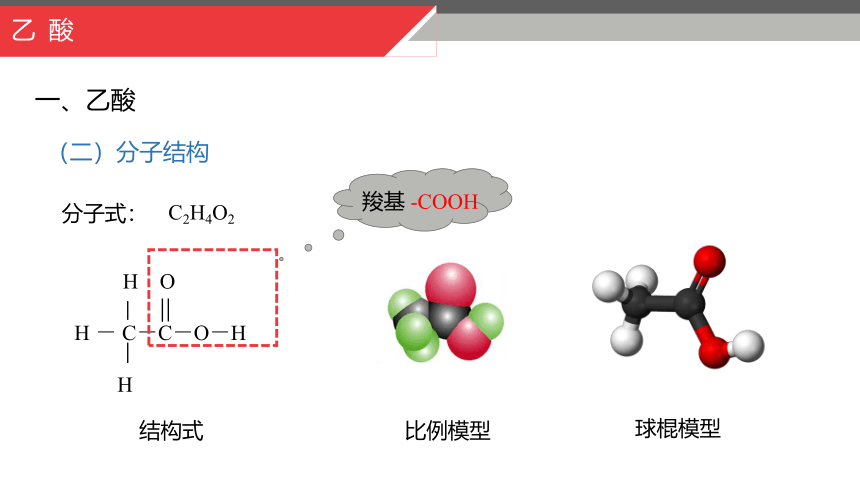
分子式:
C2H4O2
H O
H - C-C-O-H
H
结构式
羧基 -COOH
比例模型
球棍模型
一、乙酸
(二)分子结构
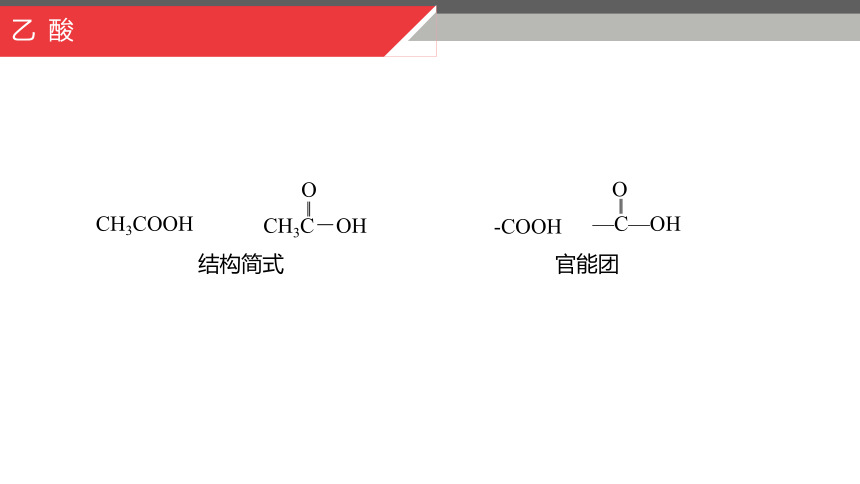
官能团
-COOH
—C—OH
O
‖
结构简式
CH3COOH
O
CH3C-OH
‖
为什么可以用醋除去水垢?
CaCO3 + 2CH3COOH →(CH3COO)2Ca + CO2↑+ H2O
酸性:CH3COOH>H2CO3
如何比较乙酸与碳酸、盐酸的酸性强弱?根据生活经验设计实验方案。
水垢的主要成分为CaCO3
生活常识
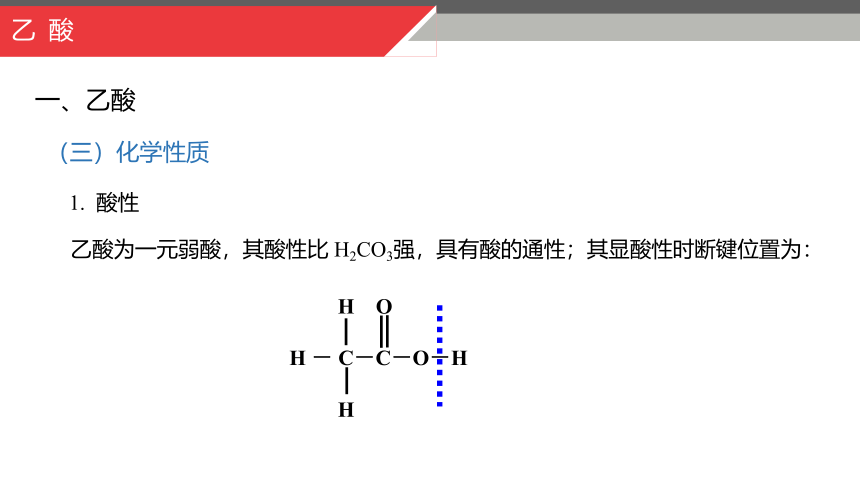
H O
H - C-C-O-H
H
乙酸为一元弱酸,其酸性比 H2CO3强,具有酸的通性;其显酸性时断键位置为:
1. 酸性
一、乙酸
(三)化学性质
①使酸碱指示剂变色(如紫色的石蕊试液变红色)
②与活泼金属(如Mg)反应
④与碱(如NaOH)反应
③与碱性氧化物(如CuO)反应
CH3COOH + NaHCO3 === CH3COONa+CO2↑+H2O
CH3COOH CH3COO- +H+
2CH3COOH + Mg === (CH3COO)2Mg+H2↑
CH3COOH + NaOH === CH3COONa+ H2O
2CH3COOH + CuO ===(CH3COO)2Cu + H2O
2CH3COOH + Mg === 2CH3COO-+Mg2++H2↑
2 CH3COOH + CuO === 2CH3COO-+Cu2+ + H2O
CH3COOH + OH- === CH3COO-+ H2O
CH3COOH + === CH3COO-+CO2↑+H2O
⑤与盐(如Na2CO3、NaHCO3)反应
1. 酸性
(三)化学性质
烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
生活常识
(1) 在试管中加入3 mL乙醇;
(2) 边振荡边加入2 mL浓硫酸和2mL乙酸;
(3) 加入几片碎瓷片;
(4) 用酒精灯小心加热。
2. 酯化反应
(三)化学性质
现象:右侧试管内液体的上层有无色透明的油状液体产生,并有香味。
浓硫酸
CH3COOH + HOC2H5 CH3COOC2H5+H2O
酯化反应:酸与醇反应生成酯和水的反应。
催化剂、吸水剂
①乙醇 ②浓硫酸 ③乙酸
①溶解乙醇;②吸收乙酸;
③降低乙酸乙酯的溶解度,便于分层。
(3)浓硫酸的作用是什么?
(1)装药品的顺序?
(4)饱和碳酸钠溶液的作用是什么?
(2)加热目的是什么?
提高反应速率;
使生成的乙酸乙酯挥发便于收集,提高乙醇乙酸的转化率。
讨论交流
——防止倒吸
(6)导气管不能插入Na2CO3溶液中的原因?
(5)加碎瓷片
——防暴沸
(7)还有其他防倒吸的方法吗?
O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 +H2O
浓硫酸
=
=
O
O
乙酸和乙醇可能是以怎样的方式相互结合形成乙酸乙酯的?
思考探索
浓硫酸
CH3COOH + HOC2H5 CH3COOC2H5+H2O
18O
18O
同位素示踪法
CH3—C—OH + H—18O—C2H5
浓硫酸
=
O
CH3—C—18O—C2H5 + H2O
=
O
CH3COOH + HOCH3
浓硫酸
CH3COOCH3 + H2O
乙酸甲酯
HCOOH + HOCH2CH3
浓硫酸
HCOOCH2CH3 + H2O
甲酸乙酯
酯化反应实质:酸脱羟基,醇脱氢
很多鲜花和水果的香味都来自酯,如草莓中含有乙酸乙酯和乙酸异戊酯,苹果中含有戊酸戊酯等。
这些分子中碳原子数少、相对分子质量较小的低级酯具有一定的挥发性,有芳香气味,难溶于水,可用作饮料、糖果、化妆品中的香料和有机溶剂。
酯类广泛存在于自然界中
陈年老酒格外香
常见的有机化合物的类别、官能团和代表物
烷 烃
官能团
代表物
有机化合物类别
卤代烃
烯 烃
炔 烃
芳香烃
CH4
甲烷
乙烯
苯
乙炔
溴乙烷
-X
碳卤键
CH2
CH2
CH CH
CH3CH2Br
C
C
碳碳双键
C C
碳碳三键
二、官能团与有机化合物的分类
醇
官能团
代表物
有机化合物类别
-OH
羟基
醛
羧酸
酯
醛基
-CHO
O
-C-H
羧基
-COOH
乙醇
乙醛
乙酸乙酯
乙酸
O
-C-
OH
O
-C-
OR
CH3CH2OH
O
-C-
OC2H5
CH3
O
CH3 -C-H
O
CH3 -C-
OH
-COOR
酯基
常见的有机化合物的类别、官能团和代表物
认识有机化合物的一般思路
认识一种有机物,可先从结构入手,分析其碳骨架和官能团,了解它所属的有机物类别;再结合这类有机物的一般性质,推测该有机物可能具有的性质,并通过实验进行验证;在此基础上进一步了解该有机物的用途。
另外,还可以根据有机物发生的化学反应,了解其在有机物转化中的作用。
与认识无机物类似,认识有机物也体现了“结构决定性质”的观念。
各类有机物在结构和性质上具有的明显规律性,有助于我们更好地认识有机物。
方法引导
O
CH3—C—O—H
①
②
①弱酸性,具有酸的通性;酸性比碳酸强。
②酯化反应
浓硫酸
结构
性质
决定
课堂总结
1. 实验室制取少量乙酸乙酯的装置如图,下列关于该实验的叙述中不正确的是 ( )
先向 a 试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止 实验过程中发生倒吸现象
C. 实验时加热试管 a 的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 可将饱和碳酸钠溶液换成氢氧化钠溶液
D
知识巩固
2. 某有机物的结构简式如图,下列关于该有机物的说法正确的是( )
B
A.分子式为C7H6O5
B.1 mol该物质能与4 mol Na发生反应
C.分子中含有两种官能团
D.在水溶液中羧基和羟基均能电离出H+
3. 1 mol 分别与Na、NaOH、NaHCO3、Na2CO3完全反应时,
消耗的Na、NaOH、NaHCO3、Na2CO3的物质的量之比为多少
4∶2∶2∶1
4. 某有机物m g,跟足量金属钠反应生成V L H2;另取m g该有机物与足量碳酸氢钠作用生成V L CO2(同一状况),该有机物分子中含有的官能团可能为 ( )
A
A.一个羧基和一个羟基 B.两个羟基
C.一个羧基 D.两个羧基
乙 酸
第七章 第三节 乙醇与乙酸
学习目标
核心素养
1.从官能团的角度认识乙酸的组成、结构、性质,形成宏观辨识与微观探析的化学核心素养。
2.从乙酸分子内化学键的变化预测陌生物质的性质,形成“结构决定性质”的观念。
3. 设计实验探究乙酸的结构与性质的关系,形成实验创新与科学探究的化学核心素养。
1.了解乙酸的分子组成、结构、官能团。
2.了解乙酸的物理性质,掌握其化学性质。
3.掌握酯化反应的原理和实质。
有强烈刺激性气味的无色液体
易溶于水和乙醇
熔点:16.6℃ 沸点:118℃
当温度低于熔点时,乙酸可凝结成类似冰一样的晶体,所以纯净的乙酸又称冰醋酸。
一、乙酸
(一)物理性质
知识梳理
分子式:
C2H4O2
H O
H - C-C-O-H
H
结构式
羧基 -COOH
比例模型
球棍模型
一、乙酸
(二)分子结构
官能团
-COOH
—C—OH
O
‖
结构简式
CH3COOH
O
CH3C-OH
‖
为什么可以用醋除去水垢?
CaCO3 + 2CH3COOH →(CH3COO)2Ca + CO2↑+ H2O
酸性:CH3COOH>H2CO3
如何比较乙酸与碳酸、盐酸的酸性强弱?根据生活经验设计实验方案。
水垢的主要成分为CaCO3
生活常识
H O
H - C-C-O-H
H
乙酸为一元弱酸,其酸性比 H2CO3强,具有酸的通性;其显酸性时断键位置为:
1. 酸性
一、乙酸
(三)化学性质
①使酸碱指示剂变色(如紫色的石蕊试液变红色)
②与活泼金属(如Mg)反应
④与碱(如NaOH)反应
③与碱性氧化物(如CuO)反应
CH3COOH + NaHCO3 === CH3COONa+CO2↑+H2O
CH3COOH CH3COO- +H+
2CH3COOH + Mg === (CH3COO)2Mg+H2↑
CH3COOH + NaOH === CH3COONa+ H2O
2CH3COOH + CuO ===(CH3COO)2Cu + H2O
2CH3COOH + Mg === 2CH3COO-+Mg2++H2↑
2 CH3COOH + CuO === 2CH3COO-+Cu2+ + H2O
CH3COOH + OH- === CH3COO-+ H2O
CH3COOH + === CH3COO-+CO2↑+H2O
⑤与盐(如Na2CO3、NaHCO3)反应
1. 酸性
(三)化学性质
烧鱼时常加醋并加点酒,这样鱼的味道就变得无腥、香醇,特别鲜美。
生活常识
(1) 在试管中加入3 mL乙醇;
(2) 边振荡边加入2 mL浓硫酸和2mL乙酸;
(3) 加入几片碎瓷片;
(4) 用酒精灯小心加热。
2. 酯化反应
(三)化学性质
现象:右侧试管内液体的上层有无色透明的油状液体产生,并有香味。
浓硫酸
CH3COOH + HOC2H5 CH3COOC2H5+H2O
酯化反应:酸与醇反应生成酯和水的反应。
催化剂、吸水剂
①乙醇 ②浓硫酸 ③乙酸
①溶解乙醇;②吸收乙酸;
③降低乙酸乙酯的溶解度,便于分层。
(3)浓硫酸的作用是什么?
(1)装药品的顺序?
(4)饱和碳酸钠溶液的作用是什么?
(2)加热目的是什么?
提高反应速率;
使生成的乙酸乙酯挥发便于收集,提高乙醇乙酸的转化率。
讨论交流
——防止倒吸
(6)导气管不能插入Na2CO3溶液中的原因?
(5)加碎瓷片
——防暴沸
(7)还有其他防倒吸的方法吗?
O O
CH3—C—O—H+HO—C2H5 CH3—C—O—C2H5 + H2O
浓硫酸
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 +H2O
浓硫酸
=
=
O
O
乙酸和乙醇可能是以怎样的方式相互结合形成乙酸乙酯的?
思考探索
浓硫酸
CH3COOH + HOC2H5 CH3COOC2H5+H2O
18O
18O
同位素示踪法
CH3—C—OH + H—18O—C2H5
浓硫酸
=
O
CH3—C—18O—C2H5 + H2O
=
O
CH3COOH + HOCH3
浓硫酸
CH3COOCH3 + H2O
乙酸甲酯
HCOOH + HOCH2CH3
浓硫酸
HCOOCH2CH3 + H2O
甲酸乙酯
酯化反应实质:酸脱羟基,醇脱氢
很多鲜花和水果的香味都来自酯,如草莓中含有乙酸乙酯和乙酸异戊酯,苹果中含有戊酸戊酯等。
这些分子中碳原子数少、相对分子质量较小的低级酯具有一定的挥发性,有芳香气味,难溶于水,可用作饮料、糖果、化妆品中的香料和有机溶剂。
酯类广泛存在于自然界中
陈年老酒格外香
常见的有机化合物的类别、官能团和代表物
烷 烃
官能团
代表物
有机化合物类别
卤代烃
烯 烃
炔 烃
芳香烃
CH4
甲烷
乙烯
苯
乙炔
溴乙烷
-X
碳卤键
CH2
CH2
CH CH
CH3CH2Br
C
C
碳碳双键
C C
碳碳三键
二、官能团与有机化合物的分类
醇
官能团
代表物
有机化合物类别
-OH
羟基
醛
羧酸
酯
醛基
-CHO
O
-C-H
羧基
-COOH
乙醇
乙醛
乙酸乙酯
乙酸
O
-C-
OH
O
-C-
OR
CH3CH2OH
O
-C-
OC2H5
CH3
O
CH3 -C-H
O
CH3 -C-
OH
-COOR
酯基
常见的有机化合物的类别、官能团和代表物
认识有机化合物的一般思路
认识一种有机物,可先从结构入手,分析其碳骨架和官能团,了解它所属的有机物类别;再结合这类有机物的一般性质,推测该有机物可能具有的性质,并通过实验进行验证;在此基础上进一步了解该有机物的用途。
另外,还可以根据有机物发生的化学反应,了解其在有机物转化中的作用。
与认识无机物类似,认识有机物也体现了“结构决定性质”的观念。
各类有机物在结构和性质上具有的明显规律性,有助于我们更好地认识有机物。
方法引导
O
CH3—C—O—H
①
②
①弱酸性,具有酸的通性;酸性比碳酸强。
②酯化反应
浓硫酸
结构
性质
决定
课堂总结
1. 实验室制取少量乙酸乙酯的装置如图,下列关于该实验的叙述中不正确的是 ( )
先向 a 试管中加入乙醇,然后边摇动试管边慢慢加入浓硫酸和冰醋酸
B. 试管b中导气管下端管口不能浸入液面的原因是防止 实验过程中发生倒吸现象
C. 实验时加热试管 a 的目的是及时将乙酸乙酯蒸出并加快反应速率
D. 可将饱和碳酸钠溶液换成氢氧化钠溶液
D
知识巩固
2. 某有机物的结构简式如图,下列关于该有机物的说法正确的是( )
B
A.分子式为C7H6O5
B.1 mol该物质能与4 mol Na发生反应
C.分子中含有两种官能团
D.在水溶液中羧基和羟基均能电离出H+
3. 1 mol 分别与Na、NaOH、NaHCO3、Na2CO3完全反应时,
消耗的Na、NaOH、NaHCO3、Na2CO3的物质的量之比为多少
4∶2∶2∶1
4. 某有机物m g,跟足量金属钠反应生成V L H2;另取m g该有机物与足量碳酸氢钠作用生成V L CO2(同一状况),该有机物分子中含有的官能团可能为 ( )
A
A.一个羧基和一个羟基 B.两个羟基
C.一个羧基 D.两个羧基
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
