人教版九下第十一单元课题1 生活中常见的盐课件(共16张PPT)
文档属性
| 名称 | 人教版九下第十一单元课题1 生活中常见的盐课件(共16张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 976.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
第十一单元 盐 化肥
课题1 生活中常见的盐
1.了解NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.了解碳酸(氢)根离子的检验方法。
3.认识盐的化学性质。
教学目标
1.碳酸(氢)根离子的检验方法。
2.盐的化学性质。
1.NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.碳酸(氢)根离子的检验方法。
3.盐的化学性质。
教学重点
教学难点
一、几种常见的盐
1.NaCl
物性:
白色固体,易溶于水
用途:
调味品、防腐剂、融雪剂、生理盐水、工业原料
制取:
海水
盐湖
盐井
粗盐
精盐
蒸发
提纯
电解食盐水:2NaCl+2H2O === 2NaOH+H2 +Cl2
通电
2.Na2CO3
俗名:纯碱(溶液呈碱性)、苏打
物性:
白色固体,易溶于水
Na2CO3 + 2HCl=
2NaCl + H2O + CO2↑
制泡沫灭火器:
用途:
工业原料(玻璃、造纸、纺织)
Na2CO3 + Ca(OH)2=
CaCO3 + 2NaOH
制烧碱(NaOH):
制面点
清洗油污
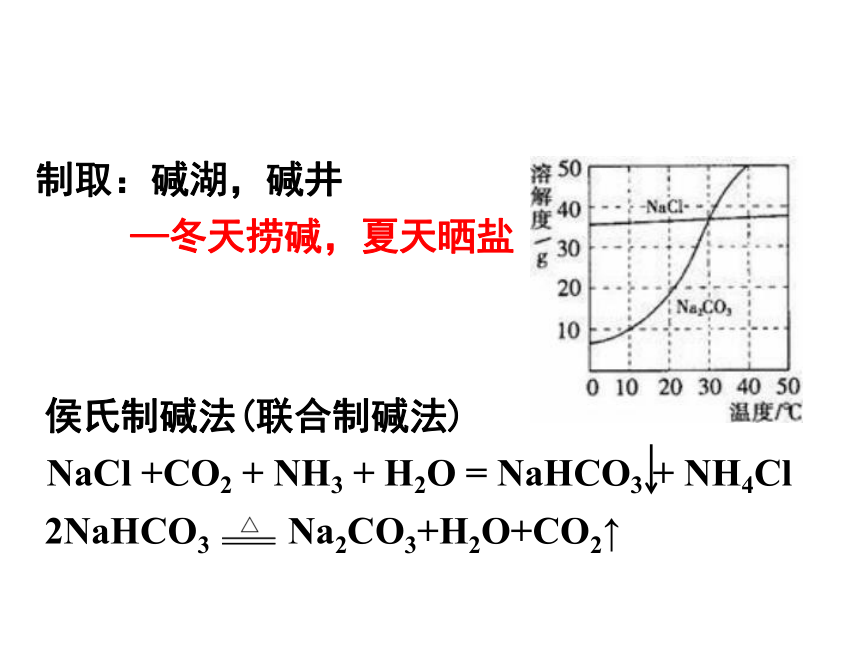
侯氏制碱法(联合制碱法)
—冬天捞碱,夏天晒盐
制取:碱湖,碱井
NaCl +CO2 + NH3 + H2O = NaHCO3 + NH4Cl
2NaHCO3
Na2CO3+H2O+CO2↑
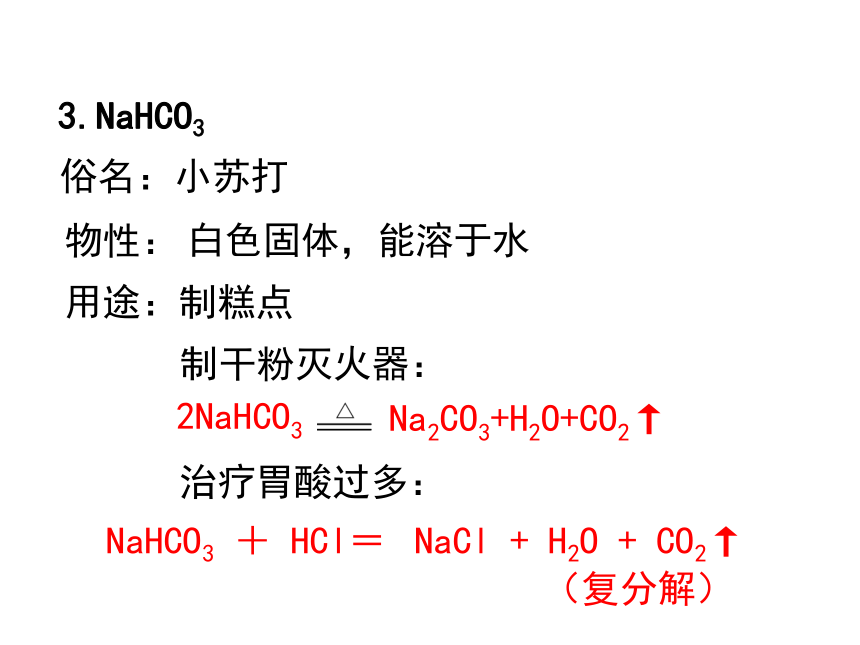
3.NaHCO3
俗名:小苏打
物性:
白色固体,能溶于水
制糕点
治疗胃酸过多:
NaHCO3 + HCl=
NaCl + H2O + CO2↑
2NaHCO3
Na2CO3+H2O+CO2↑
用途:
制干粉灭火器:
(复分解)
4.CaCO3
石灰石、大理石的主要成分
物性:
白色固体,难溶于水
用途:
建材,补钙剂
CaCO3+CO2+H2O==Ca(HCO3)2
溶洞的形成:
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
CaCO3 + 2HCl=
CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl=
2NaCl + H2O + CO2↑
NaHCO3 + HCl=
NaCl + H2O + CO2↑
取样,加入稀盐酸,将生成的气体通入澄清石灰水中,石灰水变浑浊,则该物质中含有CO32- (HCO3- )。
碳酸(氢)根离子的检验:
二、盐的化学性质
1.与指示剂作用
盐溶液不一定呈中性
例:(NH4)2SO4溶液呈酸性
Na2CO3,K2CO3溶液呈碱性
酸性溶液=酸的溶液
碱性溶液=碱的溶液
2.与金属反应
通式:
金属+盐 新金属+新盐(置换)
要求:
金盐前置后(K、Ca、Na除外)
练习:Al+CuCl2 Fe+ZnSO4
Cu+AgCl Mg+FeSO4
盐可溶
3.与酸反应
酸 + 盐 新酸 + 新盐(复分解)
生成气体、沉淀或水
4.与碱反应
生成气体、沉淀或水
可溶
通式:
要求:
通式:
要求:
碱 + 盐 新碱 + 新盐(复分解)
写一写:
AgNO3 + NaCl
= AgCl + NaNO3
这是盐与哪一类物质的反应?属于什么基本反应类型?
5.与盐反应
盐1 + 盐2 盐3 + 盐4(复分解)
生成气体、沉淀或水
可溶
通式:
要求:
练习:BaCl2+Na2SO4
KNO3+NaCl
CaCO3+BaCl2
AgNO3+KCl
小结:酸碱盐的化学性质
酸 碱
盐 盐
金属
金氧
非金氧
要求:
有酸可不溶
无酸盐碱溶
金酸H之前
金盐前置后
生成气沉水
反应物
生成物
1.NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.碳酸(氢)根离子的检验方法。
3.盐的化学性质。
课堂小结
第十一单元 盐 化肥
课题1 生活中常见的盐
1.了解NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.了解碳酸(氢)根离子的检验方法。
3.认识盐的化学性质。
教学目标
1.碳酸(氢)根离子的检验方法。
2.盐的化学性质。
1.NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.碳酸(氢)根离子的检验方法。
3.盐的化学性质。
教学重点
教学难点
一、几种常见的盐
1.NaCl
物性:
白色固体,易溶于水
用途:
调味品、防腐剂、融雪剂、生理盐水、工业原料
制取:
海水
盐湖
盐井
粗盐
精盐
蒸发
提纯
电解食盐水:2NaCl+2H2O === 2NaOH+H2 +Cl2
通电
2.Na2CO3
俗名:纯碱(溶液呈碱性)、苏打
物性:
白色固体,易溶于水
Na2CO3 + 2HCl=
2NaCl + H2O + CO2↑
制泡沫灭火器:
用途:
工业原料(玻璃、造纸、纺织)
Na2CO3 + Ca(OH)2=
CaCO3 + 2NaOH
制烧碱(NaOH):
制面点
清洗油污
侯氏制碱法(联合制碱法)
—冬天捞碱,夏天晒盐
制取:碱湖,碱井
NaCl +CO2 + NH3 + H2O = NaHCO3 + NH4Cl
2NaHCO3
Na2CO3+H2O+CO2↑
3.NaHCO3
俗名:小苏打
物性:
白色固体,能溶于水
制糕点
治疗胃酸过多:
NaHCO3 + HCl=
NaCl + H2O + CO2↑
2NaHCO3
Na2CO3+H2O+CO2↑
用途:
制干粉灭火器:
(复分解)
4.CaCO3
石灰石、大理石的主要成分
物性:
白色固体,难溶于水
用途:
建材,补钙剂
CaCO3+CO2+H2O==Ca(HCO3)2
溶洞的形成:
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
CaCO3 + 2HCl=
CaCl2 + H2O + CO2↑
Na2CO3 + 2HCl=
2NaCl + H2O + CO2↑
NaHCO3 + HCl=
NaCl + H2O + CO2↑
取样,加入稀盐酸,将生成的气体通入澄清石灰水中,石灰水变浑浊,则该物质中含有CO32- (HCO3- )。
碳酸(氢)根离子的检验:
二、盐的化学性质
1.与指示剂作用
盐溶液不一定呈中性
例:(NH4)2SO4溶液呈酸性
Na2CO3,K2CO3溶液呈碱性
酸性溶液=酸的溶液
碱性溶液=碱的溶液
2.与金属反应
通式:
金属+盐 新金属+新盐(置换)
要求:
金盐前置后(K、Ca、Na除外)
练习:Al+CuCl2 Fe+ZnSO4
Cu+AgCl Mg+FeSO4
盐可溶
3.与酸反应
酸 + 盐 新酸 + 新盐(复分解)
生成气体、沉淀或水
4.与碱反应
生成气体、沉淀或水
可溶
通式:
要求:
通式:
要求:
碱 + 盐 新碱 + 新盐(复分解)
写一写:
AgNO3 + NaCl
= AgCl + NaNO3
这是盐与哪一类物质的反应?属于什么基本反应类型?
5.与盐反应
盐1 + 盐2 盐3 + 盐4(复分解)
生成气体、沉淀或水
可溶
通式:
要求:
练习:BaCl2+Na2SO4
KNO3+NaCl
CaCO3+BaCl2
AgNO3+KCl
小结:酸碱盐的化学性质
酸 碱
盐 盐
金属
金氧
非金氧
要求:
有酸可不溶
无酸盐碱溶
金酸H之前
金盐前置后
生成气沉水
反应物
生成物
1.NaCl、Na2CO3、NaHCO3、CaCO3的性质和用途。
2.碳酸(氢)根离子的检验方法。
3.盐的化学性质。
课堂小结
同课章节目录
