人教版九下第九单元课题1 溶液的形成 课件(共20张PPT)
文档属性
| 名称 | 人教版九下第九单元课题1 溶液的形成 课件(共20张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 602.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 00:00:00 | ||
图片预览





文档简介
(共20张PPT)
第九单元 溶液
课题1 溶液的形成
1.了解溶液的定义和组成。
2.会判断溶液中的溶质和溶剂。
3.了解不同物质溶于水时的吸放热现象。
4.了解浊液和乳化作用。
教学目标
1.溶液的定义和组成。
2.判断溶液中的溶质和溶剂。
3.不同物质溶于水时的吸放热现象。
判断溶液中的溶质和溶剂。
教学重点
教学难点
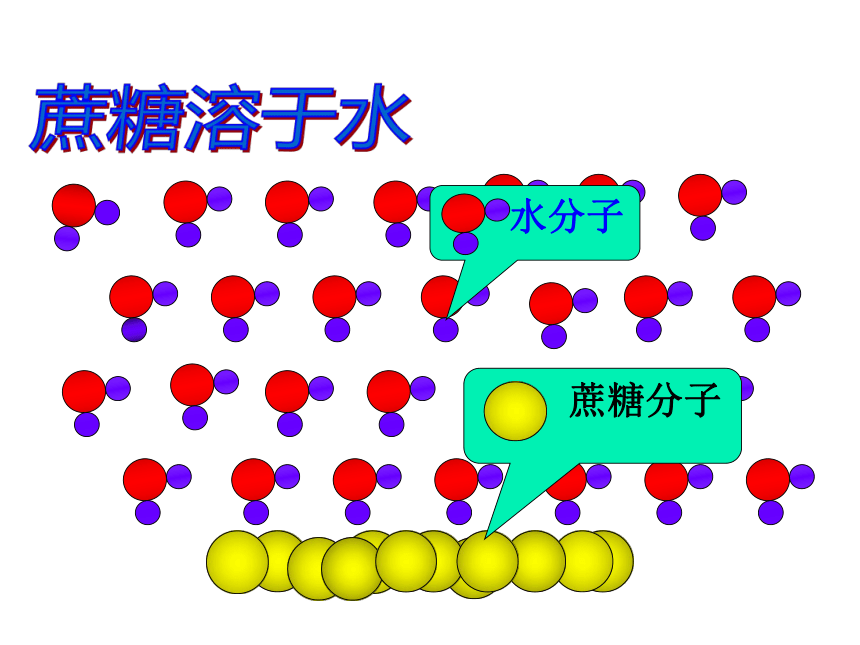
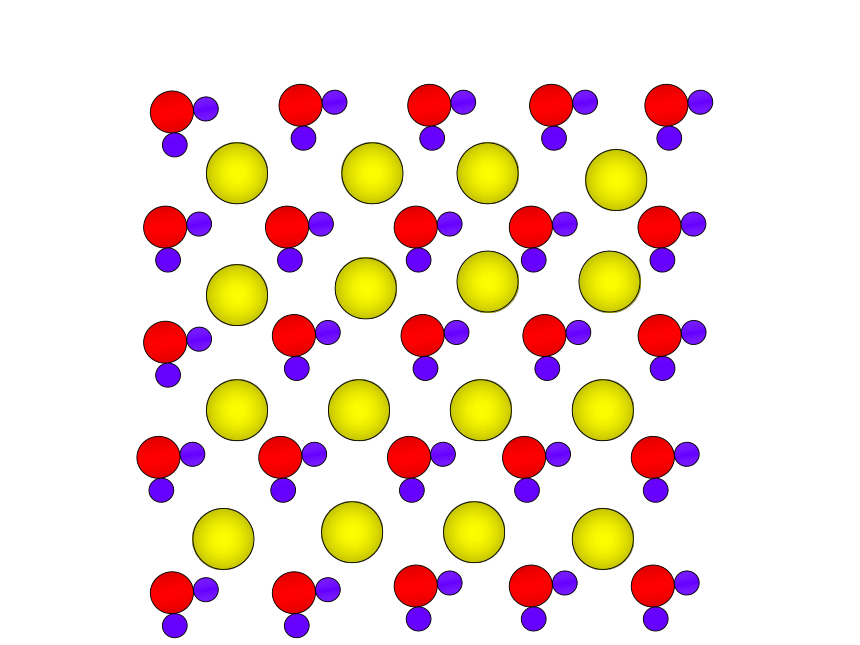
蔗糖溶于水
水分子
蔗糖分子
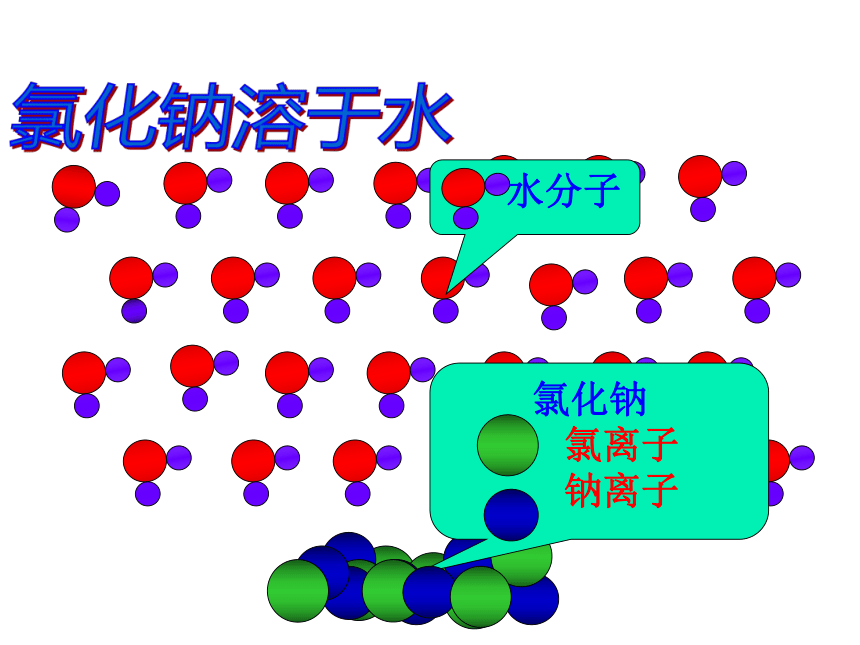
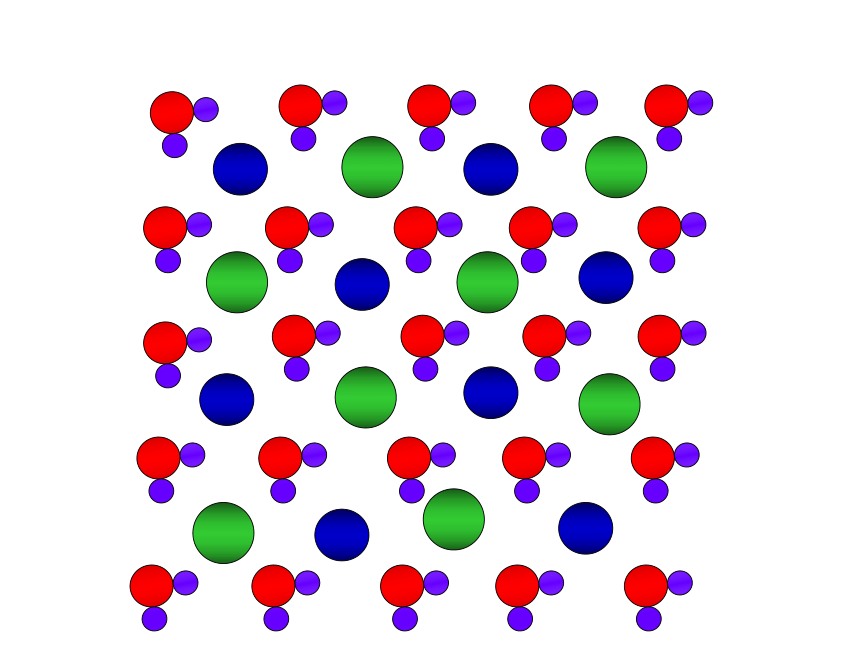
氯化钠溶于水
水分子
氯化钠
氯离子
钠离子
一、溶液
1.定义:
一种或几种物质分散到另一种物质中,形成
均一稳定的混合物。
(溶 质)
(溶 剂)
判断:下列各种物质充分混合后,能得到溶液的是( )
A.碳酸钙加入水中 B.二氧化锰加入水中
C.硫酸铜加入水中 D.植物油加入水中
下列说法是否正确?
1.溶液一定是混合物
2.混合物一定是溶液
3.溶液一定是无色的
4.溶液一定是透明的
5.均一、稳定的液体都是溶液
6.溶液一定是液态的
溶液不一定是液体,包括空气、合金等
C
2.溶液的组成
溶质:被溶解的物质(可以是气、液、固)
溶剂:能溶解其他物质的物质(常见的有水、
酒精、汽油)
溶液叫“溶质”的“溶剂”溶液(溶剂为水,则省去)
练习
20g氯化钠加入45g水中,充分溶解后剩余5g,得到溶液叫 溶液,其中溶质的质量为 ,溶液的质量为 。
m溶液=m溶质+m溶剂(未溶解的部分不得算入)
氯化钠
15g
60g
3.判断溶质、溶剂
根据名称
例:氢氧化钠溶液;白磷的二硫化碳溶液
溶质 溶剂 举例
气 液
固 液
液 液
溶液为液体时
气
液
液
固
少
多
(若有水,水是溶剂)
盐酸
蔗糖溶液
植物油的汽油溶液
溶液为固体或气体时,少的为溶质,多的为溶剂
练习:判断溶质、溶剂
1.30g汽油+20g植物油
2.30g水+70g酒精
3.30g食盐水+50g蔗糖水
4.空气中溶剂?溶质?
5.石灰水
6.锌溶于适量稀硫酸
7.锌溶于过量稀硫酸
4.溶液用途
物质呈高分散的状态(分子或离子),
接触更充分,有利于反应进行。
二、溶解时吸热、放热现象
NaCl等大多数物质
NH4Cl、NH4NO3溶于水
NaOH、浓硫酸
T无变化
降温
升温
原因:
扩散过程=水合过程:T无变化 吸热=放热
扩散过程>水合过程:降温 吸热>放热
扩散过程<水合过程:升温 吸热<放热
扩散过程: 吸热
水合过程: 放热
溶解
练习:如图所示,在试管中加入某种固体,U型管中右侧的液面上升,则加入的固体可能是 。
氢氧化钠、 生石灰
三、浊液
1.悬浊液:不溶的固体小颗粒,分散在液体中
形成的混合物。
如:泥水
2.乳浊液:不溶的小液滴,分散在液体中形成的混合物。
如:油水混合物
3.乳化作用:
使不溶的液滴分散得更细小,形成相对稳定的乳浊液(洗涤剂洗涤原理)。
比一比
汽油去污——溶解
洗涤剂去污——乳化
1.溶液的定义和组成。
2.判断溶液中的溶质和溶剂。
3.不同物质溶于水时的吸放热现象。
4.浊液和乳化作用。
课堂小结
第九单元 溶液
课题1 溶液的形成
1.了解溶液的定义和组成。
2.会判断溶液中的溶质和溶剂。
3.了解不同物质溶于水时的吸放热现象。
4.了解浊液和乳化作用。
教学目标
1.溶液的定义和组成。
2.判断溶液中的溶质和溶剂。
3.不同物质溶于水时的吸放热现象。
判断溶液中的溶质和溶剂。
教学重点
教学难点
蔗糖溶于水
水分子
蔗糖分子
氯化钠溶于水
水分子
氯化钠
氯离子
钠离子
一、溶液
1.定义:
一种或几种物质分散到另一种物质中,形成
均一稳定的混合物。
(溶 质)
(溶 剂)
判断:下列各种物质充分混合后,能得到溶液的是( )
A.碳酸钙加入水中 B.二氧化锰加入水中
C.硫酸铜加入水中 D.植物油加入水中
下列说法是否正确?
1.溶液一定是混合物
2.混合物一定是溶液
3.溶液一定是无色的
4.溶液一定是透明的
5.均一、稳定的液体都是溶液
6.溶液一定是液态的
溶液不一定是液体,包括空气、合金等
C
2.溶液的组成
溶质:被溶解的物质(可以是气、液、固)
溶剂:能溶解其他物质的物质(常见的有水、
酒精、汽油)
溶液叫“溶质”的“溶剂”溶液(溶剂为水,则省去)
练习
20g氯化钠加入45g水中,充分溶解后剩余5g,得到溶液叫 溶液,其中溶质的质量为 ,溶液的质量为 。
m溶液=m溶质+m溶剂(未溶解的部分不得算入)
氯化钠
15g
60g
3.判断溶质、溶剂
根据名称
例:氢氧化钠溶液;白磷的二硫化碳溶液
溶质 溶剂 举例
气 液
固 液
液 液
溶液为液体时
气
液
液
固
少
多
(若有水,水是溶剂)
盐酸
蔗糖溶液
植物油的汽油溶液
溶液为固体或气体时,少的为溶质,多的为溶剂
练习:判断溶质、溶剂
1.30g汽油+20g植物油
2.30g水+70g酒精
3.30g食盐水+50g蔗糖水
4.空气中溶剂?溶质?
5.石灰水
6.锌溶于适量稀硫酸
7.锌溶于过量稀硫酸
4.溶液用途
物质呈高分散的状态(分子或离子),
接触更充分,有利于反应进行。
二、溶解时吸热、放热现象
NaCl等大多数物质
NH4Cl、NH4NO3溶于水
NaOH、浓硫酸
T无变化
降温
升温
原因:
扩散过程=水合过程:T无变化 吸热=放热
扩散过程>水合过程:降温 吸热>放热
扩散过程<水合过程:升温 吸热<放热
扩散过程: 吸热
水合过程: 放热
溶解
练习:如图所示,在试管中加入某种固体,U型管中右侧的液面上升,则加入的固体可能是 。
氢氧化钠、 生石灰
三、浊液
1.悬浊液:不溶的固体小颗粒,分散在液体中
形成的混合物。
如:泥水
2.乳浊液:不溶的小液滴,分散在液体中形成的混合物。
如:油水混合物
3.乳化作用:
使不溶的液滴分散得更细小,形成相对稳定的乳浊液(洗涤剂洗涤原理)。
比一比
汽油去污——溶解
洗涤剂去污——乳化
1.溶液的定义和组成。
2.判断溶液中的溶质和溶剂。
3.不同物质溶于水时的吸放热现象。
4.浊液和乳化作用。
课堂小结
同课章节目录
