人教版九下第九单元课题2 溶解度 第二课时 课件(共19张PPT)
文档属性
| 名称 | 人教版九下第九单元课题2 溶解度 第二课时 课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 485.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 13:31:36 | ||
图片预览




文档简介
(共19张PPT)
第九单元 溶液
课题2 溶解度(第二课时)
1.了解固体溶解度的定义和影响因素。
2.认识溶解度曲线。
3.了解溶解性和溶解度之间的联系。
教学目标
1.固体溶解度的定义和影响因素。
2.溶解度曲线。
3.溶解性和溶解度之间的联系。
溶解度曲线的意义和提供的信息。
教学重点
教学难点
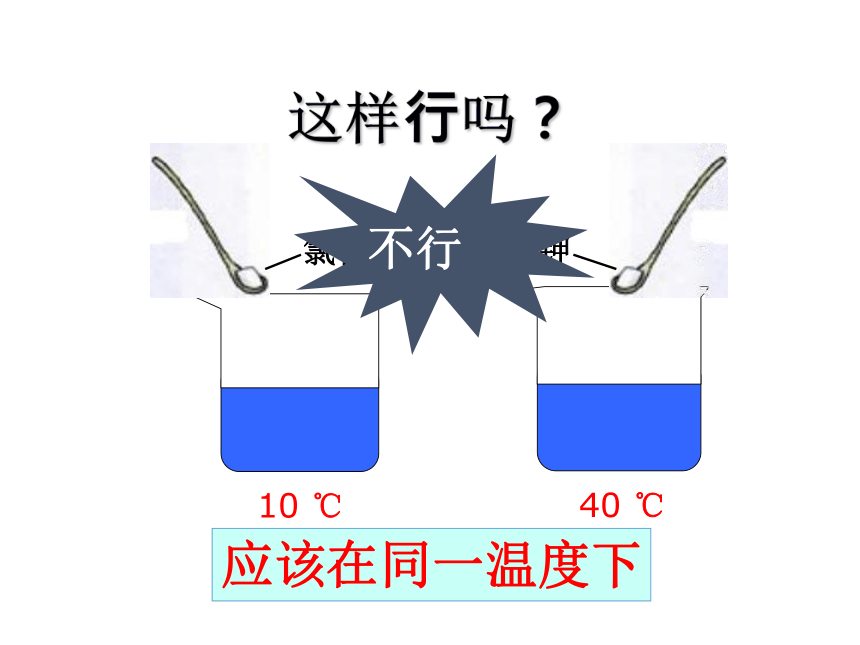
现有氯化钠、硝酸钾两种物质,如何比较两种物质的溶解能力大小
二、溶解度
10 ℃
40 ℃
氯化钠
硝酸钾
不行
应该在同一温度下
这样行吗?
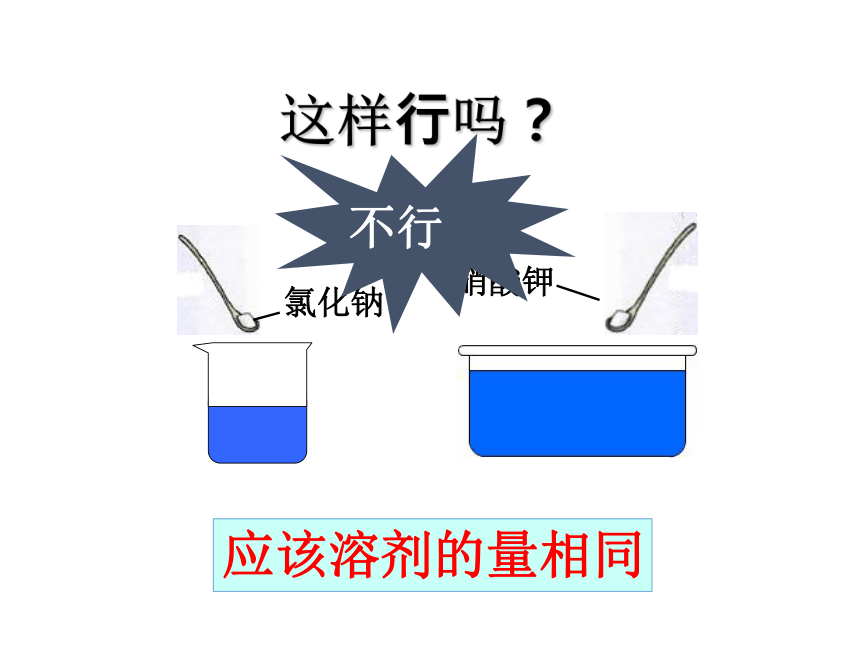
氯化钠
硝酸钾
不行
应该溶剂的量相同
这样行吗?
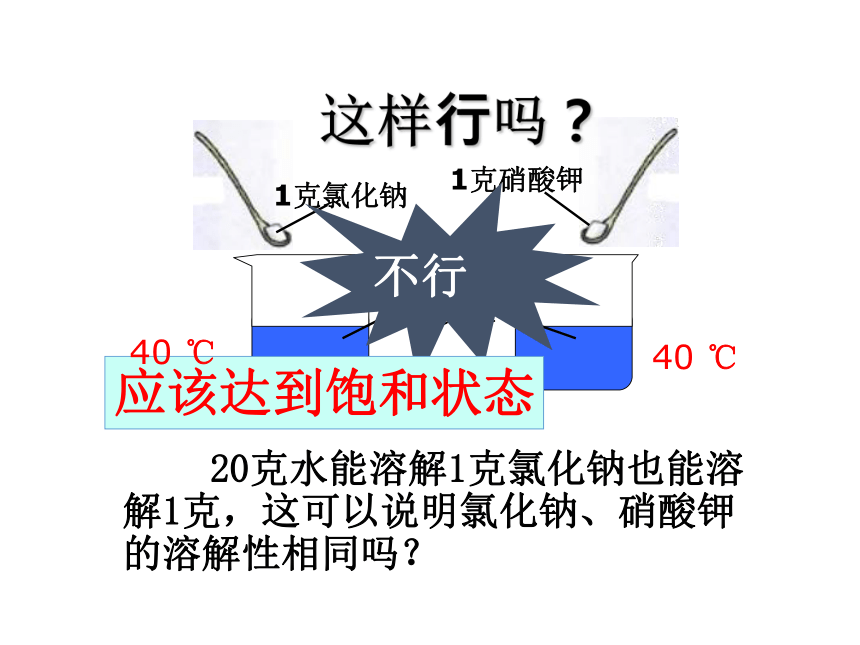
1克氯化钠
1克硝酸钾
20克水能溶解1克氯化钠也能溶解1克,这可以说明氯化钠、硝酸钾的溶解性相同吗?
20克水
不行
应该达到饱和状态
这样行吗?
40 ℃
40 ℃
定温度
定溶剂的量
定状态(达到饱和)
比较不同物质的溶解能力,应该控制的条件有:
1.固体的溶解度
一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的溶质质量。
g
单位:
符号:s
例:20 ℃时,KNO3的溶解度为31.6g
a.20℃时,在100g水中达到饱和状态所溶解的KNO3质量为31.6g。
意义:
b.20℃时,100g水中最多能溶解31.6gKNO3。
信息:
温度:20℃ 状态:饱和
溶剂:100g 溶质:31.6g 溶液:131.6g
溶液的浓度=31.6g/131.6g×100%
2.影响因素:
内因:溶质、溶剂本身的性质
外因:温度
大多数固体:温度升高,s增大,如KNO3
少数固体:温度升高,s变化不大,如NaCl
极少数固体:温度升高,s减小,如Ca(OH)2
判断:
1. NaCl的溶解度是36g
2. 20℃时,100g水中溶解了23gNaCl,
则20℃时NaCl的溶解度是23g
3. 20℃时,100g水中最多溶解了36gNaCl,
则20℃时NaCl的溶解度是36
4.20 ℃时,100gNaCl饱和溶液中含有23gNaCl,
则20℃时NaCl的溶解度是23g
5.20 ℃时,200g水中最多溶解了66gA物质,
20 ℃时,SA= 。
6.20 ℃时,100g水中,SA=36g,
那么20℃时,50g水中,SA= 。
×
36g
33g
×
×
×
3.固体的溶解性
s:~ 10g ~ 1g ~ 0.01g ~
易溶 可/能溶 微溶 不/难溶
—根据20℃的溶解度划分
根据P36表,判断KNO3,NaCl的溶解性
易溶
易溶
4. 溶解度曲线
常见物质的溶解度曲线见P37
判断硼酸,熟石灰的溶解性
硼酸:可溶
熟石灰:微溶
图像中点的意义:
曲线上的点
曲线下方的点
曲线上方的点
—图中点表示一份溶液,m溶剂=100g,m溶质=纵坐标
溶液恰好饱和
溶液不饱和
溶液饱和且有固体剩余
图像中点的移动
升温
降温
加入溶质或蒸发溶剂
析出晶体或加入溶剂
向右平移
向左平移
竖直上移
竖直下移
(1)t3℃时,甲、乙、丙三种物质
的溶解度由小到大的顺序
是 ;
(2)甲乙丙三种物质的溶液接近饱
和, 可通过加溶质,蒸发溶剂,
升温达到饱和
(3)t1℃时,20g甲加入到50g水中,
充分溶解后得到的溶液状态?
温度由t1℃升到t2℃,溶液的状态?浓度的变化情况?
(4)M点的含义?
丙,乙,甲
丙
溶液饱和且有固体剩余
溶液不饱和,浓度变大
t2℃时,甲、乙的溶解度相等
M
(5)t3℃时,将等质量的三种物质的饱和溶液降温至t1℃,析出固体最多的是哪种物质?
没有固体析出的是哪种物质?
此时三种溶液的浓度大小顺序?
(6) t2℃时三种物质的饱和溶液,恒温蒸发等质量的水,析出固体由少到多排序是 。
甲
丙
乙>甲>丙
丙<乙=甲
1.固体溶解度的定义和影响因素。
2.溶解度曲线。
3.溶解性和溶解度之间的联系。
课堂小结
第九单元 溶液
课题2 溶解度(第二课时)
1.了解固体溶解度的定义和影响因素。
2.认识溶解度曲线。
3.了解溶解性和溶解度之间的联系。
教学目标
1.固体溶解度的定义和影响因素。
2.溶解度曲线。
3.溶解性和溶解度之间的联系。
溶解度曲线的意义和提供的信息。
教学重点
教学难点
现有氯化钠、硝酸钾两种物质,如何比较两种物质的溶解能力大小
二、溶解度
10 ℃
40 ℃
氯化钠
硝酸钾
不行
应该在同一温度下
这样行吗?
氯化钠
硝酸钾
不行
应该溶剂的量相同
这样行吗?
1克氯化钠
1克硝酸钾
20克水能溶解1克氯化钠也能溶解1克,这可以说明氯化钠、硝酸钾的溶解性相同吗?
20克水
不行
应该达到饱和状态
这样行吗?
40 ℃
40 ℃
定温度
定溶剂的量
定状态(达到饱和)
比较不同物质的溶解能力,应该控制的条件有:
1.固体的溶解度
一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的溶质质量。
g
单位:
符号:s
例:20 ℃时,KNO3的溶解度为31.6g
a.20℃时,在100g水中达到饱和状态所溶解的KNO3质量为31.6g。
意义:
b.20℃时,100g水中最多能溶解31.6gKNO3。
信息:
温度:20℃ 状态:饱和
溶剂:100g 溶质:31.6g 溶液:131.6g
溶液的浓度=31.6g/131.6g×100%
2.影响因素:
内因:溶质、溶剂本身的性质
外因:温度
大多数固体:温度升高,s增大,如KNO3
少数固体:温度升高,s变化不大,如NaCl
极少数固体:温度升高,s减小,如Ca(OH)2
判断:
1. NaCl的溶解度是36g
2. 20℃时,100g水中溶解了23gNaCl,
则20℃时NaCl的溶解度是23g
3. 20℃时,100g水中最多溶解了36gNaCl,
则20℃时NaCl的溶解度是36
4.20 ℃时,100gNaCl饱和溶液中含有23gNaCl,
则20℃时NaCl的溶解度是23g
5.20 ℃时,200g水中最多溶解了66gA物质,
20 ℃时,SA= 。
6.20 ℃时,100g水中,SA=36g,
那么20℃时,50g水中,SA= 。
×
36g
33g
×
×
×
3.固体的溶解性
s:~ 10g ~ 1g ~ 0.01g ~
易溶 可/能溶 微溶 不/难溶
—根据20℃的溶解度划分
根据P36表,判断KNO3,NaCl的溶解性
易溶
易溶
4. 溶解度曲线
常见物质的溶解度曲线见P37
判断硼酸,熟石灰的溶解性
硼酸:可溶
熟石灰:微溶
图像中点的意义:
曲线上的点
曲线下方的点
曲线上方的点
—图中点表示一份溶液,m溶剂=100g,m溶质=纵坐标
溶液恰好饱和
溶液不饱和
溶液饱和且有固体剩余
图像中点的移动
升温
降温
加入溶质或蒸发溶剂
析出晶体或加入溶剂
向右平移
向左平移
竖直上移
竖直下移
(1)t3℃时,甲、乙、丙三种物质
的溶解度由小到大的顺序
是 ;
(2)甲乙丙三种物质的溶液接近饱
和, 可通过加溶质,蒸发溶剂,
升温达到饱和
(3)t1℃时,20g甲加入到50g水中,
充分溶解后得到的溶液状态?
温度由t1℃升到t2℃,溶液的状态?浓度的变化情况?
(4)M点的含义?
丙,乙,甲
丙
溶液饱和且有固体剩余
溶液不饱和,浓度变大
t2℃时,甲、乙的溶解度相等
M
(5)t3℃时,将等质量的三种物质的饱和溶液降温至t1℃,析出固体最多的是哪种物质?
没有固体析出的是哪种物质?
此时三种溶液的浓度大小顺序?
(6) t2℃时三种物质的饱和溶液,恒温蒸发等质量的水,析出固体由少到多排序是 。
甲
丙
乙>甲>丙
丙<乙=甲
1.固体溶解度的定义和影响因素。
2.溶解度曲线。
3.溶解性和溶解度之间的联系。
课堂小结
同课章节目录
