人教版九下第八单元课题3 金属资源的利用和保护 课件(共18张PPT)
文档属性
| 名称 | 人教版九下第八单元课题3 金属资源的利用和保护 课件(共18张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 14:04:18 | ||
图片预览






文档简介
(共18张PPT)
第八单元 金属和金属材料
课题3 金属资源的利用和保护
1.了解金属冶炼的方法。
2.了解实验室模拟炼铁的实验现象和步骤。
3.了解金属的锈蚀条件和防锈措施。
4.能用化学方程式进行杂质的计算。
教学目标
1.工业炼铁和实验室模拟炼铁。
2.金属锈蚀的条件和防锈措施。
3.利用化学方程式进行杂质的计算。
1.实验室模拟炼铁的实验步骤。
2.利用实验探究铁生锈的条件。
教学重点
教学难点
1.金属元素的存在形式
一、金属在自然界的存在方式
单质:金、铂、银等少数
化合物:其余大多数
主要成分:
2.常见的矿石:
赤铁矿、磁铁矿、铝土矿
Fe2O3
Fe3O4
Al2O3
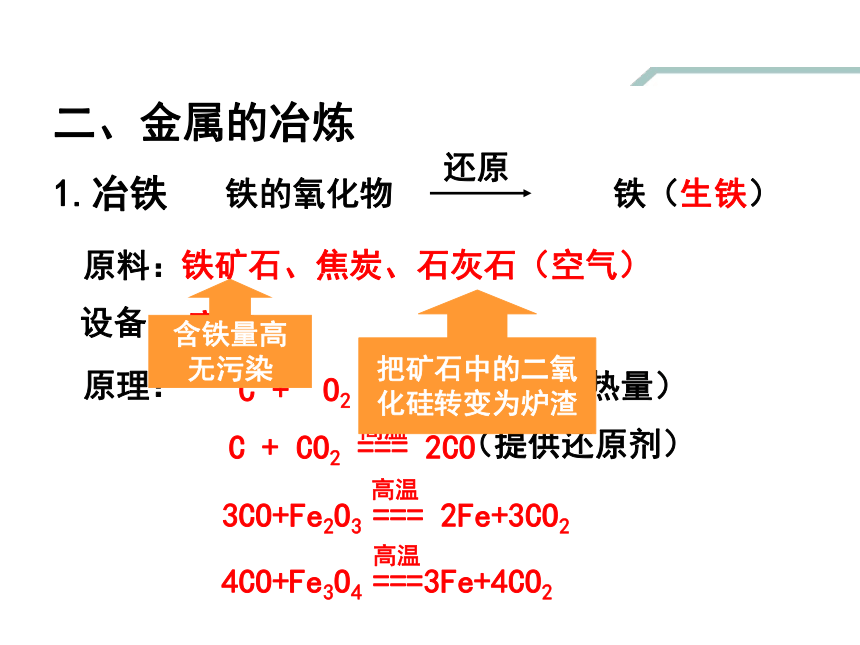
原料:
铁矿石、焦炭、石灰石(空气)
原理:
3CO+Fe2O3 === 2Fe+3CO2
高温
点燃
C + O2 === CO2
高温
C + CO2 === 2CO
(提供热量)
(提供还原剂)
二、金属的冶炼
1.冶铁
铁的氧化物 铁(生铁)
还原
设备:
高炉
4CO+Fe3O4 ===3Fe+4CO2
高温
含铁量高
无污染
把矿石中的二氧
化硅转变为炉渣
现象:红色粉末变黑,生成使石灰水变浑浊的气体
模拟实验:P16
步骤:
与CO还原CuO相似
CO早出晚归,喷灯迟到早退
2.炼钢
生铁 钢
降低含碳量
原料:生铁、富氧空气
原理:
高温
C + O2 === CO2
3.冶铜
用还原剂(C、CO、H2)还原CuO
湿法冶铜:Fe+CuSO4 = FeSO4+Cu
现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙。试设计实验以证明铁制品锈蚀的条件。
Ⅰ
Ⅱ
Ⅲ
(氧气和水)
( 有水,无氧气 )
( 有氧气,无水 )
生锈 不生锈 不生锈
( 控制变量 )
三、铁制品的锈蚀
1.铁生锈的条件
1.铁生锈的条件
Fe与O2、H2O同时作用,生成铁锈
(主要成分:Fe2O3 · xH2O)
混合物,红褐色,疏松
注意:
酸、盐能加快铁的锈蚀
铁锈疏松且有吸水性,会加快锈蚀
三、铁制品的锈蚀
小结:铁参加的反应和产物
铁在潮湿空气中缓慢氧化主要生成Fe2O3 ;
铁在纯O2中点燃生成Fe3O4 ;
铁在溶液中发生置换反应,生成亚铁化合物。
2.防锈的措施
原理
①隔绝水
②隔绝氧气
保持表面干燥
刷漆、涂油
镀一层其他金属(如铬)
烤蓝、镀“搪瓷”
制成不锈钢(加入Cr、Ni)
方法
(1)防止金属锈蚀
(2)回收利用废旧金属
(3)合理开采矿物
(4)寻找金属的代用品
防止污染环境
节约金属资源
四、金属资源的保护
Fe
Fe3O4
点燃 O2+
铁锈Fe2O3
H2O +O2+
FeCl2
+HCl
FeSO4
+稀H2SO4
Cu+FeSO4
CuSO4
+CO高温
+CO高温
请写以上6个化学反应方程式(3min)
例题:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少 t
解:设可以炼出生铁的质量为x。
160 2×56
1000t×80% x·96%
160 2×56
1000t×80% x·96%
x= 583 t
答:略。
有关杂质问题的计算
在实验生产中,所用的原料或产物一般含有杂质,在计算用料和产量时,应考虑到杂质问题。
Fe2O3+3CO == 2Fe+3CO2
高温
解法2:利用铁元素质量守恒
Fe2O3
2Fe
M( Fe2O3)= 1000t×80%=800t
M(Fe)=800t×112/160×100%=560t
M(生铁)=560t÷96%=583t
m纯铁 = m生铁 × Fe%
m生铁 = m纯铁÷ Fe%
1.金属冶炼的方法。
2.实验室模拟炼铁的实验现象和步骤。
3.金属的锈蚀条件和防锈措施。
4.利用化学方程式进行杂质的计算。
课堂小结
第八单元 金属和金属材料
课题3 金属资源的利用和保护
1.了解金属冶炼的方法。
2.了解实验室模拟炼铁的实验现象和步骤。
3.了解金属的锈蚀条件和防锈措施。
4.能用化学方程式进行杂质的计算。
教学目标
1.工业炼铁和实验室模拟炼铁。
2.金属锈蚀的条件和防锈措施。
3.利用化学方程式进行杂质的计算。
1.实验室模拟炼铁的实验步骤。
2.利用实验探究铁生锈的条件。
教学重点
教学难点
1.金属元素的存在形式
一、金属在自然界的存在方式
单质:金、铂、银等少数
化合物:其余大多数
主要成分:
2.常见的矿石:
赤铁矿、磁铁矿、铝土矿
Fe2O3
Fe3O4
Al2O3
原料:
铁矿石、焦炭、石灰石(空气)
原理:
3CO+Fe2O3 === 2Fe+3CO2
高温
点燃
C + O2 === CO2
高温
C + CO2 === 2CO
(提供热量)
(提供还原剂)
二、金属的冶炼
1.冶铁
铁的氧化物 铁(生铁)
还原
设备:
高炉
4CO+Fe3O4 ===3Fe+4CO2
高温
含铁量高
无污染
把矿石中的二氧
化硅转变为炉渣
现象:红色粉末变黑,生成使石灰水变浑浊的气体
模拟实验:P16
步骤:
与CO还原CuO相似
CO早出晚归,喷灯迟到早退
2.炼钢
生铁 钢
降低含碳量
原料:生铁、富氧空气
原理:
高温
C + O2 === CO2
3.冶铜
用还原剂(C、CO、H2)还原CuO
湿法冶铜:Fe+CuSO4 = FeSO4+Cu
现有洁净无锈的铁钉、试管、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙。试设计实验以证明铁制品锈蚀的条件。
Ⅰ
Ⅱ
Ⅲ
(氧气和水)
( 有水,无氧气 )
( 有氧气,无水 )
生锈 不生锈 不生锈
( 控制变量 )
三、铁制品的锈蚀
1.铁生锈的条件
1.铁生锈的条件
Fe与O2、H2O同时作用,生成铁锈
(主要成分:Fe2O3 · xH2O)
混合物,红褐色,疏松
注意:
酸、盐能加快铁的锈蚀
铁锈疏松且有吸水性,会加快锈蚀
三、铁制品的锈蚀
小结:铁参加的反应和产物
铁在潮湿空气中缓慢氧化主要生成Fe2O3 ;
铁在纯O2中点燃生成Fe3O4 ;
铁在溶液中发生置换反应,生成亚铁化合物。
2.防锈的措施
原理
①隔绝水
②隔绝氧气
保持表面干燥
刷漆、涂油
镀一层其他金属(如铬)
烤蓝、镀“搪瓷”
制成不锈钢(加入Cr、Ni)
方法
(1)防止金属锈蚀
(2)回收利用废旧金属
(3)合理开采矿物
(4)寻找金属的代用品
防止污染环境
节约金属资源
四、金属资源的保护
Fe
Fe3O4
点燃 O2+
铁锈Fe2O3
H2O +O2+
FeCl2
+HCl
FeSO4
+稀H2SO4
Cu+FeSO4
CuSO4
+CO高温
+CO高温
请写以上6个化学反应方程式(3min)
例题:用1000 t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁多少 t
解:设可以炼出生铁的质量为x。
160 2×56
1000t×80% x·96%
160 2×56
1000t×80% x·96%
x= 583 t
答:略。
有关杂质问题的计算
在实验生产中,所用的原料或产物一般含有杂质,在计算用料和产量时,应考虑到杂质问题。
Fe2O3+3CO == 2Fe+3CO2
高温
解法2:利用铁元素质量守恒
Fe2O3
2Fe
M( Fe2O3)= 1000t×80%=800t
M(Fe)=800t×112/160×100%=560t
M(生铁)=560t÷96%=583t
m纯铁 = m生铁 × Fe%
m生铁 = m纯铁÷ Fe%
1.金属冶炼的方法。
2.实验室模拟炼铁的实验现象和步骤。
3.金属的锈蚀条件和防锈措施。
4.利用化学方程式进行杂质的计算。
课堂小结
同课章节目录
