化学人教版(2019)选择性必修1 1.1.1反应热 焓变(共17张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.1反应热 焓变(共17张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 40.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 20:31:58 | ||
图片预览






文档简介
(共17张PPT)
第1课时 反应热 焓变
第一章 第一节 反应热
教 学 目 标
核 心 素 养
1.了解内能、反应热、焓变的含义及反应热与焓变的关系。
2.掌握中和热的测定实验。从中理解热量的定量测定与计算。
宏观辨识与微观探析:能从宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应。
情 境 导 思
①CaCO3 === CaO + CO2↑
高温
②CaO +H2O === Ca(OH)2
下列4个反应中是放热反应的 ,是吸热反应的 。
③NaHCO3 +HCl === NaCl + H2O + CO2↑
④NaOH +HCl === NaCl + H2O
②③④
①
要进一步知道反应放出或吸收多少热量该用什么方法呢?
新 知 学 习
一、反应热及其测定
1.体系与环境
体系与环境示意图
环境
体系
体系:反应物及其发生的反应
如HCl(aq)、NaOH(aq)及其反应
环境:与体系相互影响的其他部分
如试管、空气等
热量:指因温度不同在体系与环境之间交换或传递的能量
什么情况下会导致体系与环境的温度不同呢?
显然只要体系发生了反应,就会导致体系与环境之间的温度不同,产生能量交换或传递。
新 知 学 习
反应热:
在等温条件下,化学反应体系向环境或从环境吸收的热量
反应热的测定:
反应前后体系的温度相同
如果反应前后环境的温度不变,那么反应过程中体系的温度就会改变,
结合体系的质量等就可测量反应热。
方法:通过量热计直接测定
实例:中和热的测定
一、反应热及其测定
2.反应热
原理
HCl + NaOH === NaCl + H2O
HCl(aq)、NaOH(aq)用量越多,产生的水越多,放热就越多,即生成水的量与放热成正比,所以计算生成1 mol水放出的热量即为中和热。
计算式
中和热=
Q
n(H2O)
(体系放热值记为Q ,Q又与
体系的质量及比热容有关)
=
[m(HCl(aq)) +m(NaOH(aq))] c(t2-t1)
n(H2O)
新 知 学 习
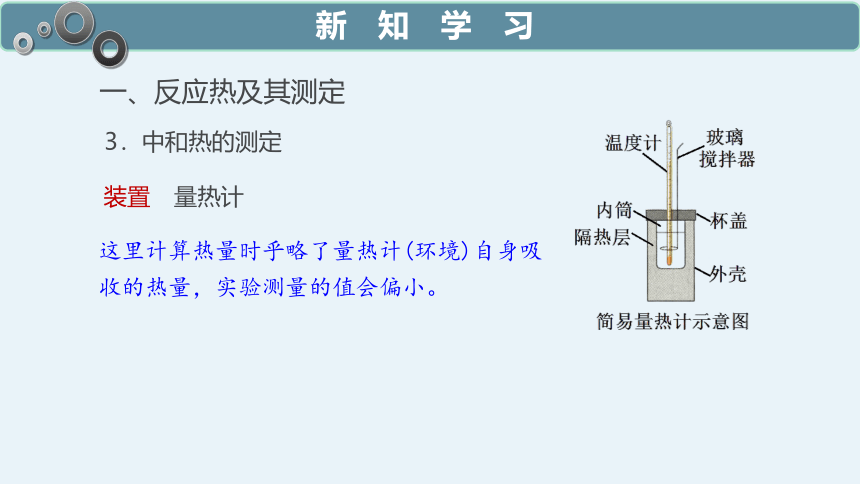
3.中和热的测定
一、反应热及其测定
t2为反应结束时温度,t1为反应前温度,因m(aq)=V(aq)·ρ,V (aq)可直接测量,本实验在反应过程中要测得的数据就是t1、t2
装置
量热计
这里计算热量时乎略了量热计(环境)自身吸收的热量,实验测量的值会偏小。
新 知 学 习
3.中和热的测定
一、反应热及其测定
次数 反应物的 温度℃ 反应前体系的温度 反应后体系的温度 Δt
HCl(50mL) NaOH(50mL) t1 /℃ t2 /℃ t2-t1
1
2
3
观察视频,了解实验过程,并记录相关数据填入表格
28.6
28.4
31.3
28.5
2.8
(50 +50)g× 4.18J/(g.℃)×2.8℃
0.05 L×0.5 mol/L
中和热=
=46.8 kJ/mol
[m(HCl) +m(NaOH)] c(t2-t1)
n(H2O)
中和热=
应该取3次平均值,这里只有一次数据
新 知 学 习
在25℃101 kPa下,强酸稀溶液与强碱稀溶液生成 1 mol H2O时放出57.3 kJ热量。
请分析实验结果偏低的原因有哪些?
量热器保温效果不好
溶液混合不够快速
反应不够充分
量盐酸后温度计没有冲洗就量NaOH溶液的温度
误差分析
化学反应为什么会产生反应热?
思 考 讨 论
新 知 学 习
二、反应热与焓变
1.内能(U) :
是体系内物质的各种能量的总和,受温度、
压强和物质的聚集状态等影响。
化学反应前后体系内能会发生变化,是反应热产生的根源
与内能有关的物理量
焓:
等压条件下的反应热
焓变(ΔH):
放热反应
ΔH <0
焓(H)
反应物
生成物
焓(H)
生成物
反应物
吸热反应
ΔH >0
反
应
热
放热反应
ΔH <0,体系的焓减小
吸热反应
ΔH >0,体系的焓增大
不同的物质焓不同
如 1 mol H2 与 1 mol Cl2的反应热: ΔH =-184.6 kJ/mol
如 1 mol C与 1 mol H2O(g)的反应热: ΔH =+131.5 kJ/mol
ΔH =H(生成物)-H(反应物)
2.焓与焓变
新 知 学 习
3.反应热的实质
旧键断裂与新键形成过程中能量的变化即为反应热
断
键
吸
热
成键放热
ΔH=反应物总键能-生成物总键能=(436+243) kJ/mol-2×431 kJ/mol
=-183 kJ/mol
二、反应热与焓变
1.在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验常用0.50 mol·L-1盐酸和0.55 mol·L-1的NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是 。
当室温低于10 ℃时进行,对实验结果会造成较大误差的原因是 。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量
为 kJ(填表达式)。
根据热量计算式:cmΔt = 4.18 J·g-1·℃-1×(50+50) g×(t2-t1)℃×10-3 kJ/J
新 知 检 测
保证盐酸完全被中和
散热太快
0.418(t2-t1)
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:
。
中和热是指在稀溶液中强酸
与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
新 知 检 测
不相等
相等
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
新 知 检 测
B
解析 若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
新 知 检 测
B
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键放出a kJ能量
解析 根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
新 知 检 测
4.在一定条件下,A和B反应可生成C和D,其能量变化如下:
若E1<E2,则该反应为 (填“吸热”或“放热”)反应,该反应的反应热为 。
A+B反应物总能量E1
C+D反应物总能量E2
A+B = C+D
解析 若E1<E2,反应吸收能量,ΔH=(E2-E1) kJ·mol-1>0;
相反,若E1>E2,反应放出能量,ΔH=(E2-E1) kJ·mol-1<0
吸热
ΔH=(E2-E1) kJ·mol-1
课 堂 小 结
反
应
热
定义
在等温条件下,化学反应体系向环境或从环境吸收的热量
获
取
方
法
用量热计测量
实验方法
理论计算
焓变
ΔH =H(生成物)-H(反应物)
如中和热测定
ΔH =E(生成物)-E(反应物)
ΔH <0 放热
ΔH >0 吸热
宏观
角度
微观
角度
键能
ΔH =E(断键总和) -E(成键总和)
计算式
仪器与操作
第1课时 反应热 焓变
第一章 第一节 反应热
教 学 目 标
核 心 素 养
1.了解内能、反应热、焓变的含义及反应热与焓变的关系。
2.掌握中和热的测定实验。从中理解热量的定量测定与计算。
宏观辨识与微观探析:能从宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应。
情 境 导 思
①CaCO3 === CaO + CO2↑
高温
②CaO +H2O === Ca(OH)2
下列4个反应中是放热反应的 ,是吸热反应的 。
③NaHCO3 +HCl === NaCl + H2O + CO2↑
④NaOH +HCl === NaCl + H2O
②③④
①
要进一步知道反应放出或吸收多少热量该用什么方法呢?
新 知 学 习
一、反应热及其测定
1.体系与环境
体系与环境示意图
环境
体系
体系:反应物及其发生的反应
如HCl(aq)、NaOH(aq)及其反应
环境:与体系相互影响的其他部分
如试管、空气等
热量:指因温度不同在体系与环境之间交换或传递的能量
什么情况下会导致体系与环境的温度不同呢?
显然只要体系发生了反应,就会导致体系与环境之间的温度不同,产生能量交换或传递。
新 知 学 习
反应热:
在等温条件下,化学反应体系向环境或从环境吸收的热量
反应热的测定:
反应前后体系的温度相同
如果反应前后环境的温度不变,那么反应过程中体系的温度就会改变,
结合体系的质量等就可测量反应热。
方法:通过量热计直接测定
实例:中和热的测定
一、反应热及其测定
2.反应热
原理
HCl + NaOH === NaCl + H2O
HCl(aq)、NaOH(aq)用量越多,产生的水越多,放热就越多,即生成水的量与放热成正比,所以计算生成1 mol水放出的热量即为中和热。
计算式
中和热=
Q
n(H2O)
(体系放热值记为Q ,Q又与
体系的质量及比热容有关)
=
[m(HCl(aq)) +m(NaOH(aq))] c(t2-t1)
n(H2O)
新 知 学 习
3.中和热的测定
一、反应热及其测定
t2为反应结束时温度,t1为反应前温度,因m(aq)=V(aq)·ρ,V (aq)可直接测量,本实验在反应过程中要测得的数据就是t1、t2
装置
量热计
这里计算热量时乎略了量热计(环境)自身吸收的热量,实验测量的值会偏小。
新 知 学 习
3.中和热的测定
一、反应热及其测定
次数 反应物的 温度℃ 反应前体系的温度 反应后体系的温度 Δt
HCl(50mL) NaOH(50mL) t1 /℃ t2 /℃ t2-t1
1
2
3
观察视频,了解实验过程,并记录相关数据填入表格
28.6
28.4
31.3
28.5
2.8
(50 +50)g× 4.18J/(g.℃)×2.8℃
0.05 L×0.5 mol/L
中和热=
=46.8 kJ/mol
[m(HCl) +m(NaOH)] c(t2-t1)
n(H2O)
中和热=
应该取3次平均值,这里只有一次数据
新 知 学 习
在25℃101 kPa下,强酸稀溶液与强碱稀溶液生成 1 mol H2O时放出57.3 kJ热量。
请分析实验结果偏低的原因有哪些?
量热器保温效果不好
溶液混合不够快速
反应不够充分
量盐酸后温度计没有冲洗就量NaOH溶液的温度
误差分析
化学反应为什么会产生反应热?
思 考 讨 论
新 知 学 习
二、反应热与焓变
1.内能(U) :
是体系内物质的各种能量的总和,受温度、
压强和物质的聚集状态等影响。
化学反应前后体系内能会发生变化,是反应热产生的根源
与内能有关的物理量
焓:
等压条件下的反应热
焓变(ΔH):
放热反应
ΔH <0
焓(H)
反应物
生成物
焓(H)
生成物
反应物
吸热反应
ΔH >0
反
应
热
放热反应
ΔH <0,体系的焓减小
吸热反应
ΔH >0,体系的焓增大
不同的物质焓不同
如 1 mol H2 与 1 mol Cl2的反应热: ΔH =-184.6 kJ/mol
如 1 mol C与 1 mol H2O(g)的反应热: ΔH =+131.5 kJ/mol
ΔH =H(生成物)-H(反应物)
2.焓与焓变
新 知 学 习
3.反应热的实质
旧键断裂与新键形成过程中能量的变化即为反应热
断
键
吸
热
成键放热
ΔH=反应物总键能-生成物总键能=(436+243) kJ/mol-2×431 kJ/mol
=-183 kJ/mol
二、反应热与焓变
1.在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)该实验常用0.50 mol·L-1盐酸和0.55 mol·L-1的NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是 。
当室温低于10 ℃时进行,对实验结果会造成较大误差的原因是 。
(2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量
为 kJ(填表达式)。
根据热量计算式:cmΔt = 4.18 J·g-1·℃-1×(50+50) g×(t2-t1)℃×10-3 kJ/J
新 知 检 测
保证盐酸完全被中和
散热太快
0.418(t2-t1)
(3)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:
。
中和热是指在稀溶液中强酸
与强碱发生中和反应生成1 mol H2O时的反应热,与酸和碱的用量无关
新 知 检 测
不相等
相等
2.某同学通过实验测出稀盐酸和稀NaOH溶液(碱稍过量)反应生成1 mol水的反应热ΔH=-52.3 kJ·mol-1,造成这一结果的原因不可能的是( )
A.实验装置保温、隔热效果差
B.用量筒量取盐酸时仰视读数
C.分多次将NaOH溶液倒入量热计的内筒中
D.用测量盐酸的温度计直接测定NaOH溶液的温度
新 知 检 测
B
解析 若装置保温、隔热效果差,会造成较多的热量损失,测得的反应热数值偏小,A项可能;仰视读数时,实际量取的溶液体积多于应该量取的溶液体积,会导致放出的热量变多,B项不可能;C项操作会导致较多的热量损失,C项可能;D项操作会导致测得的NaOH溶液的初始温度偏高,最后计算出的反应放出的热量比实际放出的热量少,D项可能。
新 知 检 测
B
3.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是( )
A.该反应每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键放出a kJ能量
解析 根据图像可知,反应物的总能量低于生成物的总能量,该反应是吸热反应,每生成2 mol AB(g)吸收(a-b) kJ热量,A、C项错误;根据反应热等于生成物总能量与反应物总能量的差值可知,该反应热ΔH=+(a-b) kJ·mol-1,B项正确;化学键断裂吸收能量,D项错误。
新 知 检 测
4.在一定条件下,A和B反应可生成C和D,其能量变化如下:
若E1<E2,则该反应为 (填“吸热”或“放热”)反应,该反应的反应热为 。
A+B反应物总能量E1
C+D反应物总能量E2
A+B = C+D
解析 若E1<E2,反应吸收能量,ΔH=(E2-E1) kJ·mol-1>0;
相反,若E1>E2,反应放出能量,ΔH=(E2-E1) kJ·mol-1<0
吸热
ΔH=(E2-E1) kJ·mol-1
课 堂 小 结
反
应
热
定义
在等温条件下,化学反应体系向环境或从环境吸收的热量
获
取
方
法
用量热计测量
实验方法
理论计算
焓变
ΔH =H(生成物)-H(反应物)
如中和热测定
ΔH =E(生成物)-E(反应物)
ΔH <0 放热
ΔH >0 吸热
宏观
角度
微观
角度
键能
ΔH =E(断键总和) -E(成键总和)
计算式
仪器与操作
