化学人教版(2019)必修第二册7.3.1乙醇(共23张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册7.3.1乙醇(共23张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 20:33:23 | ||
图片预览





文档简介
(共23张PPT)
第七章 第三节
第1课时 乙醇
(1)从传统文化和生活实际了解,激发学生学习化学的兴趣,认识乙醇与人类生活的密切联系。
(2)通过预测和实验推出乙醇的分子结构,提高科学探究水平,并从化学反应中得出官能团和烃的衍生物概念,深入理解“结构决定性质”这一基本规律。
(3)通过对乙醇的化学性质(与活泼金属反应、氧化反应)的学习,使学生了解官能团对物质性质的重要作用,体会由点及面的学习方法,提高宏观辨识和微观探析能力。
(4)根据乙醇在生产、生活中的应用,进一步认识结构、性质、用途之间的关系。
学习目标
将进酒
君不见黄河之水天上来,奔流到海不复回。
君不见高堂明镜悲白发,朝如青丝暮成雪。
人生得意须尽欢,莫使金樽空对月。
天生我材必有用,千金散尽还复来。
烹羊宰牛且为乐,会须一饮三百杯。
岑夫子,丹丘生,将进酒,杯莫停。
与君歌一曲,请君为我倾耳听。
钟鼓馔玉不足贵,但愿长醉不愿醒。
古来圣贤皆寂寞,惟有饮者留其名。
陈王昔时宴平乐,斗酒十千恣欢谑。
主人何为言少钱,径须沽取对君酌。
五花马,千金裘,
呼儿将出换美酒,与尔同销万古愁。
酒与传统文化
天若不爱酒,酒星不在天
地若不爱酒,地应无酒泉
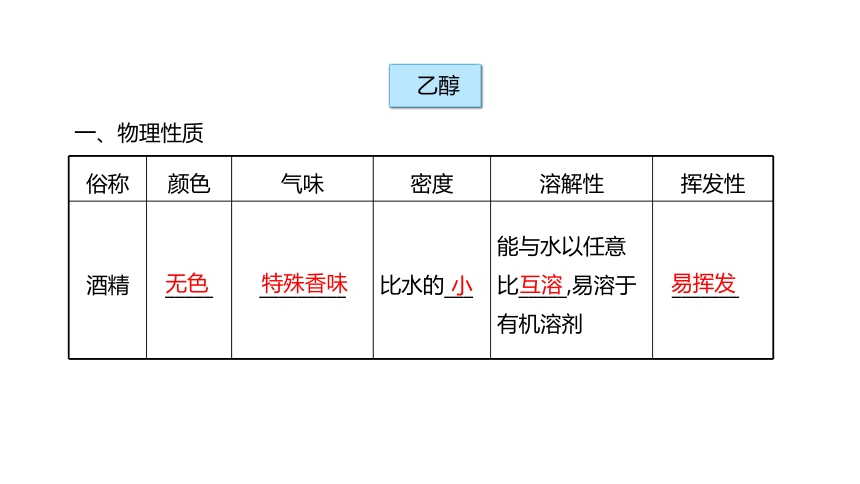
俗称 颜色 气味 密度 溶解性 挥发性
酒精 _____ _________ 比水的___ 能与水以任意比_____,易溶于有机溶剂 _______
无色
特殊香味
小
互溶
易挥发
一、物理性质
乙醇
1.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
【学以致用】
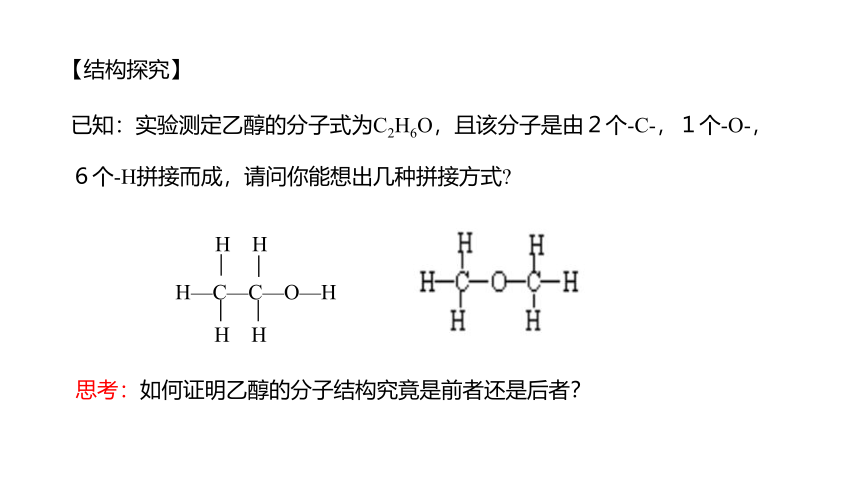
已知:实验测定乙醇的分子式为C2H6O,且该分子是由2个-C-,1个-O-,6个-H拼接而成,请问你能想出几种拼接方式
H—C—C—O—H
H H
H H
思考:如何证明乙醇的分子结构究竟是前者还是后者?
【结构探究】
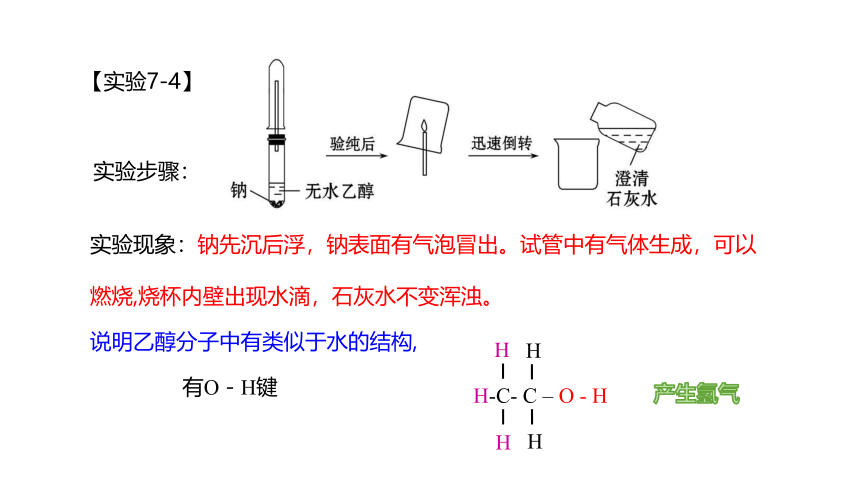
【实验7-4】
实验现象:钠先沉后浮,钠表面有气泡冒出。试管中有气体生成,可以燃烧,烧杯内壁出现水滴,石灰水不变浑浊。
H-C- C – O - H
H
H
H
H
说明乙醇分子中有类似于水的结构,
产生氢气
有O-H键
实验步骤:
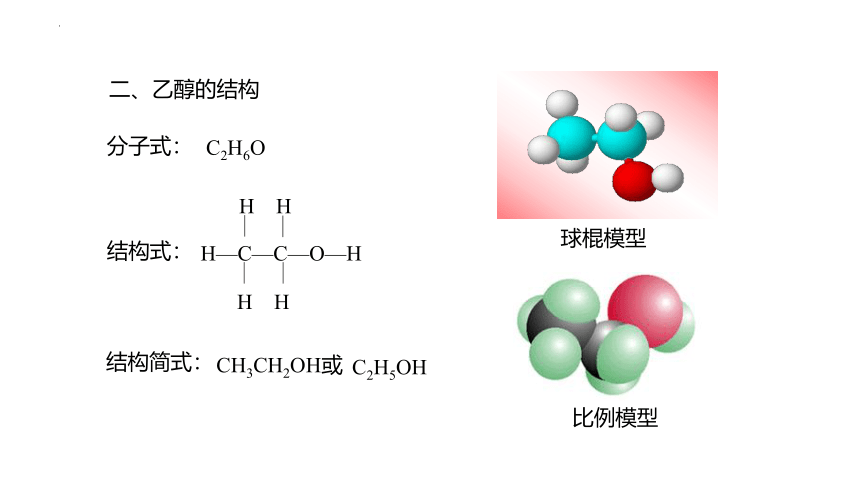
结构式:
结构简式:
C2H5OH
CH3CH2OH或
分子式:
C2H6O
球棍模型
二、乙醇的结构
比例模型
H—C—C—O—H
H H
H H
写出钠与水反应的化学方程式书写
2Na+ 2CH3CH2OH → 2CH3CH2ONa + H2↑
2Na+2H-OH === 2NaOH+ H2↑
回忆一下
羟基,写作-OH
决定有机物化学特性的原子或原子团叫做官能团。
H — C — C—O—H
H
H
H
H
官能团
(1)定义:决定有机化合物 的原子或原子团。
(2)实例
物质 CH3Cl CH3CH2OH CH2=CH2 CH≡CH
所含官 能团 _____ _____ —C≡C—
官能团的 名称 氯原子 _____ _________ ________
特性
—Cl
—OH
羟基
碳碳双键
碳碳三键
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物
三、乙醇的化学性质
1、乙醇与钠的反应
CH3CH2O H + Na → CH3CH2ONa +H2↑
2 2 2
【练习】其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2, 请写出镁与乙醇反应的化学方程式。
H—C —C—O—H
H H
H H
①
断键机理
Na代替—OH中的H
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
2、氧化反应
(1) 燃烧
(彻底氧化)
C2H5OH +3O2 2CO2+3H2O
点燃
作燃料 —— 飞机、汽车、火锅、酒精灯等
用乙醇做燃料的新式汽车
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
(2)催化氧化反应
实验现象:灼烧后铜丝由红色变为黑色,插入乙醇Cu丝黑色又变为红色,液体产生特殊气味。
断键机理:
2Cu + O2===2CuO
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
总式: 2CH3CH2OH + O2 2CH3CHO+2H2O
Cu
△
反应原理:
△
【科学态度与社会责任】
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。
驾驶员正在接受酒精检查
O
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
(3)被强氧化剂氧化
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
乙醇化学性质 断键小结
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为 的乙醇溶液作消毒剂。
75%
四、乙醇的用途
溶剂、制乙酸
制酒精型饮料 —— 啤酒、红酒等
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键( )
A. ①
2、发生催化氧化反应时在何处断键( )
A. ① ④
B. ②
B. ① ③
C. ③
C. ② ④
D. ④
D. ② ④
A
B
课堂练习
3、下列物质中有两种官能团的是( )
A.四氯甲烷 B.甘油 CH2 CH CH2
C.乙烷 D.氯乙烯(CH2 CH2Cl)
OH
OH
OH
D
4、在下列物质中,分别加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.无水酒精
C.苯 D. 75%的酒精
C
第七章 第三节
第1课时 乙醇
(1)从传统文化和生活实际了解,激发学生学习化学的兴趣,认识乙醇与人类生活的密切联系。
(2)通过预测和实验推出乙醇的分子结构,提高科学探究水平,并从化学反应中得出官能团和烃的衍生物概念,深入理解“结构决定性质”这一基本规律。
(3)通过对乙醇的化学性质(与活泼金属反应、氧化反应)的学习,使学生了解官能团对物质性质的重要作用,体会由点及面的学习方法,提高宏观辨识和微观探析能力。
(4)根据乙醇在生产、生活中的应用,进一步认识结构、性质、用途之间的关系。
学习目标
将进酒
君不见黄河之水天上来,奔流到海不复回。
君不见高堂明镜悲白发,朝如青丝暮成雪。
人生得意须尽欢,莫使金樽空对月。
天生我材必有用,千金散尽还复来。
烹羊宰牛且为乐,会须一饮三百杯。
岑夫子,丹丘生,将进酒,杯莫停。
与君歌一曲,请君为我倾耳听。
钟鼓馔玉不足贵,但愿长醉不愿醒。
古来圣贤皆寂寞,惟有饮者留其名。
陈王昔时宴平乐,斗酒十千恣欢谑。
主人何为言少钱,径须沽取对君酌。
五花马,千金裘,
呼儿将出换美酒,与尔同销万古愁。
酒与传统文化
天若不爱酒,酒星不在天
地若不爱酒,地应无酒泉
俗称 颜色 气味 密度 溶解性 挥发性
酒精 _____ _________ 比水的___ 能与水以任意比_____,易溶于有机溶剂 _______
无色
特殊香味
小
互溶
易挥发
一、物理性质
乙醇
1.下列有关乙醇的物理性质的应用中不正确的是( )
A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去
B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分
C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒
D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法
A
【学以致用】
已知:实验测定乙醇的分子式为C2H6O,且该分子是由2个-C-,1个-O-,6个-H拼接而成,请问你能想出几种拼接方式
H—C—C—O—H
H H
H H
思考:如何证明乙醇的分子结构究竟是前者还是后者?
【结构探究】
【实验7-4】
实验现象:钠先沉后浮,钠表面有气泡冒出。试管中有气体生成,可以燃烧,烧杯内壁出现水滴,石灰水不变浑浊。
H-C- C – O - H
H
H
H
H
说明乙醇分子中有类似于水的结构,
产生氢气
有O-H键
实验步骤:
结构式:
结构简式:
C2H5OH
CH3CH2OH或
分子式:
C2H6O
球棍模型
二、乙醇的结构
比例模型
H—C—C—O—H
H H
H H
写出钠与水反应的化学方程式书写
2Na+ 2CH3CH2OH → 2CH3CH2ONa + H2↑
2Na+2H-OH === 2NaOH+ H2↑
回忆一下
羟基,写作-OH
决定有机物化学特性的原子或原子团叫做官能团。
H — C — C—O—H
H
H
H
H
官能团
(1)定义:决定有机化合物 的原子或原子团。
(2)实例
物质 CH3Cl CH3CH2OH CH2=CH2 CH≡CH
所含官 能团 _____ _____ —C≡C—
官能团的 名称 氯原子 _____ _________ ________
特性
—Cl
—OH
羟基
碳碳双键
碳碳三键
烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物
三、乙醇的化学性质
1、乙醇与钠的反应
CH3CH2O H + Na → CH3CH2ONa +H2↑
2 2 2
【练习】其它活泼金属如钾、镁和铝等也可与乙醇反应,均可产生H2, 请写出镁与乙醇反应的化学方程式。
H—C —C—O—H
H H
H H
①
断键机理
Na代替—OH中的H
2CH3CH2OH + Mg (CH3CH2O)2Mg + H2↑
2、氧化反应
(1) 燃烧
(彻底氧化)
C2H5OH +3O2 2CO2+3H2O
点燃
作燃料 —— 飞机、汽车、火锅、酒精灯等
用乙醇做燃料的新式汽车
【实验7-5】向试管中加入少量乙醇,取一根铜丝,下端绕成螺旋状,在酒精灯上灼烧后插入乙醇,反复几次。注意观察反应现象,小心地闻试管中液体产生的气味。
(2)催化氧化反应
实验现象:灼烧后铜丝由红色变为黑色,插入乙醇Cu丝黑色又变为红色,液体产生特殊气味。
断键机理:
2Cu + O2===2CuO
CH3CH2OH + CuO CH3CHO+Cu+H2O
△
乙 醛
乙 醇
总式: 2CH3CH2OH + O2 2CH3CHO+2H2O
Cu
△
反应原理:
△
【科学态度与社会责任】
酒的主要成分是乙醇,少量饮酒对人体有益,但酗酒有害健康。科学研究表明酒量的大小与人体内某些酶有关。
驾驶员正在接受酒精检查
O
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
(3)被强氧化剂氧化
乙醇的性质 键的断裂
与钠反应 断①键
燃烧 断①②③④⑤键
催化氧化 断①③键
乙醇化学性质 断键小结
(1)用作酒精灯、火锅、内燃机等的燃料。
(2)用作生产医药、香料、化妆品、涂料等的化工原料。
(3)医疗上常用体积分数为 的乙醇溶液作消毒剂。
75%
四、乙醇的用途
溶剂、制乙酸
制酒精型饮料 —— 啤酒、红酒等
C—C—O—H
H
H
H
H
H
①
②
④
③
1、与钠反应时在何处断键( )
A. ①
2、发生催化氧化反应时在何处断键( )
A. ① ④
B. ②
B. ① ③
C. ③
C. ② ④
D. ④
D. ② ④
A
B
课堂练习
3、下列物质中有两种官能团的是( )
A.四氯甲烷 B.甘油 CH2 CH CH2
C.乙烷 D.氯乙烯(CH2 CH2Cl)
OH
OH
OH
D
4、在下列物质中,分别加入金属钠,不能产生氢气的是( )
A.蒸馏水 B.无水酒精
C.苯 D. 75%的酒精
C
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
