化学人教版(2019)选择性必修1 4.2.2电解原理的应用(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.2.2电解原理的应用(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 21:05:57 | ||
图片预览








文档简介
(共30张PPT)
第二节 电解池
第2课时 电解原理的应用
学习目标
1.理解电解饱和食盐水、电镀和电冶金的反应原理。
2.能够认识电解在实现物质转化和储存能量中的具体应用。
化学与生活
c
d
a
b
电源
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
Cl2 +2NaOH == NaCl + NaClO + H2O
混合遇火或遇强光爆炸
电解饱和食盐水要解决的主要问题
解决方法:使用离子交换膜
化学与生活
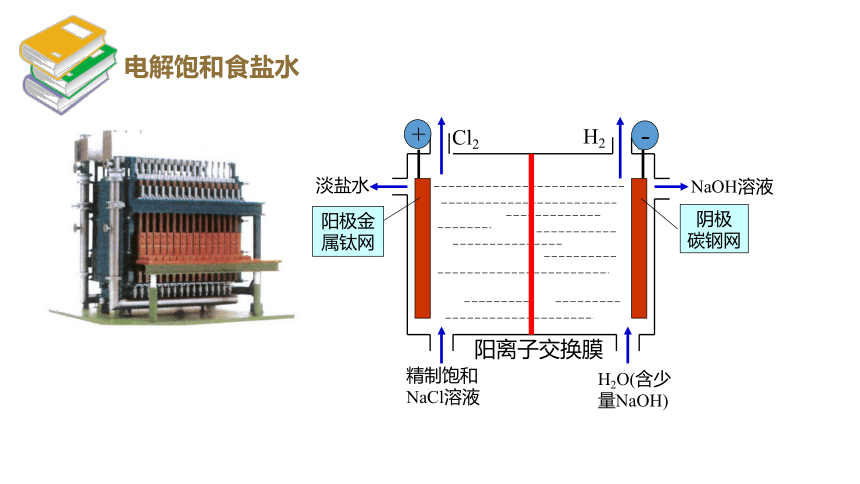
Cl2
H2
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极金
属钛网
阴极
碳钢网
+
-
电解饱和食盐水
-
+
离子交换膜
F
E
D
C
B
A
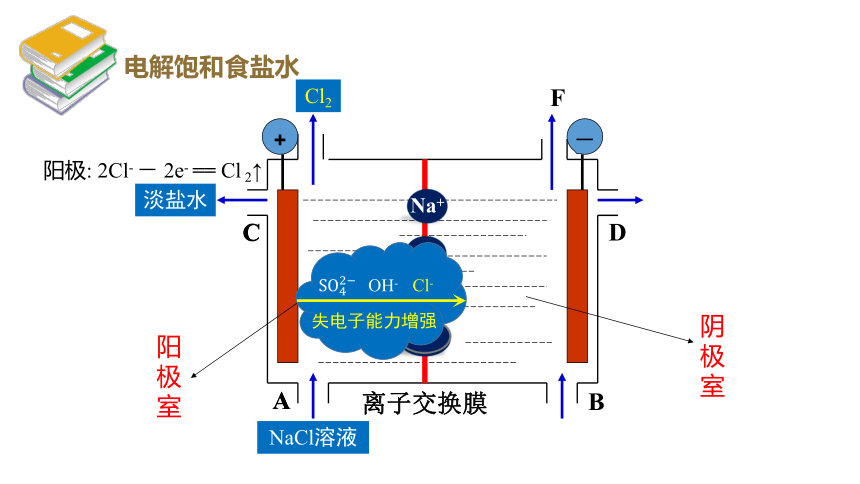
OH-
Cl-
H+
Na+
OH-
Cl-
OH- Cl-
失电子能力增强
阳极: 2Cl- - 2e- == Cl 2↑
Cl2
NaCl溶液
淡盐水
A
C
阳极室
阴极室
电解饱和食盐水
H2O
-
+
离子交换膜
F
E
D
C
B
A
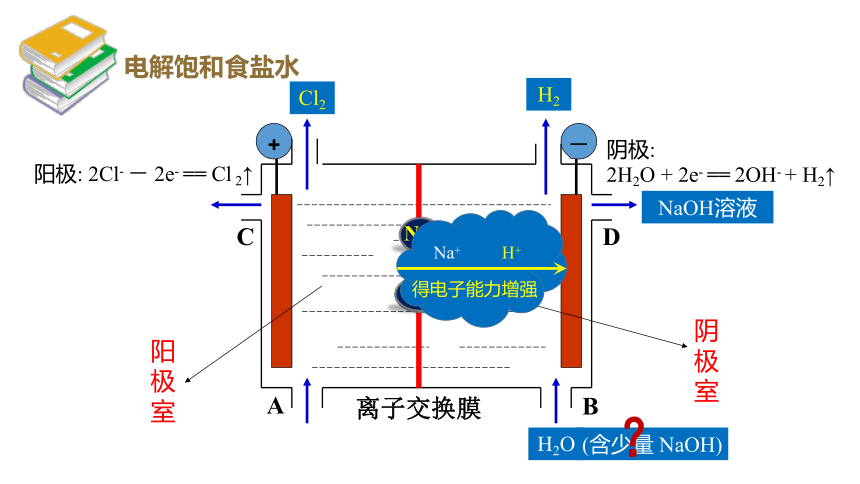
阳极: 2Cl- - 2e- == Cl 2↑
Cl2
H+
Na+
Na+
H+
Na+ H+
得电子能力增强
阴极:
2H2O + 2e- == 2OH- + H2↑
H2
(含少量 NaOH)
?
NaOH溶液
阳极室
阴极室
电解饱和食盐水
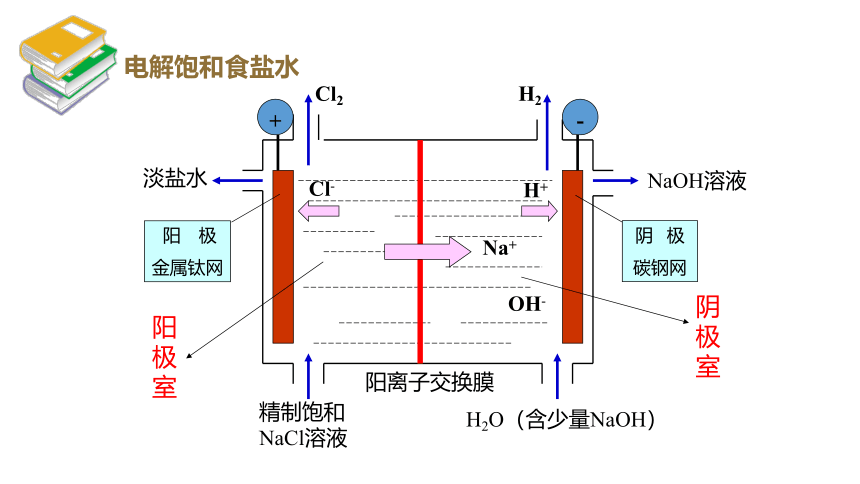
-
+
Cl2
Cl-
H2
Na+
H+
OH-
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
电解饱和食盐水
1.概念
2.原理
习惯上把电解饱和食盐水的工业生产叫做氯碱工业
阳极反应式:2Cl- - 2e- == Cl2↑
阴极反应式: 2H2O + 2e- == 2OH- + H2↑
总反应:
因H+放电,促进了水的电离,使阴极区溶液显碱性
电解饱和食盐水
2NaCl+2H2O 2NaOH+H2↑ + Cl2↑
电解
3.氯碱工业生产流程
(1)阳离子交换膜电解槽
只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠溶液反应而影响氢氧化钠溶液的产量和质量。
(2)阳离子交换膜的作用
电解饱和食盐水
4.氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、有机合成、农药等领域中广泛应用。
电解饱和食盐水
化学与生活
镀金奖杯
镀金饰品
景泰蓝
化学与生活
镀层金属
Cu
镀件
直流电源
+
-
阳极
阴极
阳极:
Cu - 2e- == Cu2+
阴极:
Cu2++ 2e- == Cu
CuSO4溶液
电镀
1.电镀
2.电镀池的构成
阴极:待镀物品——钥匙
阳极:镀层金属——铜
电解质溶液:含有镀层金属阳离子的电解质溶液——硫酸铜溶液
利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺
阴极反应式为:Cu2++2e- == Cu
阳极反应式为:Cu - 2e- == Cu2+
在钥匙上镀铜
硫酸铜溶液浓度基本不变
镀层金属通常是一些在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)。
电镀
[Au(CN) ]
2
-
e- ==
Au
2CN-
+
+
2H O
2
2e- ==
H2↑
2OH-
+
+
阴极主要电极反应
阳极
阴极
[Au(CN) ]
Au
2CN-
- e- ==
+
-
2
4OH-
- 4e- ==
2H2O+O2↑
阳极主要电极反应(金做阳极)
电镀金原理(含氰法)
电镀
孙淑兰 (1942- )
景泰蓝制作高级工程师
景泰蓝
上世纪70年代,研究出亚硫酸无氰镀金法,形成一条无氰镀金流水线,填补了我国无氰镀金的空白,后荣获国家科技进步奖。
[Au(SO ) ]
2
3
3-
e
-
+
Au
+
2SO
2-
3
阴极主要反应
镀金工艺改进
电镀
若要在铁制品表面镀镍,下列有关说法正确的是( )
B
理 论应 用
A.电镀液用硫酸亚铁溶液
B.镍应与电源的正极相连,铁制品应与电源的负极相连
C.阴极的电极反应 Ni - 2e- == Ni2+
D.电镀过程中电镀液中溶质的浓度会减小
电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- == Cl2
Na++ e- == Na
氧化反应
还原反应
电冶金
2NaCl(熔融) 2Na + Cl2↑
电解
1.本质
2.应用
制取一些活泼金属单质
Mn++ne- == M
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极: 2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:Al3++3e- == Al
电解
冰晶石
Al2O3(熔融) 4Al+ 3O2↑
2
2NaCl(熔融) 2Na + Cl2↑
电解
阳极: 2Cl- - 2e- == Cl2 ↑
阴极:Na++ e- == Na
电冶金
历史上伏打发明电池以后引起化学家利用电解方法研究元素的兴趣
电解与元素的发现
资 料 卡 片
戴维利用电解熔融碳酸钾、碳酸钠制得钾和钠
1807年
1808年
1808年
1823年
1825年
1886年
戴维电解碱土金属和汞的混合物制得镁、钙、锶、钡
戴维等用钾还原无水硼酸制得单质硼
贝采里乌斯(瑞典)用钾还原四氯化硅得到单质硅
奥斯特(丹麦)用钾汞齐还原无水氯化铝得到铝
莫瓦桑(法国)在无水HF中电解KHF2制得单质氟
电有机合成
许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。
电合成己二腈的反应如下:
阳极:2H2O - 4e- == 4H+ +O2↑
阴极:4CH2=CHCN + 4H+ + 4e- == 2NC(CH2) 4CN
总反应:4CH2=CHCN + 2H2O == 2NC(CH2) 4CN + O2↑
工业上先用丙烯为原料制备丙烯腈,再用丙烯腈电合成己二腈。
与其他有机合成相比,电有机合成具有反应条件温和、反应试剂纯净和生产效率高等优点。
资 料 卡 片
电解原理的应用
阳极:2Cl- - 2e- == Cl2↑
阴极: 2H2O + 2e- == 2OH- + H2↑
阳极(镀层金属):M - ne- == Mn+
阴极(镀件):Mn++ ne- == M
阳极: 2Cl- - 2e- == Cl2↑
阴极:Na++ e- == Na
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
电解
2NaCl(熔融) 2Na +Cl2↑
电解
电解饱和食盐水
电 镀
电冶金
小结
1. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e﹣ == Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
D
习题巩固
2. 工业上为了处理含有Cr2的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是( )
A. 阳极反应:Fe - 2e- == Fe2+
B. 阴极反应:2H++2e- == H2↑
C. 在电解过程中工业废水由酸性变为碱性
D. 可以将铁电极改为石墨电极
D
习题巩固
3. 某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中不正确的是( )
A. 电源中的a为正极,b为负极,制取效果较好
B. 可以用NaCl溶液作为电解液
C. A、B两端都必须用铁作电极
D. 阴极发生的反应是:2H++2e- == H2↑
C
习题巩固
A
B
a
b
电源
4. 在固态金属氧化物电解池中,高温电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A. X是电源的负极
B. 阴极的反应式:H2O+2e- == H2+O2-
CO2+2e- == CO+O2-
C. 总反应可表示:H2O+CO2 H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1∶1
D
电解
习题巩固
5. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
甲 乙 丙
习题巩固
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),该电极反应式为____________________________________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。
负极
H2-2e- +2OH- == 2H2O
阳极
铁极
5. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
甲 乙 丙
习题巩固
根据要求回答相关问题:
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为____________________。
减小
Cu2++2e- == Cu
第二节 电解池
第2课时 电解原理的应用
学习目标
1.理解电解饱和食盐水、电镀和电冶金的反应原理。
2.能够认识电解在实现物质转化和储存能量中的具体应用。
化学与生活
c
d
a
b
电源
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
Cl2 +2NaOH == NaCl + NaClO + H2O
混合遇火或遇强光爆炸
电解饱和食盐水要解决的主要问题
解决方法:使用离子交换膜
化学与生活
Cl2
H2
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳极金
属钛网
阴极
碳钢网
+
-
电解饱和食盐水
-
+
离子交换膜
F
E
D
C
B
A
OH-
Cl-
H+
Na+
OH-
Cl-
OH- Cl-
失电子能力增强
阳极: 2Cl- - 2e- == Cl 2↑
Cl2
NaCl溶液
淡盐水
A
C
阳极室
阴极室
电解饱和食盐水
H2O
-
+
离子交换膜
F
E
D
C
B
A
阳极: 2Cl- - 2e- == Cl 2↑
Cl2
H+
Na+
Na+
H+
Na+ H+
得电子能力增强
阴极:
2H2O + 2e- == 2OH- + H2↑
H2
(含少量 NaOH)
?
NaOH溶液
阳极室
阴极室
电解饱和食盐水
-
+
Cl2
Cl-
H2
Na+
H+
OH-
淡盐水
NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
金属钛网
阴 极
碳钢网
阳极室
阴极室
电解饱和食盐水
1.概念
2.原理
习惯上把电解饱和食盐水的工业生产叫做氯碱工业
阳极反应式:2Cl- - 2e- == Cl2↑
阴极反应式: 2H2O + 2e- == 2OH- + H2↑
总反应:
因H+放电,促进了水的电离,使阴极区溶液显碱性
电解饱和食盐水
2NaCl+2H2O 2NaOH+H2↑ + Cl2↑
电解
3.氯碱工业生产流程
(1)阳离子交换膜电解槽
只允许Na+等阳离子通过,不允许Cl-、OH-等阴离子及气体分子通过,可以防止阴极产生的氢气与阳极产生的氯气混合发生爆炸,也能避免氯气与阴极产生的氢氧化钠溶液反应而影响氢氧化钠溶液的产量和质量。
(2)阳离子交换膜的作用
电解饱和食盐水
4.氯碱工业产品及其应用
(1)氯碱工业产品主要有NaOH、Cl2、H2、含氯漂白剂等。
(2)以电解饱和食盐水为原理的氯碱工业产品在有机合成、造纸、玻璃、肥皂、纺织、印染、有机合成、农药等领域中广泛应用。
电解饱和食盐水
化学与生活
镀金奖杯
镀金饰品
景泰蓝
化学与生活
镀层金属
Cu
镀件
直流电源
+
-
阳极
阴极
阳极:
Cu - 2e- == Cu2+
阴极:
Cu2++ 2e- == Cu
CuSO4溶液
电镀
1.电镀
2.电镀池的构成
阴极:待镀物品——钥匙
阳极:镀层金属——铜
电解质溶液:含有镀层金属阳离子的电解质溶液——硫酸铜溶液
利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺
阴极反应式为:Cu2++2e- == Cu
阳极反应式为:Cu - 2e- == Cu2+
在钥匙上镀铜
硫酸铜溶液浓度基本不变
镀层金属通常是一些在空气或溶液中不易发生变化的金属(如铬、镍、银)和合金(如黄铜)。
电镀
[Au(CN) ]
2
-
e- ==
Au
2CN-
+
+
2H O
2
2e- ==
H2↑
2OH-
+
+
阴极主要电极反应
阳极
阴极
[Au(CN) ]
Au
2CN-
- e- ==
+
-
2
4OH-
- 4e- ==
2H2O+O2↑
阳极主要电极反应(金做阳极)
电镀金原理(含氰法)
电镀
孙淑兰 (1942- )
景泰蓝制作高级工程师
景泰蓝
上世纪70年代,研究出亚硫酸无氰镀金法,形成一条无氰镀金流水线,填补了我国无氰镀金的空白,后荣获国家科技进步奖。
[Au(SO ) ]
2
3
3-
e
-
+
Au
+
2SO
2-
3
阴极主要反应
镀金工艺改进
电镀
若要在铁制品表面镀镍,下列有关说法正确的是( )
B
理 论应 用
A.电镀液用硫酸亚铁溶液
B.镍应与电源的正极相连,铁制品应与电源的负极相连
C.阴极的电极反应 Ni - 2e- == Ni2+
D.电镀过程中电镀液中溶质的浓度会减小
电冶金
熔融NaCl
阴极
阳极
e-
e-
Na+
Cl-
2Cl- - 2e- == Cl2
Na++ e- == Na
氧化反应
还原反应
电冶金
2NaCl(熔融) 2Na + Cl2↑
电解
1.本质
2.应用
制取一些活泼金属单质
Mn++ne- == M
(熔融)
电解
Mg + Cl2↑
MgCl2
阳极: 2Cl- - 2e- == Cl2 ↑
阴极:Mg2++ 2e- == Mg
阳极:6O2- - 12e- == 3O2↑
阴极:Al3++3e- == Al
电解
冰晶石
Al2O3(熔融) 4Al+ 3O2↑
2
2NaCl(熔融) 2Na + Cl2↑
电解
阳极: 2Cl- - 2e- == Cl2 ↑
阴极:Na++ e- == Na
电冶金
历史上伏打发明电池以后引起化学家利用电解方法研究元素的兴趣
电解与元素的发现
资 料 卡 片
戴维利用电解熔融碳酸钾、碳酸钠制得钾和钠
1807年
1808年
1808年
1823年
1825年
1886年
戴维电解碱土金属和汞的混合物制得镁、钙、锶、钡
戴维等用钾还原无水硼酸制得单质硼
贝采里乌斯(瑞典)用钾还原四氯化硅得到单质硅
奥斯特(丹麦)用钾汞齐还原无水氯化铝得到铝
莫瓦桑(法国)在无水HF中电解KHF2制得单质氟
电有机合成
许多有机化学反应包含电子的转移,使这些反应在电解池中进行时称为电有机合成。
电合成己二腈的反应如下:
阳极:2H2O - 4e- == 4H+ +O2↑
阴极:4CH2=CHCN + 4H+ + 4e- == 2NC(CH2) 4CN
总反应:4CH2=CHCN + 2H2O == 2NC(CH2) 4CN + O2↑
工业上先用丙烯为原料制备丙烯腈,再用丙烯腈电合成己二腈。
与其他有机合成相比,电有机合成具有反应条件温和、反应试剂纯净和生产效率高等优点。
资 料 卡 片
电解原理的应用
阳极:2Cl- - 2e- == Cl2↑
阴极: 2H2O + 2e- == 2OH- + H2↑
阳极(镀层金属):M - ne- == Mn+
阴极(镀件):Mn++ ne- == M
阳极: 2Cl- - 2e- == Cl2↑
阴极:Na++ e- == Na
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
电解
2NaCl(熔融) 2Na +Cl2↑
电解
电解饱和食盐水
电 镀
电冶金
小结
1. 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e﹣ == Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
D
习题巩固
2. 工业上为了处理含有Cr2的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以铁为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬元素的含量可低于排放标准。关于上述方法,下列说法错误的是( )
A. 阳极反应:Fe - 2e- == Fe2+
B. 阴极反应:2H++2e- == H2↑
C. 在电解过程中工业废水由酸性变为碱性
D. 可以将铁电极改为石墨电极
D
习题巩固
3. 某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中不正确的是( )
A. 电源中的a为正极,b为负极,制取效果较好
B. 可以用NaCl溶液作为电解液
C. A、B两端都必须用铁作电极
D. 阴极发生的反应是:2H++2e- == H2↑
C
习题巩固
A
B
a
b
电源
4. 在固态金属氧化物电解池中,高温电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A. X是电源的负极
B. 阴极的反应式:H2O+2e- == H2+O2-
CO2+2e- == CO+O2-
C. 总反应可表示:H2O+CO2 H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1∶1
D
电解
习题巩固
5. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
甲 乙 丙
习题巩固
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),该电极反应式为____________________________________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。
负极
H2-2e- +2OH- == 2H2O
阳极
铁极
5. 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
甲 乙 丙
习题巩固
根据要求回答相关问题:
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为____________________。
减小
Cu2++2e- == Cu
