化学人教版(2019)选择性必修1 4.1.2化学电源(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.1.2化学电源(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-23 21:07:36 | ||
图片预览









文档简介
(共30张PPT)
第一节 原电池
第2课时 化学电源
学 习 目 标
1.了解一次电池、二次电池、燃料电池的构造及电极反应。
2.能够写出常见简单电池的电极反应。
化学与生活
便于携带、易于维护
内阻小
质量小
能量转化效率高
价格便宜、多次使用
体积小
供能稳定、连续工作
寿命长
……
理想的化学
电源
化学与生活
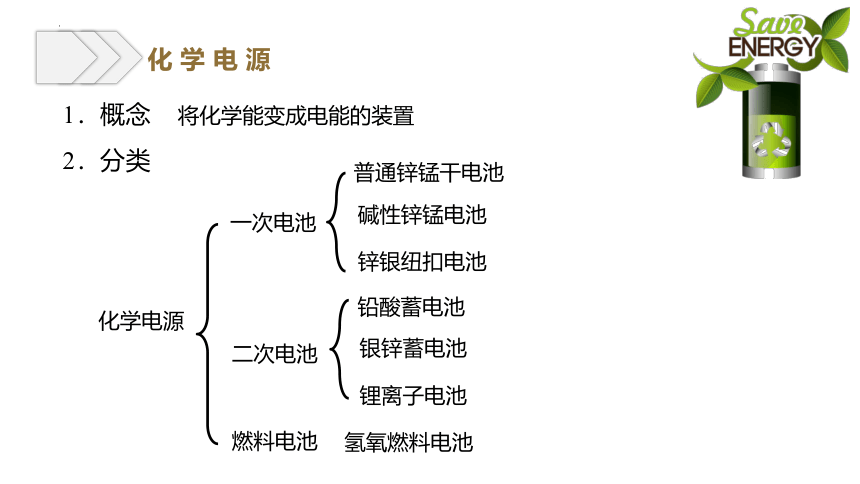
化 学 电 源
1.概念
化学电源
一次电池
二次电池
燃料电池
碱性锌锰电池
铅酸蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
2.分类
将化学能变成电能的装置
3.优点
(1) 能量转换效率高,供能稳定可靠
(2) 可以制成各种形状和大小、不同容量和电压的电池和电池组, 使用方便
(3) 方便携带,易维护,可在各种环境下工作
(1)比能量
质量好的电池:质量轻、体积小而输出电能多、功率大、储存时间长
4.判断标准
单位质量或单位体积所能输出电能的多少
单位:(W·h)/kg或(W·h)/L
(2)比功率
(3)电池的可储存时间的长短
单位质量或单位体积所能输出功率的多少
单位:W/kg或W/L
化 学 电 源
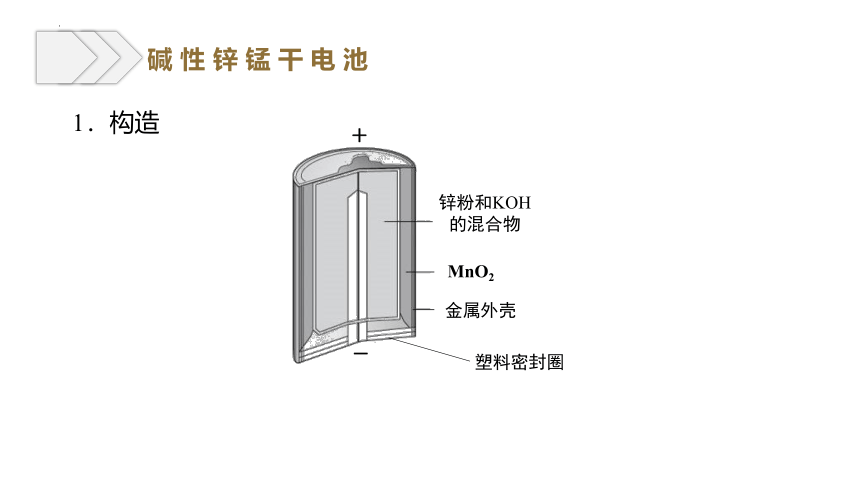
1.构造
塑料密封圈
+
-
锌粉和KOH的混合物
MnO2
金属外壳
碱 性 锌 锰 干 电 池
优点:电流稳定,放电容量大、时间长,不会涨气或漏液
缺点:只能一次使用,不能充电;价格较贵
负极:Zn+2OH- -2e- == Zn(OH)2
正极:2MnO2+2H2O+2e- == 2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O == 2MnO(OH)+Zn(OH)2
2.工作原理
碱 性 锌 锰 干 电 池
1. 微型银-锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O == 2Ag+Zn(OH)2,下列说法正确的是( )
A. 电池工作过程中,KOH溶液浓度降低
B. 电池工作过程中,电解液中OH-向正极迁移
C. 负极发生反应Zn+2OH- - 2e- == Zn(OH)2
D. 正极发生反应Ag2O+2H++2e- == 2Ag+H2O
C
学 习反 馈
纽扣式锌银电池
金属外壳
浸了KOH(aq)的隔板
锌负极
Ag2O正极
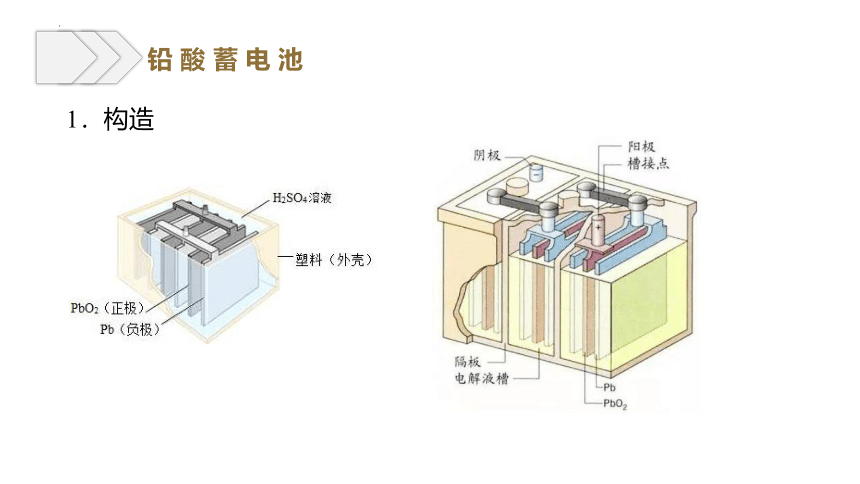
1.构造
铅 酸 蓄 电 池
(1) 负极:
(4) 放电过程中,负极质量增大,电解质溶液pH增大
Pb+- 2e- == PbSO4
PbO2+4H+++2e- == PbSO4+2H2O
2.工作原理
(2) 正极:
放电反应原理
(3) 总反应:Pb+PbO2+2H2SO4 == 2PbSO4+2H2O
铅 酸 蓄 电 池
(1) 阴极:
(4)充电时,正极与直流电源正极相连,负极与直流电源负极相连
PbSO4 == Pb+- 2e-
PbSO4+2H2O == PbO2+4H+++2e-
(2) 阳极:
充电反应原理
(3) 总反应:2PbSO4+2H2O == Pb+PbO2+2H2SO4
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
铅 酸 蓄 电 池
2.工作原理
缺点:比能量低,笨重,
废弃电池污染环境
优点:可重复使用,电压稳定,
使用方便,安全可靠,价格低廉
铅 酸 蓄 电 池
锂离子电池
资 料 卡 片
锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。
一种锂离子电池,其负极材料为嵌锂石墨,正极材料为钴酸锂,电解质溶液为六氟磷酸锂的碳酸酯溶液,反应原理为:
(1) 负极:
LixCy - xe- == xLi+ + Cy
Li1-xCoO2+ xLi+ +xe- == LiCoO2
(2) 正极:
(3) 总反应: LixCy + Li1-xCoO2 == LiCoO2 + Cy
资 料 卡 片
锂离子电池还可用于大型储能电站,当它正式并网投入运营后,在用电低谷时充电,在用电高峰时放电,可以实现对电能的灵活调节和精确控制。
锂离子电池
思考与讨论
电解水可以得到氢气和氧气,这是电能直接转化为化学能的过程。按照能量转化与守恒的观点推测:氢气与氧气反应由化学能转化为电能的过程也可能实现。这一过程到底能否实现呢?是怎样发生的呢?
1.构造
燃 料 电 池
酸性电解质(H2SO4) 碱性电解质(KOH)
负极反应
正极反应
总反应 (1) 连续地将燃料和氧化剂的化学能直接转换成电能
(2) 电极材料本身不参与氧化还原反应
(3) 工作时燃料和氧化剂连续地由外部供给,在电极上不断地反应,生成物不断地被排出
(4) 能量转化率高(>80%),排放废物少
2H2 - 4e- == 4H+
O2 + 4H+ + 4e- == 2H2O
2H2 +4OH- - 4e- == 4H2O
O2 + 2H2O + 4e- == 4OH-
2H2+O2 == 2H2O
2.工作原理
3.电池特点
燃 料 电 池
2. 根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极上发生的反应为( )
A. CH3OH+O2 - 2e- == H2O+CO2+2H+
B. O2+4H++4e- == 2H2O
C. CH3OH - 6e- +H2O == CO2↑+6H+
D. 4OH- - 4e- == O2↑+2H2O
C
学 习反 馈
方法导引
补项原则
酸性介质: 缺氢补H+ 缺氧补H2O
碱性介质: 缺氢补H2O 缺氧补OH-
电池在许多方面都有应用, 军事、移动装置、居民家庭、空间领域、运输等。一颗钮扣电池就能污染大约60万升水,相当于一个人一生的用水量。
废旧电池的危害与处理
一节1号电池烂在土壤中,能使1平方米的土地失去农业利用价值。
在1971年召开的国际环境会议上提出的对环境污染最严重的与电池污染相关的有三种即汞、镉、铅,这三种金属广泛存在于电池中,使用者丢弃后,电池在环境中自然腐蚀,大部分有害物质以各种形态进入环境中,直接污染水资源,再通过食物链进入人体,危害着人们的健康生活。
资 料 卡 片
迅猛发展的绿色环保电池是指近年来研制、开发和已投入使用的高性能、无污染电池。
绿色电池种种
资 料 卡 片
金属氢化物镍电池由于采用了稀土合金或TiNi合金储氢材料作为负极活性物质,取代了致癌物质镉,使其成为一种绿色环保电池。锂离子蓄电池是由碳作负极,嵌锂的金属氧化物作正极和有机电解质构成,其工作电压36伏,相当三个镉镍或金属氢化物镍电池。
迅猛发展的绿色环保电池是指近年来研制、开发和已投入使用的高性能、无污染电池。
绿色电池种种
资 料 卡 片
太阳能电池利用P—N结的光电效应,把太阳光能直接转
换成电能,满足用户需要。这种发电具有无需燃料、无污染、
无噪声、运行简单可靠、
减少维护、建设周期短等
特点,已被空间和无常规
能源的地域广泛采用。
历史上第一个化学电源
1789年,意大利生理学家伽法尼在一次解剖青蛙时,把铁钩钩着的青蛙腿挂在阳台的铁栏杆上,偶然发现蛙腿每次接触铁栏杆就会抽搐一次。经过研究,伽法尼认为这种肌肉收缩作用是“动物电”引起的。
科学史话
历史上第一个化学电源
1799年,伏打研制了能维持一定电流的电堆。这种电堆能为科研、生产提供稳恒电流,使电能成为人们认识、改造自然的锐利武器。1807年英国化学家戴维利用伏打电堆电解制得钾和钠,后来又陆续制得了镁、钙、锶、钡等。伏打电堆的发明,促进了新元素的发现、研究及电学的进一步发展,也为电化学的创建开辟了道路。
科学史话
1. 现在各类碱性电池已经占有了越来越多的市场份额,这类电池广泛的应用于各种小型用电器(如照相机、收音机等)中。有一种新型的锌锰电池就是这种碱性电池,它是在传统锌锰电池的基础上改进的。下列对于碱性锌锰电池的叙述中不正确的是( )
A. 碱性锌锰电池工作时,电子由锌极经外电路流向碳极
B. 这种电池较传统锌锰电池(即干电池)使用寿命长
C. 碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D. 这种电池的电解质由传统的NH4Cl换成湿的KOH
C
习题巩固
2. 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是( )
A. Zn为电池的负极
B. 正极反应式为2+10H++6e- == Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度增大
D. 电池工作时OH-向负极迁移
B
【解析】以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液的电池中,Zn为负极,发生反应:Zn - 2e- +2OH- == Zn(OH)2,K2FeO4为正极,发生反应:+4H2O+3e- == Fe(OH)3+5OH- ,放电过程中有OH-生成,则电解质溶液的浓度增大,OH-向负极迁移,A、C、D正确,B错误。
习题巩固
3. 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式:MnO2+4H++2e- == Mn2++2H2O
D
分子组成为Cm(H2O)n的物质不一定是糖类,例如乙酸(C2H4O2),A错误;微生物放电时,Cm(H2O)n中碳元素化合价升高失去电子,发生氧化反应,微生物所在的区域为负极区,B错误;原电池中阴离子向负极移动,阳离子向正极移动,C错误;正极得到电子发生还原反应,电极反应式为:MnO2+4H++2e- == Mn2++2H2O,D正确。
习题巩固
4. 最新研制出的以NaOH溶液为电解液的锌-空气电池具有零污染、高能量及材料可再生等优点,因而被专家们认为是电动汽车的理想动力电源。下列说法中正确的是( )
A. 该电池工作时,电子经外电路从正极流向负极
B. 该电池每天消耗65 g Zn时吸收11.2 L O2
C. 负极的电极反应式为Zn+4OH- - 2e- == +2H2O
D. 该电池在工作过程中电解液的pH增大
C
Zn原料
空气入口
空气出口
习题巩固
5. “ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
A. 电池反应中有NaCl生成
B. 电池的总反应是金属钠还原三价铝离子
C. 正极反应为NiCl2+2e- == Ni+2Cl-
D. 钠离子通过钠离子导体在两电极间移动
B
【解析】该原电池的负极反应式为Na - e- == Na+,正极反应式为NiCl2+2e- == Ni+2Cl- ,总电池反应式为2Na+NiCl2 == 2NaCl+Ni,B错误。
习题巩固
第一节 原电池
第2课时 化学电源
学 习 目 标
1.了解一次电池、二次电池、燃料电池的构造及电极反应。
2.能够写出常见简单电池的电极反应。
化学与生活
便于携带、易于维护
内阻小
质量小
能量转化效率高
价格便宜、多次使用
体积小
供能稳定、连续工作
寿命长
……
理想的化学
电源
化学与生活
化 学 电 源
1.概念
化学电源
一次电池
二次电池
燃料电池
碱性锌锰电池
铅酸蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
2.分类
将化学能变成电能的装置
3.优点
(1) 能量转换效率高,供能稳定可靠
(2) 可以制成各种形状和大小、不同容量和电压的电池和电池组, 使用方便
(3) 方便携带,易维护,可在各种环境下工作
(1)比能量
质量好的电池:质量轻、体积小而输出电能多、功率大、储存时间长
4.判断标准
单位质量或单位体积所能输出电能的多少
单位:(W·h)/kg或(W·h)/L
(2)比功率
(3)电池的可储存时间的长短
单位质量或单位体积所能输出功率的多少
单位:W/kg或W/L
化 学 电 源
1.构造
塑料密封圈
+
-
锌粉和KOH的混合物
MnO2
金属外壳
碱 性 锌 锰 干 电 池
优点:电流稳定,放电容量大、时间长,不会涨气或漏液
缺点:只能一次使用,不能充电;价格较贵
负极:Zn+2OH- -2e- == Zn(OH)2
正极:2MnO2+2H2O+2e- == 2MnO(OH)+2OH-
总反应:Zn+2MnO2+2H2O == 2MnO(OH)+Zn(OH)2
2.工作原理
碱 性 锌 锰 干 电 池
1. 微型银-锌电池可用作电子仪器的电源,其电极分别是Ag/Ag2O和Zn,电解质为KOH溶液,电池总反应为Ag2O+Zn+H2O == 2Ag+Zn(OH)2,下列说法正确的是( )
A. 电池工作过程中,KOH溶液浓度降低
B. 电池工作过程中,电解液中OH-向正极迁移
C. 负极发生反应Zn+2OH- - 2e- == Zn(OH)2
D. 正极发生反应Ag2O+2H++2e- == 2Ag+H2O
C
学 习反 馈
纽扣式锌银电池
金属外壳
浸了KOH(aq)的隔板
锌负极
Ag2O正极
1.构造
铅 酸 蓄 电 池
(1) 负极:
(4) 放电过程中,负极质量增大,电解质溶液pH增大
Pb+- 2e- == PbSO4
PbO2+4H+++2e- == PbSO4+2H2O
2.工作原理
(2) 正极:
放电反应原理
(3) 总反应:Pb+PbO2+2H2SO4 == 2PbSO4+2H2O
铅 酸 蓄 电 池
(1) 阴极:
(4)充电时,正极与直流电源正极相连,负极与直流电源负极相连
PbSO4 == Pb+- 2e-
PbSO4+2H2O == PbO2+4H+++2e-
(2) 阳极:
充电反应原理
(3) 总反应:2PbSO4+2H2O == Pb+PbO2+2H2SO4
Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
放电
充电
铅 酸 蓄 电 池
2.工作原理
缺点:比能量低,笨重,
废弃电池污染环境
优点:可重复使用,电压稳定,
使用方便,安全可靠,价格低廉
铅 酸 蓄 电 池
锂离子电池
资 料 卡 片
锂离子电池具有质量小、体积小、储存和输出能量大等特点,是多种便携式电子设备和交通工具的常用电池。
一种锂离子电池,其负极材料为嵌锂石墨,正极材料为钴酸锂,电解质溶液为六氟磷酸锂的碳酸酯溶液,反应原理为:
(1) 负极:
LixCy - xe- == xLi+ + Cy
Li1-xCoO2+ xLi+ +xe- == LiCoO2
(2) 正极:
(3) 总反应: LixCy + Li1-xCoO2 == LiCoO2 + Cy
资 料 卡 片
锂离子电池还可用于大型储能电站,当它正式并网投入运营后,在用电低谷时充电,在用电高峰时放电,可以实现对电能的灵活调节和精确控制。
锂离子电池
思考与讨论
电解水可以得到氢气和氧气,这是电能直接转化为化学能的过程。按照能量转化与守恒的观点推测:氢气与氧气反应由化学能转化为电能的过程也可能实现。这一过程到底能否实现呢?是怎样发生的呢?
1.构造
燃 料 电 池
酸性电解质(H2SO4) 碱性电解质(KOH)
负极反应
正极反应
总反应 (1) 连续地将燃料和氧化剂的化学能直接转换成电能
(2) 电极材料本身不参与氧化还原反应
(3) 工作时燃料和氧化剂连续地由外部供给,在电极上不断地反应,生成物不断地被排出
(4) 能量转化率高(>80%),排放废物少
2H2 - 4e- == 4H+
O2 + 4H+ + 4e- == 2H2O
2H2 +4OH- - 4e- == 4H2O
O2 + 2H2O + 4e- == 4OH-
2H2+O2 == 2H2O
2.工作原理
3.电池特点
燃 料 电 池
2. 根据甲醇在酸性电解质溶液中与氧气作用生成二氧化碳和水的反应,设计一种燃料电池。该燃料电池工作时,负极上发生的反应为( )
A. CH3OH+O2 - 2e- == H2O+CO2+2H+
B. O2+4H++4e- == 2H2O
C. CH3OH - 6e- +H2O == CO2↑+6H+
D. 4OH- - 4e- == O2↑+2H2O
C
学 习反 馈
方法导引
补项原则
酸性介质: 缺氢补H+ 缺氧补H2O
碱性介质: 缺氢补H2O 缺氧补OH-
电池在许多方面都有应用, 军事、移动装置、居民家庭、空间领域、运输等。一颗钮扣电池就能污染大约60万升水,相当于一个人一生的用水量。
废旧电池的危害与处理
一节1号电池烂在土壤中,能使1平方米的土地失去农业利用价值。
在1971年召开的国际环境会议上提出的对环境污染最严重的与电池污染相关的有三种即汞、镉、铅,这三种金属广泛存在于电池中,使用者丢弃后,电池在环境中自然腐蚀,大部分有害物质以各种形态进入环境中,直接污染水资源,再通过食物链进入人体,危害着人们的健康生活。
资 料 卡 片
迅猛发展的绿色环保电池是指近年来研制、开发和已投入使用的高性能、无污染电池。
绿色电池种种
资 料 卡 片
金属氢化物镍电池由于采用了稀土合金或TiNi合金储氢材料作为负极活性物质,取代了致癌物质镉,使其成为一种绿色环保电池。锂离子蓄电池是由碳作负极,嵌锂的金属氧化物作正极和有机电解质构成,其工作电压36伏,相当三个镉镍或金属氢化物镍电池。
迅猛发展的绿色环保电池是指近年来研制、开发和已投入使用的高性能、无污染电池。
绿色电池种种
资 料 卡 片
太阳能电池利用P—N结的光电效应,把太阳光能直接转
换成电能,满足用户需要。这种发电具有无需燃料、无污染、
无噪声、运行简单可靠、
减少维护、建设周期短等
特点,已被空间和无常规
能源的地域广泛采用。
历史上第一个化学电源
1789年,意大利生理学家伽法尼在一次解剖青蛙时,把铁钩钩着的青蛙腿挂在阳台的铁栏杆上,偶然发现蛙腿每次接触铁栏杆就会抽搐一次。经过研究,伽法尼认为这种肌肉收缩作用是“动物电”引起的。
科学史话
历史上第一个化学电源
1799年,伏打研制了能维持一定电流的电堆。这种电堆能为科研、生产提供稳恒电流,使电能成为人们认识、改造自然的锐利武器。1807年英国化学家戴维利用伏打电堆电解制得钾和钠,后来又陆续制得了镁、钙、锶、钡等。伏打电堆的发明,促进了新元素的发现、研究及电学的进一步发展,也为电化学的创建开辟了道路。
科学史话
1. 现在各类碱性电池已经占有了越来越多的市场份额,这类电池广泛的应用于各种小型用电器(如照相机、收音机等)中。有一种新型的锌锰电池就是这种碱性电池,它是在传统锌锰电池的基础上改进的。下列对于碱性锌锰电池的叙述中不正确的是( )
A. 碱性锌锰电池工作时,电子由锌极经外电路流向碳极
B. 这种电池较传统锌锰电池(即干电池)使用寿命长
C. 碱性锌锰电池可以实现化学能向电能的转化和电能向化学能的转化
D. 这种电池的电解质由传统的NH4Cl换成湿的KOH
C
习题巩固
2. 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液。下列说法不正确的是( )
A. Zn为电池的负极
B. 正极反应式为2+10H++6e- == Fe2O3+5H2O
C. 该电池放电过程中电解质溶液浓度增大
D. 电池工作时OH-向负极迁移
B
【解析】以K2FeO4和Zn为电极材料,KOH溶液为电解质溶液的电池中,Zn为负极,发生反应:Zn - 2e- +2OH- == Zn(OH)2,K2FeO4为正极,发生反应:+4H2O+3e- == Fe(OH)3+5OH- ,放电过程中有OH-生成,则电解质溶液的浓度增大,OH-向负极迁移,A、C、D正确,B错误。
习题巩固
3. 如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式:MnO2+4H++2e- == Mn2++2H2O
D
分子组成为Cm(H2O)n的物质不一定是糖类,例如乙酸(C2H4O2),A错误;微生物放电时,Cm(H2O)n中碳元素化合价升高失去电子,发生氧化反应,微生物所在的区域为负极区,B错误;原电池中阴离子向负极移动,阳离子向正极移动,C错误;正极得到电子发生还原反应,电极反应式为:MnO2+4H++2e- == Mn2++2H2O,D正确。
习题巩固
4. 最新研制出的以NaOH溶液为电解液的锌-空气电池具有零污染、高能量及材料可再生等优点,因而被专家们认为是电动汽车的理想动力电源。下列说法中正确的是( )
A. 该电池工作时,电子经外电路从正极流向负极
B. 该电池每天消耗65 g Zn时吸收11.2 L O2
C. 负极的电极反应式为Zn+4OH- - 2e- == +2H2O
D. 该电池在工作过程中电解液的pH增大
C
Zn原料
空气入口
空气出口
习题巩固
5. “ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是( )
A. 电池反应中有NaCl生成
B. 电池的总反应是金属钠还原三价铝离子
C. 正极反应为NiCl2+2e- == Ni+2Cl-
D. 钠离子通过钠离子导体在两电极间移动
B
【解析】该原电池的负极反应式为Na - e- == Na+,正极反应式为NiCl2+2e- == Ni+2Cl- ,总电池反应式为2Na+NiCl2 == 2NaCl+Ni,B错误。
习题巩固
