华师大版九上 2.2重要的酸 随堂练习(含解析)
文档属性
| 名称 | 华师大版九上 2.2重要的酸 随堂练习(含解析) |

|
|
| 格式 | doc | ||
| 文件大小 | 596.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2023-10-12 08:39:23 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
华师大版九上 2.2重要的酸 随堂练习
一、选择题
1.为了研究稀硫酸的性质,小金设计了如图所示实验。分别将过量的稀硫酸滴入盛有Zn粒、Fe2O3粉末.Cu(OH)2固体和Ba(NO3)2溶液的4支试管中。关于实验现象和分析正确的是( )
A.反应后4支试管中均得到无色溶液
B.Fe2O3粉末与稀硫酸反应会生成FeSO4
C.反应后的物质全部倒进废液缸不再发生新的反应
D.改成稀盐酸进行实验,实验现象都与稀硫酸相同
2.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料。下列物质不能与酒石酸反应的是( ) 21教育名师原创作品
A.Mg B.CO2 C.NaOH D.CuO
3.奥运五环的蓝、黄、黑、绿和红色象征欧、亚、非、大洋、美五大洲和全世界的运动员在奥运会上相聚一堂。若要用化学试剂给如下有凹槽的塑料奥运五环加上颜色(注:所给试剂恰好完全反应或完全溶解,凹槽可盛放溶液),你认为合理的是( )
A.用铜粉末和稀硫酸给蓝环上色 B.用铁粉和稀盐酸给黄色环上色
C.用氧化铁和稀盐酸给绿环上色 D.用氢氧化钠和酚酞给红环上色
4.兴趣小组按如图流程进行实验(每步均充分反应)。反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象。下列说法不正确的是( ) 【来源:21·世纪·教育·网】
A.滤渣中一定有Cu,一定没有Fe和Mg
B.滤液中的溶质一定有FeCl2、MgCl2和CuCl2
C.本实验可判断出铁、铜、镁的活动性顺序
D.两支试管混合后,固体总质量一定增加
5.下列实验操作中,正确的是
A.检查气密性 B.稀释浓硫酸
C.滴管取液 D.测定某溶液的pH
6.科学实验中,有许多涉及操作上的“先”“后”问题,下列描述的实验操作中“先”“后”顺序错误的是( )
A.使用弹簧测力计时,应先调零,后进行测量
B.稀释浓硫酸时先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中
C.使用显微镜观察细胞时,先调节粗准焦螺旋,后调节细准焦螺旋
D.实验室制取氧气,停止加热时,应先把导管移出水面,再熄灭酒精灯
二、填空题
7.盐酸和硫酸是两种重要的酸。
(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的 性。
(2)如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是 (填“浓硫酸”或“水”) 。
8.实验室用水吸收HCl气体时,若用导管直接将HCl气体通入水中,由于它溶解快、溶解度大,会造成导管内外压强差,形成倒吸(如图1),带来实验安全问题。图2装置用水吸收HCl气体时,可以防止发生倒吸。 21*cnjy*com
(1)结合图2装置中液体分层情况,可得液体A的密度 水的密度。(选填“大于”、“等于”或者“小于”) 21cnjy.com
(2)用图2装置吸收HCI气体可以防止发生倒吸,请分析选择的液体A还应该具有 的性质。 www.21-cn-jy.com
9.小科为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图所示为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),其中“〇”表示的是 (填离子符号)。
(2)反应后的四支试管中有一支为无色溶液,小科只向试管中加入一种试剂就确定了可能存在的成分,则加入的试剂为 。
10.盐酸和稀硫酸是初中科学常见的两种酸。请回答下列问题。
(1)胃液中含有的酸是 。
(2)除去Na2SO4溶液中的NaOH,可用的适量的酸是 。
三、实验探究题
11.浓盐酸具有挥发性,敞口放置于空气中,溶质质量分数变小。稀盐酸会发生同样的变化吗?
某同学通过如下步骤进行探究:
①取两个烧杯,各倒入40毫升3%的稀盐酸,分别标为甲和乙。
②甲密封,液体体积不变。乙敞口放置于空气中至液体体积变为20毫升。(溶液密度变化忽略不计)
③向甲、乙中滴加几滴石蕊试液,再分别缓慢滴加相同溶质质量分数的氢氧化钠溶液,恰好完全反应时,消耗的氢氧化钠溶液体积分别为30毫升、26毫升。
(1)实验中,“恰好完全反应”的判断依据是:溶液颜色 。
(2)乙烧杯中的稀盐酸敞口放置后,溶质质量分数变大,依据是______________________________
。 2-1-c-n-j-y
(3)为了确定稀盐酸口放置于空气中,溶质质量分数一定会变大,请简要闸述应补充的实验。
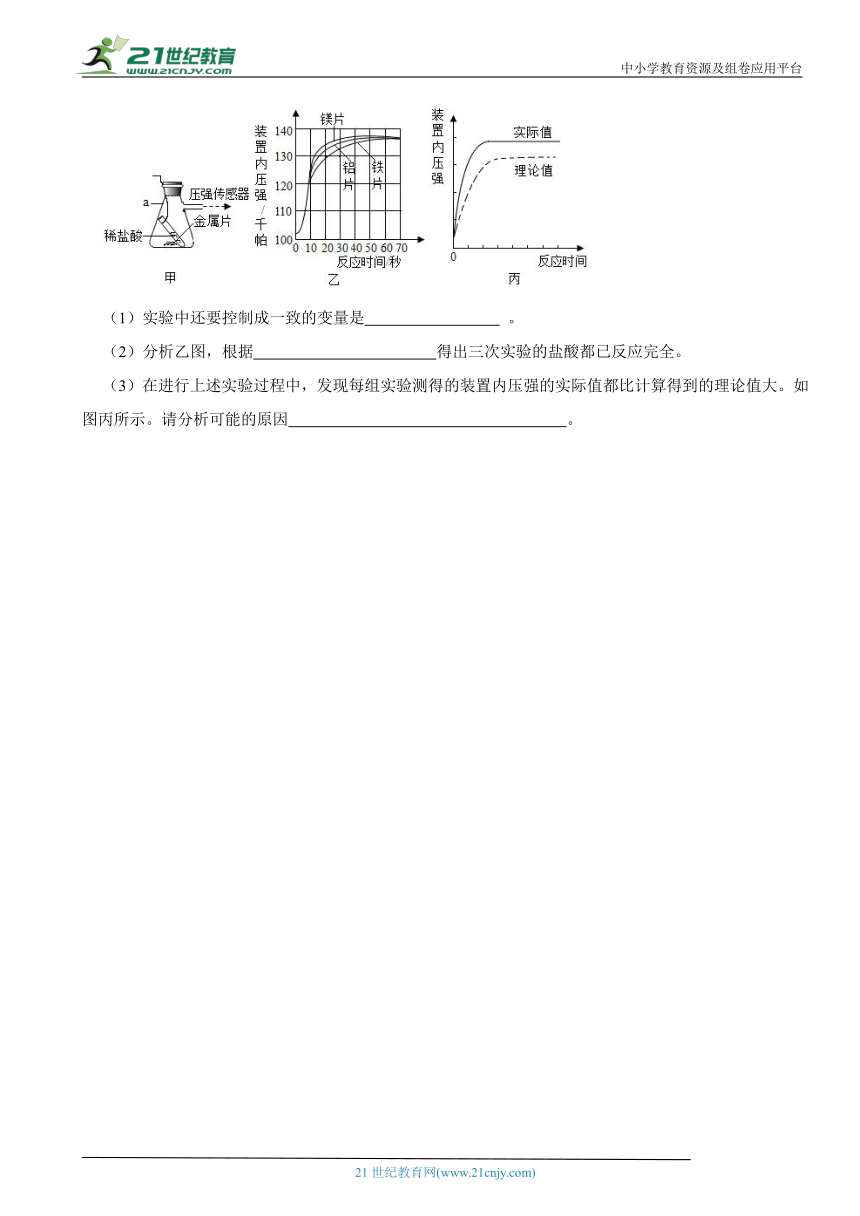
12.图甲装置可以用来比较不同金属与稀盐酸反应的快慢情况,其中的压强传感器能够测出密闭容器内的气压大小。现将等质量的镁、铝、铁与等量的等浓度的稀盐酸反应的相关数据记录如图乙。已知在等温、等体积条件下,装置内气压与气体的量成正比。
(1)实验中还要控制成一致的变量是 。
(2)分析乙图,根据 得出三次实验的盐酸都已反应完全。
(3)在进行上述实验过程中,发现每组实验测得的装置内压强的实际值都比计算得到的理论值大。如图丙所示。请分析可能的原因 。
答案解析部分
1.C
(1)使酸碱指示剂变色:紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色;无色酚酞试液遇酸溶液不变色(2)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应 (非氧化性酸)酸 + 金属-→盐 + 氢气;(3) 跟碱性氧化物和某些金属氧化物反应;酸 + 碱性(金属)氧化物-→盐+水;(4)跟碱起中和反应:酸+碱-→盐+水(5)与某些盐反应生成酸和新盐。盐+酸=新盐+新酸,要依照复分解的条件来判断是否会发生反应;21世纪教育网版
【解答】A.②号试管和③号试管分别得到黄色溶液和蓝色溶液,①号和④号得到无色溶液,A错误;
B. Fe2O3粉末与稀硫酸反应会生成Fe2(SO4)3;B错误;
C. 反应后的物质全部倒进废液缸不再发生新的反应,SO42-和NO3-不会和H+、Fe3+、Cu2+反应生成新的物质,C正确;2·1·c·n·j·y
D. 改成稀盐酸进行实验,①②③实验现象都与稀硫酸相同,属于酸的共性;④中无现象,这两者不发生反应,属于酸的个性,D错误;
故答案为:C
2.B
本题主要考查酸的化学性质,酸一般能与碱,金属氧化物,活泼金属,某些盐反应。
【解答】A.属于活泼金属能与酸反应;
B.非金属氧化物不能与酸反应;
C.酸能与碱反应;
D.酸能与金属氧化物反应;
故答案为:B
3.D
稀酸可以跟碱,活泼金属,金属氧化物,某些盐反应。
【解答】A.铜不与稀硫酸反应;
B.铁粉与稀盐酸反应生成的氯化亚铁是绿色的;
C.氧化铁与盐酸反应的氧化铁是黄色的;
D.氢氧化钠呈碱性,故遇酚酞呈红色;
故答案为:D
4.B
本题主要考查金属的活动性顺序对置换反应进行先后的影响。
【解答】由加入稀盐酸无现象可知滤渣中一定有铜,无其他金属;则滤液中一定有氯化镁,氯化亚铜,可能有氯化铜。
A.加入稀盐酸无现象可知滤渣中一定有铜,无其他金属;
www-2-1-cnjy-com
B.有上述分析可知氯化铜可能还没反应完,故可能有氯化铜;
C.根据第一次时的反应现象即可知三者的活动性,活动性强的金属置换活动性弱的金属;
D.不管是铁置换出铜还是镁置换出铜,由其相对原子质量可知,质量一定增大;
故答案为:B
5.A
A、根据热胀冷缩原理检查装置气密性的方法分析;
B、根据浓硫酸稀释酸入水中的步骤分析;
C、根据滴管的使用方法分析;
D、根据pH试纸的使用方法分析。 21教育网
【解答】A、检查装置气密性先将导管伸入水中形成密闭体系,再手握试管,观察导管口是否有气泡冒出,符合题意;
B、稀释浓硫酸时要将浓硫酸沿器壁缓缓倒入水中,并有玻璃棒搅拌散热,不符合题意;
C、滴管滴加液体要在试管口上方垂直悬空滴加,不能接触试管壁,不符合题意;
D、测溶液pH时不能将试纸浸入待测液中,应用玻璃棒蘸取少量液体滴在试纸上测定,不符合题意;
故选A。
6.B
从实验仪器的使用方法及注意事项、实验操作时的安全性等角度分析解答。
【解答】A.若不先调零,测量结果就会偏大或偏小,所以要先调零。正确
B.若将水沿着烧杯壁慢慢倒入浓硫酸中,因为浓硫酸溶于水会放出大量的热,而且水的密度比浓硫酸小,硫酸小液滴会飞溅,不安全。错误。
C.先调节粗准焦螺旋找到细胞,后调节细准焦螺旋可调节视野中细胞的清晰度。正确。
D.若先熄灭酒精灯,再把导管移出水面,会因为试管内气压降低而使水倒吸入试管,使试管破裂,所以要先把导管移出水面,再熄灭酒精灯。正确。
7.(1)脱水
(2)浓硫酸
(1)根据浓硫酸的脱水性分析;
(2)根据浓硫酸稀释“酸入水”中分析。
【解答】(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的脱水性;
(2)浓硫酸稀释时要将浓硫酸沿器壁缓缓倒入水中,所以烧杯中的液体A为浓硫酸。
故答案为:(1)脱水;(2)浓硫酸。【版权所有:21教育】
8.(1)大于
(2)不易溶解HCl气体,不与HCl气体反应
HCl气体极易溶于水,溶于水后形成盐酸溶液
【解答】(1)液体A在水的下层,说明液体A的密度大于水的密度
(2)图2为了防止倒吸现象,要求液体A应具有不易溶解HCl气体,且不与HCl气体发生反应;如果液体A能溶解HCl气体或者与HCl气体反应,那么HCl溶解在液体A后会使得导管内外有压强差,形成倒吸。
故答案为(1)大于 (2) 不易溶解HCl气体,不与HCl气体反应【来源:21cnj*y.co*m】
9.(1)H+
(2)紫色石蕊溶液
(1)反应前,试管中是稀硫酸,溶液中的离子是H+和SO42-,个数比为2:1,
所以白圈为H+,灰圈为SO42-
(2)铁、氢氧化钠、氧化铜、氯化钡加入到稀硫酸出现的现象分别是:粉末溶解,产生气体,溶液变为淡绿色;无色溶液;黑色粉末溶解,溶液变为蓝色;产生白色沉淀。紫色石蕊溶液可以区别酸性溶液和碱性溶液
【解答】(1)反应前溶液中的离子是H+和SO42-,个数比为2:1,“〇”4个,灰圈2个,所以答案为H+
(2)加入氢氧化钠的试管中溶液无色,稀硫酸和氢氧化钠反应生成硫酸钠和水。那么可能存在的成分是NaOH或H2SO4,可以用紫色石蕊溶液鉴别,所以答案为:紫色石蕊溶液21·cn·jy·com
10.(1)盐酸
(2)稀硫酸
(1)根据胃液中的酸为盐酸分析;
(2)根据除杂时不能引入新杂质分析。
【解答】(1) 胃液中含有的酸是盐酸;
(2)除去Na2SO4溶液中的NaOH,为不引入新杂质,可用的适量的酸是硫酸。
故答案为:(1)盐酸;(2)稀硫酸。21*cnjy*com
11.(1)恰好由红色变成紫色
(2)稀盐酸的体积变成一半,所消耗的氢氧化钠溶液体积大于一半
(3)换用不同质量分数的稀盐酸多次重复实验
(1)盐酸会与氢氧化钠反应,酸碱中和生成盐和水;
(2)(3)稀盐酸具有一定的挥发性;
【解答】(1)往盐酸中滴加石蕊后颜色为红色,滴入氢氧化钠的过程中,酸逐渐被中和,恰好反应时 溶液颜色恰好由红色变成紫色;
(2)若只挥发掉其中的溶质,则质量分数应减小,但现在变大是由于:稀盐酸的体积变成一半,所消耗的氢氧化钠溶液体积大于一半 ;
(3) 为了确定稀盐酸口放置于空气中,溶质质量分数一定会变大 ,应换用不同质量分数的稀盐酸多次重复实验。
12.(1)金属颗粒大小
(2)最终装置内气压相同
(3)氢气中混入了氯化氢气体或水蒸气
根据金属颗粒大小会影响反应速率,图像中最终装置内气压相同,利用金属与盐酸反应产生的氢气中含有氯化氢和水蒸气分析。
【出处:21教育名师】
【解答】(1)金属颗粒大小影响反应速率,所以实验中还需控制金属颗粒大小;
(2)由乙图中最终装置内气压相同,可得出三次实验的盐酸都已反应完全;
(3)盐酸具有挥发性,金属与酸反应产生的氢气中会混有氯化氢和水蒸气,使得实际值偏大。
故答案为:(1)金属颗粒大小;(2)最终装置内气压相同;(3) 氢气中混入了氯化氢气体或水蒸气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
华师大版九上 2.2重要的酸 随堂练习
一、选择题
1.为了研究稀硫酸的性质,小金设计了如图所示实验。分别将过量的稀硫酸滴入盛有Zn粒、Fe2O3粉末.Cu(OH)2固体和Ba(NO3)2溶液的4支试管中。关于实验现象和分析正确的是( )
A.反应后4支试管中均得到无色溶液
B.Fe2O3粉末与稀硫酸反应会生成FeSO4
C.反应后的物质全部倒进废液缸不再发生新的反应
D.改成稀盐酸进行实验,实验现象都与稀硫酸相同
2.酒石酸(C4H6O6)是葡萄酒中主要的有机酸之一,在水溶液中可以电离出H+,从而呈现酸性,主要用于饮料添加剂或药物工业原料。下列物质不能与酒石酸反应的是( ) 21教育名师原创作品
A.Mg B.CO2 C.NaOH D.CuO
3.奥运五环的蓝、黄、黑、绿和红色象征欧、亚、非、大洋、美五大洲和全世界的运动员在奥运会上相聚一堂。若要用化学试剂给如下有凹槽的塑料奥运五环加上颜色(注:所给试剂恰好完全反应或完全溶解,凹槽可盛放溶液),你认为合理的是( )
A.用铜粉末和稀硫酸给蓝环上色 B.用铁粉和稀盐酸给黄色环上色
C.用氧化铁和稀盐酸给绿环上色 D.用氢氧化钠和酚酞给红环上色
4.兴趣小组按如图流程进行实验(每步均充分反应)。反应结束后,将烧杯内物质进行过滤,向滤渣中加入少量稀盐酸,无明显现象。下列说法不正确的是( ) 【来源:21·世纪·教育·网】
A.滤渣中一定有Cu,一定没有Fe和Mg
B.滤液中的溶质一定有FeCl2、MgCl2和CuCl2
C.本实验可判断出铁、铜、镁的活动性顺序
D.两支试管混合后,固体总质量一定增加
5.下列实验操作中,正确的是
A.检查气密性 B.稀释浓硫酸
C.滴管取液 D.测定某溶液的pH
6.科学实验中,有许多涉及操作上的“先”“后”问题,下列描述的实验操作中“先”“后”顺序错误的是( )
A.使用弹簧测力计时,应先调零,后进行测量
B.稀释浓硫酸时先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中
C.使用显微镜观察细胞时,先调节粗准焦螺旋,后调节细准焦螺旋
D.实验室制取氧气,停止加热时,应先把导管移出水面,再熄灭酒精灯
二、填空题
7.盐酸和硫酸是两种重要的酸。
(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的 性。
(2)如图为实验室稀释浓硫酸的操作示意图,其中烧杯中的液体A是 (填“浓硫酸”或“水”) 。
8.实验室用水吸收HCl气体时,若用导管直接将HCl气体通入水中,由于它溶解快、溶解度大,会造成导管内外压强差,形成倒吸(如图1),带来实验安全问题。图2装置用水吸收HCl气体时,可以防止发生倒吸。 21*cnjy*com
(1)结合图2装置中液体分层情况,可得液体A的密度 水的密度。(选填“大于”、“等于”或者“小于”) 21cnjy.com
(2)用图2装置吸收HCI气体可以防止发生倒吸,请分析选择的液体A还应该具有 的性质。 www.21-cn-jy.com
9.小科为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图所示为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),其中“〇”表示的是 (填离子符号)。
(2)反应后的四支试管中有一支为无色溶液,小科只向试管中加入一种试剂就确定了可能存在的成分,则加入的试剂为 。
10.盐酸和稀硫酸是初中科学常见的两种酸。请回答下列问题。
(1)胃液中含有的酸是 。
(2)除去Na2SO4溶液中的NaOH,可用的适量的酸是 。
三、实验探究题
11.浓盐酸具有挥发性,敞口放置于空气中,溶质质量分数变小。稀盐酸会发生同样的变化吗?
某同学通过如下步骤进行探究:
①取两个烧杯,各倒入40毫升3%的稀盐酸,分别标为甲和乙。
②甲密封,液体体积不变。乙敞口放置于空气中至液体体积变为20毫升。(溶液密度变化忽略不计)
③向甲、乙中滴加几滴石蕊试液,再分别缓慢滴加相同溶质质量分数的氢氧化钠溶液,恰好完全反应时,消耗的氢氧化钠溶液体积分别为30毫升、26毫升。
(1)实验中,“恰好完全反应”的判断依据是:溶液颜色 。
(2)乙烧杯中的稀盐酸敞口放置后,溶质质量分数变大,依据是______________________________
。 2-1-c-n-j-y
(3)为了确定稀盐酸口放置于空气中,溶质质量分数一定会变大,请简要闸述应补充的实验。
12.图甲装置可以用来比较不同金属与稀盐酸反应的快慢情况,其中的压强传感器能够测出密闭容器内的气压大小。现将等质量的镁、铝、铁与等量的等浓度的稀盐酸反应的相关数据记录如图乙。已知在等温、等体积条件下,装置内气压与气体的量成正比。
(1)实验中还要控制成一致的变量是 。
(2)分析乙图,根据 得出三次实验的盐酸都已反应完全。
(3)在进行上述实验过程中,发现每组实验测得的装置内压强的实际值都比计算得到的理论值大。如图丙所示。请分析可能的原因 。
答案解析部分
1.C
(1)使酸碱指示剂变色:紫色石蕊试液或蓝色石蕊试纸遇酸溶液变红色;无色酚酞试液遇酸溶液不变色(2)跟金属活动性顺序表(H)前的活泼金属的单质起置换反应 (非氧化性酸)酸 + 金属-→盐 + 氢气;(3) 跟碱性氧化物和某些金属氧化物反应;酸 + 碱性(金属)氧化物-→盐+水;(4)跟碱起中和反应:酸+碱-→盐+水(5)与某些盐反应生成酸和新盐。盐+酸=新盐+新酸,要依照复分解的条件来判断是否会发生反应;21世纪教育网版
【解答】A.②号试管和③号试管分别得到黄色溶液和蓝色溶液,①号和④号得到无色溶液,A错误;
B. Fe2O3粉末与稀硫酸反应会生成Fe2(SO4)3;B错误;
C. 反应后的物质全部倒进废液缸不再发生新的反应,SO42-和NO3-不会和H+、Fe3+、Cu2+反应生成新的物质,C正确;2·1·c·n·j·y
D. 改成稀盐酸进行实验,①②③实验现象都与稀硫酸相同,属于酸的共性;④中无现象,这两者不发生反应,属于酸的个性,D错误;
故答案为:C
2.B
本题主要考查酸的化学性质,酸一般能与碱,金属氧化物,活泼金属,某些盐反应。
【解答】A.属于活泼金属能与酸反应;
B.非金属氧化物不能与酸反应;
C.酸能与碱反应;
D.酸能与金属氧化物反应;
故答案为:B
3.D
稀酸可以跟碱,活泼金属,金属氧化物,某些盐反应。
【解答】A.铜不与稀硫酸反应;
B.铁粉与稀盐酸反应生成的氯化亚铁是绿色的;
C.氧化铁与盐酸反应的氧化铁是黄色的;
D.氢氧化钠呈碱性,故遇酚酞呈红色;
故答案为:D
4.B
本题主要考查金属的活动性顺序对置换反应进行先后的影响。
【解答】由加入稀盐酸无现象可知滤渣中一定有铜,无其他金属;则滤液中一定有氯化镁,氯化亚铜,可能有氯化铜。
A.加入稀盐酸无现象可知滤渣中一定有铜,无其他金属;
www-2-1-cnjy-com
B.有上述分析可知氯化铜可能还没反应完,故可能有氯化铜;
C.根据第一次时的反应现象即可知三者的活动性,活动性强的金属置换活动性弱的金属;
D.不管是铁置换出铜还是镁置换出铜,由其相对原子质量可知,质量一定增大;
故答案为:B
5.A
A、根据热胀冷缩原理检查装置气密性的方法分析;
B、根据浓硫酸稀释酸入水中的步骤分析;
C、根据滴管的使用方法分析;
D、根据pH试纸的使用方法分析。 21教育网
【解答】A、检查装置气密性先将导管伸入水中形成密闭体系,再手握试管,观察导管口是否有气泡冒出,符合题意;
B、稀释浓硫酸时要将浓硫酸沿器壁缓缓倒入水中,并有玻璃棒搅拌散热,不符合题意;
C、滴管滴加液体要在试管口上方垂直悬空滴加,不能接触试管壁,不符合题意;
D、测溶液pH时不能将试纸浸入待测液中,应用玻璃棒蘸取少量液体滴在试纸上测定,不符合题意;
故选A。
6.B
从实验仪器的使用方法及注意事项、实验操作时的安全性等角度分析解答。
【解答】A.若不先调零,测量结果就会偏大或偏小,所以要先调零。正确
B.若将水沿着烧杯壁慢慢倒入浓硫酸中,因为浓硫酸溶于水会放出大量的热,而且水的密度比浓硫酸小,硫酸小液滴会飞溅,不安全。错误。
C.先调节粗准焦螺旋找到细胞,后调节细准焦螺旋可调节视野中细胞的清晰度。正确。
D.若先熄灭酒精灯,再把导管移出水面,会因为试管内气压降低而使水倒吸入试管,使试管破裂,所以要先把导管移出水面,再熄灭酒精灯。正确。
7.(1)脱水
(2)浓硫酸
(1)根据浓硫酸的脱水性分析;
(2)根据浓硫酸稀释“酸入水”中分析。
【解答】(1)浓硫酸使木棒或棉花变黑,体现了浓硫酸的脱水性;
(2)浓硫酸稀释时要将浓硫酸沿器壁缓缓倒入水中,所以烧杯中的液体A为浓硫酸。
故答案为:(1)脱水;(2)浓硫酸。【版权所有:21教育】
8.(1)大于
(2)不易溶解HCl气体,不与HCl气体反应
HCl气体极易溶于水,溶于水后形成盐酸溶液
【解答】(1)液体A在水的下层,说明液体A的密度大于水的密度
(2)图2为了防止倒吸现象,要求液体A应具有不易溶解HCl气体,且不与HCl气体发生反应;如果液体A能溶解HCl气体或者与HCl气体反应,那么HCl溶解在液体A后会使得导管内外有压强差,形成倒吸。
故答案为(1)大于 (2) 不易溶解HCl气体,不与HCl气体反应【来源:21cnj*y.co*m】
9.(1)H+
(2)紫色石蕊溶液
(1)反应前,试管中是稀硫酸,溶液中的离子是H+和SO42-,个数比为2:1,
所以白圈为H+,灰圈为SO42-
(2)铁、氢氧化钠、氧化铜、氯化钡加入到稀硫酸出现的现象分别是:粉末溶解,产生气体,溶液变为淡绿色;无色溶液;黑色粉末溶解,溶液变为蓝色;产生白色沉淀。紫色石蕊溶液可以区别酸性溶液和碱性溶液
【解答】(1)反应前溶液中的离子是H+和SO42-,个数比为2:1,“〇”4个,灰圈2个,所以答案为H+
(2)加入氢氧化钠的试管中溶液无色,稀硫酸和氢氧化钠反应生成硫酸钠和水。那么可能存在的成分是NaOH或H2SO4,可以用紫色石蕊溶液鉴别,所以答案为:紫色石蕊溶液21·cn·jy·com
10.(1)盐酸
(2)稀硫酸
(1)根据胃液中的酸为盐酸分析;
(2)根据除杂时不能引入新杂质分析。
【解答】(1) 胃液中含有的酸是盐酸;
(2)除去Na2SO4溶液中的NaOH,为不引入新杂质,可用的适量的酸是硫酸。
故答案为:(1)盐酸;(2)稀硫酸。21*cnjy*com
11.(1)恰好由红色变成紫色
(2)稀盐酸的体积变成一半,所消耗的氢氧化钠溶液体积大于一半
(3)换用不同质量分数的稀盐酸多次重复实验
(1)盐酸会与氢氧化钠反应,酸碱中和生成盐和水;
(2)(3)稀盐酸具有一定的挥发性;
【解答】(1)往盐酸中滴加石蕊后颜色为红色,滴入氢氧化钠的过程中,酸逐渐被中和,恰好反应时 溶液颜色恰好由红色变成紫色;
(2)若只挥发掉其中的溶质,则质量分数应减小,但现在变大是由于:稀盐酸的体积变成一半,所消耗的氢氧化钠溶液体积大于一半 ;
(3) 为了确定稀盐酸口放置于空气中,溶质质量分数一定会变大 ,应换用不同质量分数的稀盐酸多次重复实验。
12.(1)金属颗粒大小
(2)最终装置内气压相同
(3)氢气中混入了氯化氢气体或水蒸气
根据金属颗粒大小会影响反应速率,图像中最终装置内气压相同,利用金属与盐酸反应产生的氢气中含有氯化氢和水蒸气分析。
【出处:21教育名师】
【解答】(1)金属颗粒大小影响反应速率,所以实验中还需控制金属颗粒大小;
(2)由乙图中最终装置内气压相同,可得出三次实验的盐酸都已反应完全;
(3)盐酸具有挥发性,金属与酸反应产生的氢气中会混有氯化氢和水蒸气,使得实际值偏大。
故答案为:(1)金属颗粒大小;(2)最终装置内气压相同;(3) 氢气中混入了氯化氢气体或水蒸气。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
