化学人教版(2019)选择性必修1 2.2.1化学平衡状态(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.2.1化学平衡状态(共28张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-26 18:32:38 | ||
图片预览








文档简介
(共28张PPT)
化学平衡状态
化学(人教版)选择性必修1 第二章 第二节 第一课时
学习目标
通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,形成变化观念与平衡思想。
01
通过领会变化观念与平衡思想,理解化学平衡状态的特征,判断反应是否达到化学平衡状态。
02
扳手腕比赛
力的平衡、生态平衡、
家庭的收支平衡、
人口平衡、心理平衡…..
情境引入
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成氨,直到1913年才实现了合成氨的工业化生产。化学反应N2(g)+3H2(g) 2NH3(g)看起来十分简单,合成氨的工业化生产却经历了漫长的发展过程。化工生产中,我们需要考虑哪些因素呢?
——化学反应进行的限度
使原料尽可能快地转化为产品
使原料尽可能多地转化为产品
——化学反应速率
(即化学平衡)
情境引入
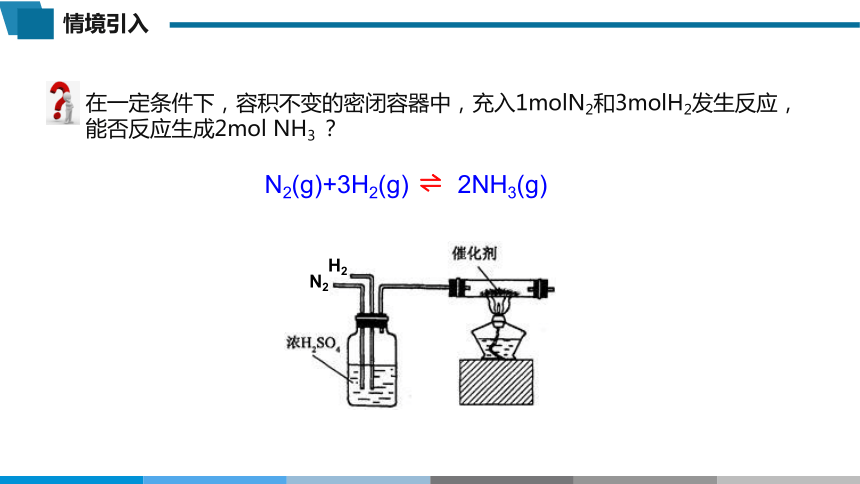
在一定条件下,容积不变的密闭容器中,充入1molN2和3molH2发生反应,能否反应生成2mol NH3 ?
N2(g)+3H2(g) 2NH3(g)
N2
H2
双向性
双同性
共存性
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
N2(g)+3H2(g) 2NH3(g)
——
2.表示:书写可逆反应的方程式不用“——”,而用“ ”连接。
3.特点:
可逆反应分为正反应方向和逆反应方向
正、逆反应在同一条件下同时进行
反应物与生成物共存,反应物的转化率小于100%
可逆反应
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
取2 ml 0.5 mol/L KI溶液,滴加2 ml 0.1 mol/L的FeCl3溶液,再继续加入2 ml CCl4,充分振荡、静置、分层,再取上清液,滴加KSCN溶液。
(1)该方案中能证明该反应为可逆反应的现象是:
_________________________________________
_________________________________________。
下层溶液呈紫红色,且上清夜中加KSCN后溶液呈血红色。
(2)有同学认为该方案不够严密,即使该反应不是可逆反应也可能出现上述现象,原因是:__________________________
______________________________。
振荡过程中,溶液中Fe2+可被空气中的氧气氧化成Fe3+
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
及时归纳
常见的可逆反应
在容积为1L的密闭容器里,加0.1mol N2和0.3mol H2
1. 化学平衡的建立
N2(g)+3H2 (g) 2NH3 (g)
二、化学平衡状态
对于以上反应,请分析:
(1)当反应刚开始时,反应物和生成物的浓度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个反应速率大?
(3)随着反应的进行,反应物和生成物浓度如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
(5)结合速率-时间图像进行分析?
化学平衡状态的建立
正反应
在一定条件下的容积不变的密闭容器中,合成氨反应:
浓度
时间
(a)反应从正向开始
2NH3
N2 + 3H2
催化剂
高温、高压
浓度—时间图
刚开始时:反应物浓度________,正反应速率________ ,生成物浓度为_________,逆反应速率_________ 。
反应过程中:反应物浓度_________ ,正反应速率_________ , 生成物浓度_________ ,逆反应速率_________。
t0时间后:必然出__________________。
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
最大
最大
0
0
渐小
渐小
渐大
渐大
υ正= υ逆
t0
t0
速率—时间图
一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡状态
1.定义:
v(逆)
v(正)=v(逆)
时间
速率
v(正)
0
时间
浓度
0
N2
H2
标志
本质
平衡状态是在一定条件下,可逆反应所能进行的最大程度,即可逆反应的限度。
NH3
N2(g)+3H2(g) 2NH3(g)
静态平衡
动态平衡
是不是化学反应到达平衡,反应就停止了?
思考:现在有一个蓄水池,分别有个进水口和出水口,
发现水面高低一直不变 ,为什么呢?
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量________
动
v正 ____ v逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
化学平衡状态
2.化学平衡状态的特征:
“标志”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
(1)同种物质—— v正(A) = v逆(A)
化学平衡状态的判定
1.
“等”
(2)不同物质—— v正(A) : v逆(B) = a : b(化学计量数之比)
①③
【例1 】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
正逆相等
【思维模型】
v正= v逆
①方向
②数值
相反
同一物质
不同物质
相同
化学计量比
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
2、在一定温度下,向 a L 的恒容密闭容器中加入1 molX气体和2 molY气体,发生如下反应: X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
A、反应速率 2v(X)=v(Z)
B、容器内各物质的浓度不随时间变化
C、容器内X、Y、Z的浓度之比为1:2:2
D、单位时间内消耗0.1 mol X 同时生成0.2 mol Z
B
化学平衡状态的判定
2.
“定”
变量不变
【思维模型】
变量
+
不变
=
平衡
【关键】 判断某参数是否是变量
【例2】 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
化学平衡状态的判定
2.
“定”
变量不变
①质量
②分子数(物质的量)
③浓度
④百分含量
小结:对于反应体系中的某一种物质:
以上参数不变时,均可作为判断平衡的依据。
⑤转化率
化学平衡状态的判定
【深入研究】
例如:A(s) B(g)+C(g)
时间 B的物质的量
C的物质的量
起始 0
0
1min 0.4
0.4
2min 0.6
0.6
3min 0.7
0.7
...... B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
反应体系中的某种气体的体积分数不变时,是否一定可以判断反应已达到平衡状态?
(即物质的量分数)
化学平衡状态的判定
(4) 针对气体的总物质的量n、总体积V,总压强P,要具体分析是否为变量:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量:
恒温恒容时的压强P:
减少
不变
不变
减少
气体的总物质的量n、总压强P,看反应前气体总系数是否等于反应后气体总系数,相等则不是变量,不相等则为变量。
恒温恒压时的体积V:
不变
减少
变量不变
化学平衡状态的判定
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
(5)恒温恒容时,气体的密度ρ不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+ m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,ρ是不变量,不能作为判断依据。
变量不变
化学平衡状态的判定
找固体
看气体系数
M=
m总
n总
分子、分母只要有一个是变量,M即可作为判断平衡的依据!
特例:单一气体的反应,气体平均相对分子质量一定时,不能作为判断平衡的标志。
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(S)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
(6)混合气体的平均摩尔质量M,不再变化时,要具体分析
变量不变
化学平衡状态的判定
2.
“定”
变量不变
【思维模型】
变量
+
不变
=
平衡
【关键】 判断某参数是否是变量
【例3】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
【思考】对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
化学平衡状态的判定
2.
“定”
变量不变
小结:对于有气体参与的整个反应体系:
mA(g)+nB(g) = pC(g)+qD(g)
(恒温恒容)
压强
本质
方法
n1
=
P1
P2
n2
密度
ρ =
m(g)
V(容器)
平均相对分子质量
M =
m(g)总
n(g)总
(气体总物质的量)
m+n ≠ p+q
√
m+n = p+q
×
m+n ≠ p+q
√
m+n = p+q
×
反应前后有非气体物质
反应前后无非气体物质
√
×
H2(g)+I2(g) 2HI(g)已经达到平衡状态的标志是
_______________。
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成n molH2的同时生成2n molHI
⑤单位时间内生成n mol H2的同时生成n mol I2
⑥一个H-H键断裂的同时有两个H-I键断裂
⑦恒温恒容下,容器内压强不再变化
⑧恒温恒容下,混合气体的颜色不再变化
⑨恒温恒压下,混合气体的密度不再变化
⑩条件一定,混合气体的平均相对分子质量不再变化
③,④,⑥,⑧
能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :
①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
④t min内生成1mol NH3同时消耗0.5mol N2
⑤t min内,生成1mol N2同时消耗3mol H2
⑥ 某时间内断裂3mol H-H键的同时,断裂6mol N-H键
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
⑨容器内密度不再发生变化
⑩容器内的平均相对分子质量不再发生变化
⑤⑥⑧⑩
随堂练习
在恒温恒容的容器中,当下列物理量不再发生变化时,能判断
已经达到化学平衡的是__________________
①2v逆(B)=v正(C)
②各反应物或生成物的浓度之比等于化学计量数之比
③某种气体的百分含量
④混合气体的压强
⑤混合气体的密度
⑥混合气体的总物质的量
⑦混合气体的平均相对分子质量
⑧混合气体的颜色
A(s)+2B(g) C(g)+D(g)
③⑤⑦
本课小结
化学平衡的研究对象
化学平衡状态
化学(人教版)选择性必修1 第二章 第二节 第一课时
学习目标
通过化学平衡状态的建立过程,知道化学平衡是一种动态平衡,形成变化观念与平衡思想。
01
通过领会变化观念与平衡思想,理解化学平衡状态的特征,判断反应是否达到化学平衡状态。
02
扳手腕比赛
力的平衡、生态平衡、
家庭的收支平衡、
人口平衡、心理平衡…..
情境引入
自1784年氨被发现以来,人们一直在研究如何利用化学方法由氮气和氢气合成氨,直到1913年才实现了合成氨的工业化生产。化学反应N2(g)+3H2(g) 2NH3(g)看起来十分简单,合成氨的工业化生产却经历了漫长的发展过程。化工生产中,我们需要考虑哪些因素呢?
——化学反应进行的限度
使原料尽可能快地转化为产品
使原料尽可能多地转化为产品
——化学反应速率
(即化学平衡)
情境引入
在一定条件下,容积不变的密闭容器中,充入1molN2和3molH2发生反应,能否反应生成2mol NH3 ?
N2(g)+3H2(g) 2NH3(g)
N2
H2
双向性
双同性
共存性
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应。
N2(g)+3H2(g) 2NH3(g)
——
2.表示:书写可逆反应的方程式不用“——”,而用“ ”连接。
3.特点:
可逆反应分为正反应方向和逆反应方向
正、逆反应在同一条件下同时进行
反应物与生成物共存,反应物的转化率小于100%
可逆反应
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
取2 ml 0.5 mol/L KI溶液,滴加2 ml 0.1 mol/L的FeCl3溶液,再继续加入2 ml CCl4,充分振荡、静置、分层,再取上清液,滴加KSCN溶液。
(1)该方案中能证明该反应为可逆反应的现象是:
_________________________________________
_________________________________________。
下层溶液呈紫红色,且上清夜中加KSCN后溶液呈血红色。
(2)有同学认为该方案不够严密,即使该反应不是可逆反应也可能出现上述现象,原因是:__________________________
______________________________。
振荡过程中,溶液中Fe2+可被空气中的氧气氧化成Fe3+
练、某学习小组为了证明2Fe3++2I 2Fe2++I2 为可逆反应,设计了如下的方案:
及时归纳
常见的可逆反应
在容积为1L的密闭容器里,加0.1mol N2和0.3mol H2
1. 化学平衡的建立
N2(g)+3H2 (g) 2NH3 (g)
二、化学平衡状态
对于以上反应,请分析:
(1)当反应刚开始时,反应物和生成物的浓度哪个大?
(2)当反应刚开始时,正反应与逆反应哪个反应速率大?
(3)随着反应的进行,反应物和生成物浓度如何变化?
(4)随着反应的进行,v(正)与v(逆)怎样变化?
(5)结合速率-时间图像进行分析?
化学平衡状态的建立
正反应
在一定条件下的容积不变的密闭容器中,合成氨反应:
浓度
时间
(a)反应从正向开始
2NH3
N2 + 3H2
催化剂
高温、高压
浓度—时间图
刚开始时:反应物浓度________,正反应速率________ ,生成物浓度为_________,逆反应速率_________ 。
反应过程中:反应物浓度_________ ,正反应速率_________ , 生成物浓度_________ ,逆反应速率_________。
t0时间后:必然出__________________。
H2
N2
NH3
时间
速率
υ正= υ逆
化学平衡状态
υ正
υ逆
最大
最大
0
0
渐小
渐小
渐大
渐大
υ正= υ逆
t0
t0
速率—时间图
一定条件下的可逆反应,正反应和逆反应的速率相等,反应混合物中各组分的浓度保持不变的状态。
化学平衡状态
1.定义:
v(逆)
v(正)=v(逆)
时间
速率
v(正)
0
时间
浓度
0
N2
H2
标志
本质
平衡状态是在一定条件下,可逆反应所能进行的最大程度,即可逆反应的限度。
NH3
N2(g)+3H2(g) 2NH3(g)
静态平衡
动态平衡
是不是化学反应到达平衡,反应就停止了?
思考:现在有一个蓄水池,分别有个进水口和出水口,
发现水面高低一直不变 ,为什么呢?
逆
化学平衡状态的研究对象是_______反应
等
各组分浓度/物质的量/百分含量________
动
v正 ____ v逆 ____ 0,是一个动态平衡
定
变
外界条件改变时,原平衡状态被破坏,在新条件下建立平衡
可逆
= ≠
保持不变
化学平衡状态
2.化学平衡状态的特征:
“标志”
“本质”
如何判断一个化学反应是否已达到平衡状态呢?
(1)同种物质—— v正(A) = v逆(A)
化学平衡状态的判定
1.
“等”
(2)不同物质—— v正(A) : v逆(B) = a : b(化学计量数之比)
①③
【例1 】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是______
① 单位时间内消耗1 mol N2 ,同时生成1 mol N2
② 单位时间内消耗1 mol N2 ,同时生成2 mol NH3
③ 单位时间内消耗1 mol N2 ,同时生成3 mol H2
正逆相等
【思维模型】
v正= v逆
①方向
②数值
相反
同一物质
不同物质
相同
化学计量比
④ 断裂3 mol H-H键 ,同时生成6 mol N-H键
2、在一定温度下,向 a L 的恒容密闭容器中加入1 molX气体和2 molY气体,发生如下反应: X(g)+2Y(g) 2Z(g),此反应达到平衡的标志是
A、反应速率 2v(X)=v(Z)
B、容器内各物质的浓度不随时间变化
C、容器内X、Y、Z的浓度之比为1:2:2
D、单位时间内消耗0.1 mol X 同时生成0.2 mol Z
B
化学平衡状态的判定
2.
“定”
变量不变
【思维模型】
变量
+
不变
=
平衡
【关键】 判断某参数是否是变量
【例2】 恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① N2 、H2 、 NH3 的浓度比为1:3:2
② N2的浓度不随时间变化
③ NH3的百分含量不再发生变化
④ 混合气体的颜色不再发生变化
⑤ H2的转化率不再发生变化
②③⑤
化学平衡状态的判定
2.
“定”
变量不变
①质量
②分子数(物质的量)
③浓度
④百分含量
小结:对于反应体系中的某一种物质:
以上参数不变时,均可作为判断平衡的依据。
⑤转化率
化学平衡状态的判定
【深入研究】
例如:A(s) B(g)+C(g)
时间 B的物质的量
C的物质的量
起始 0
0
1min 0.4
0.4
2min 0.6
0.6
3min 0.7
0.7
...... B、C的体积分数始终为1/2,不是变量,不能作为判断平衡的依据。
反应体系中的某种气体的体积分数不变时,是否一定可以判断反应已达到平衡状态?
(即物质的量分数)
化学平衡状态的判定
(4) 针对气体的总物质的量n、总体积V,总压强P,要具体分析是否为变量:
A(g) + B(g) 2C(g)
A(g) + B(g) C(g)
气体的总物质的量:
恒温恒容时的压强P:
减少
不变
不变
减少
气体的总物质的量n、总压强P,看反应前气体总系数是否等于反应后气体总系数,相等则不是变量,不相等则为变量。
恒温恒压时的体积V:
不变
减少
变量不变
化学平衡状态的判定
恒容时,凡是有固体参与的气体反应,其气体密度都会变,此时ρ是变量,可以作为判断依据。
(5)恒温恒容时,气体的密度ρ不再变化时,要具体分析
ρ=
m总
v
不会变
气体质量增加,ρ是变量,可以作为判断依据。
对于反应:A(s)+B(g) C(g)
mA+ m B= mC (质量守恒)
找固体,若方程式中有固体,则气体总质量会变化
对于反应:A(g)+B(g) C(g)
质量守恒,气体质量不变,ρ是不变量,不能作为判断依据。
变量不变
化学平衡状态的判定
找固体
看气体系数
M=
m总
n总
分子、分母只要有一个是变量,M即可作为判断平衡的依据!
特例:单一气体的反应,气体平均相对分子质量一定时,不能作为判断平衡的标志。
A(g)+B(g) 2C(g)
A(g)+B(g) C(g)
A(S)+B(g) C(g)
m总
n总
M
不变
不变
不变
不变
变
变
变
变
不变
(6)混合气体的平均摩尔质量M,不再变化时,要具体分析
变量不变
化学平衡状态的判定
2.
“定”
变量不变
【思维模型】
变量
+
不变
=
平衡
【关键】 判断某参数是否是变量
【例3】恒温恒容时,可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的标志是_________
① 混合气体总的物质的量不再发生变化
② 气体的总压强不再发生变化
③ 混合气体的平均相对分子质量不再发生变化
④ 混合气体的密度不再发生变化
①②③
【思考】对于可逆反应: H2(g)+I2(g) 2HI(g)呢 ?
都不行
化学平衡状态的判定
2.
“定”
变量不变
小结:对于有气体参与的整个反应体系:
mA(g)+nB(g) = pC(g)+qD(g)
(恒温恒容)
压强
本质
方法
n1
=
P1
P2
n2
密度
ρ =
m(g)
V(容器)
平均相对分子质量
M =
m(g)总
n(g)总
(气体总物质的量)
m+n ≠ p+q
√
m+n = p+q
×
m+n ≠ p+q
√
m+n = p+q
×
反应前后有非气体物质
反应前后无非气体物质
√
×
H2(g)+I2(g) 2HI(g)已经达到平衡状态的标志是
_______________。
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成n molH2的同时生成2n molHI
⑤单位时间内生成n mol H2的同时生成n mol I2
⑥一个H-H键断裂的同时有两个H-I键断裂
⑦恒温恒容下,容器内压强不再变化
⑧恒温恒容下,混合气体的颜色不再变化
⑨恒温恒压下,混合气体的密度不再变化
⑩条件一定,混合气体的平均相对分子质量不再变化
③,④,⑥,⑧
能够说明 N2 + 3H2 2NH3反应在密闭容器中已达到平衡状态的是 :
①容器内N2、H2、NH3三者共存
②容器内N2、H2、NH3三者浓度相等
③ 容器内N2、H2、NH3的浓度比恰为1:3:2
④t min内生成1mol NH3同时消耗0.5mol N2
⑤t min内,生成1mol N2同时消耗3mol H2
⑥ 某时间内断裂3mol H-H键的同时,断裂6mol N-H键
⑦容器内质量不随时间的变化而变化
⑧容器内压强不随时间的变化而变化
⑨容器内密度不再发生变化
⑩容器内的平均相对分子质量不再发生变化
⑤⑥⑧⑩
随堂练习
在恒温恒容的容器中,当下列物理量不再发生变化时,能判断
已经达到化学平衡的是__________________
①2v逆(B)=v正(C)
②各反应物或生成物的浓度之比等于化学计量数之比
③某种气体的百分含量
④混合气体的压强
⑤混合气体的密度
⑥混合气体的总物质的量
⑦混合气体的平均相对分子质量
⑧混合气体的颜色
A(s)+2B(g) C(g)+D(g)
③⑤⑦
本课小结
化学平衡的研究对象
