化学人教版(2019)选择性必修1 1.1.反应热(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 1.1.反应热(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 462.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-26 18:34:48 | ||
图片预览






文档简介
(共34张PPT)
第一章 化学反应的热效应
第一节 反应热
化学 选修1 化学反应原理
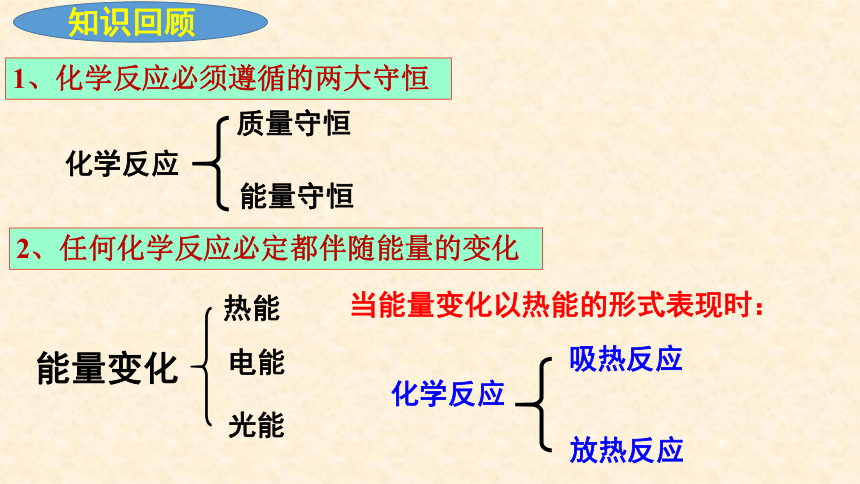
知识回顾
1、化学反应必须遵循的两大守恒
化学反应
能量守恒
质量守恒
2、任何化学反应必定都伴随能量的变化
能量变化
热能
电能
光能
当能量变化以热能的形式表现时:
化学反应
放热反应
吸热反应
2.键能:
H2 与Cl2 反应的方程式?
思考
思考
一个反应放热还是吸热,是否取决于反应条件?
为什么有的反应会放热,有的需要吸热呢?
思考
H2 + Cl2 ====== 2HCl
点燃/强光
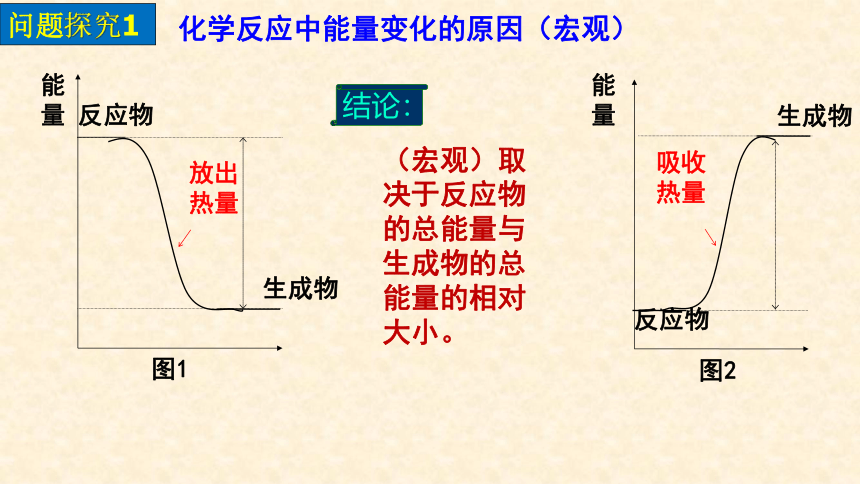
问题探究1
放出热量
生成物
图1
反应物
能量
生成物
反应物
能量
图2
吸收热量
结论:
(宏观)取决于反应物的总能量与生成物的总能量的相对大小。
化学反应中能量变化的原因(宏观)
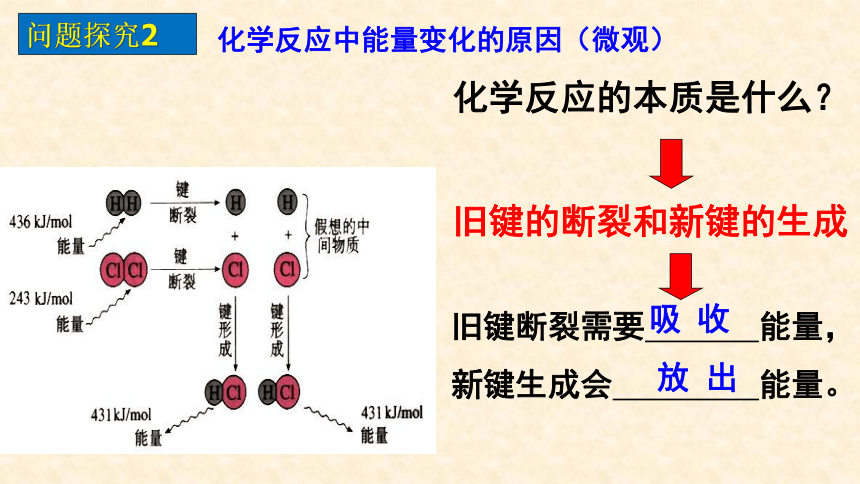
问题探究2
化学反应的本质是什么?
旧键的断裂和新键的生成
旧键断裂需要 能量,
新键生成会 能量。
放 出
吸 收
化学反应中能量变化的原因(微观)
一 、反应热 焓变
1、反应热:
等温条件下,化学反应体系向环境释放或者吸收的热量,称为反应热.
2、焓:
同一物质的不同状态的焓值不同:g l s
3、焓变:
即△H = H(生成物)— H(反应物)
单位:
kJ/mol 或kJ·mol-1
阅读教材
> >
恒压条件下的反应热又称焓变。
与内能有关的物理量 符号:H
生成物与反应物的焓值差 符号:△H
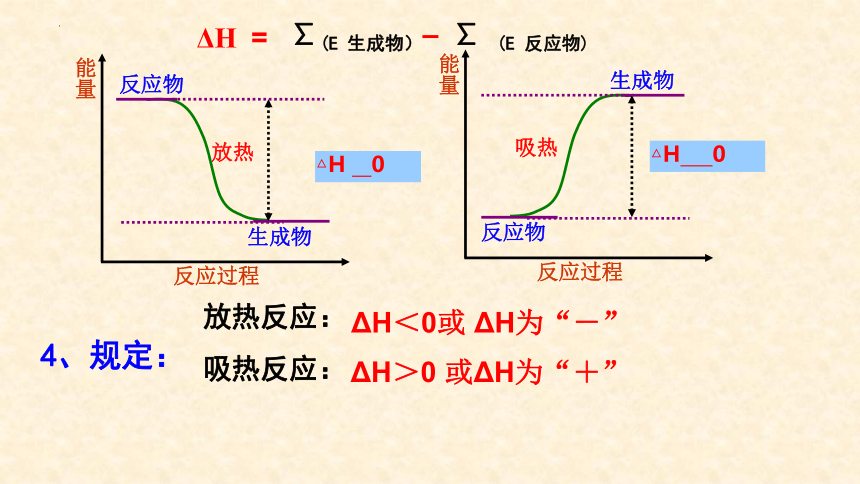
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
放热
反应物
生成物
能量
反应过程
△H 0
吸热
反应物
生成物
能量
反应过程
△H 0
4、规定:
∑(E 生成物)– ∑ (E 反应物)
ΔH =
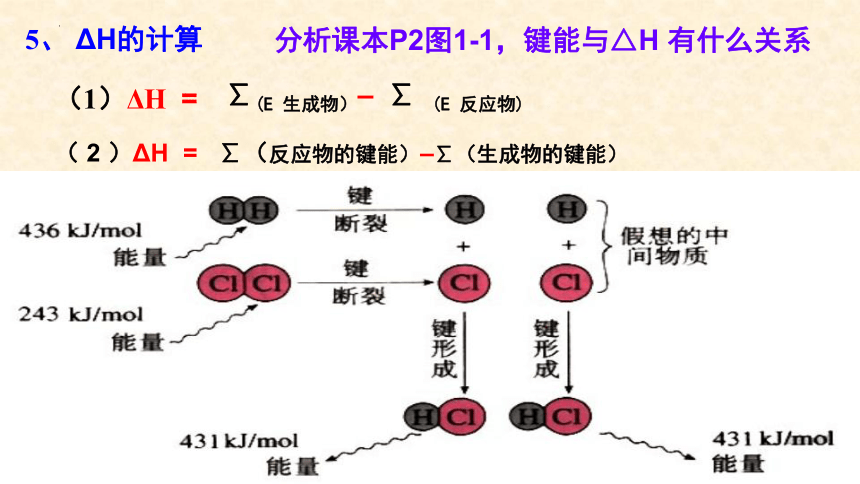
5、 ΔH的计算
( 2 )ΔH = ∑(反应物的键能)–∑(生成物的键能)
分析课本P2图1-1,键能与△H 有什么关系
∑(E 生成物)– ∑ (E 反应物)
(1)ΔH =
二、热化学方程式
什么是热化学方程式?化学方程式相比,热化学方程式有哪些不同?
表示参加反应物质的量和反应热的
关系的化学方程式。
1、定义:
2、含义:
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
3、书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
3、物质后需注明物质状态(s、l、g、aq)
4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量,因此化学计量数可以是整数也可以是分数。
5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
6、 热化学方程式一般不写反应条件。
7、 kJ/mol的含义:每 mol 该系数对应的反应。
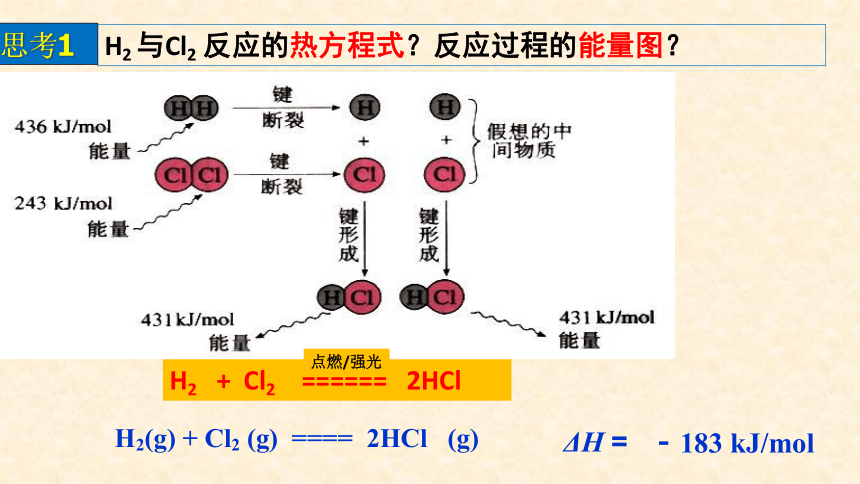
H2(g) + Cl2 (g) ==== 2HCl (g)
ΔH =
-183 kJ/mol
H2 + Cl2 ====== 2HCl
点燃/强光
H2 与Cl2 反应的热方程式?反应过程的能量图?
思考1
已知: H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol
思考2
推测: H2(g)+I2(g) =2HI (s) ΔH - 14.9 kJ/mol
推测: H2(g)+I2(s) =2HI (g) ΔH - 14.9 kJ/mol
推测: 1/2H2(g)+1/2I2(g) =HI (g) ΔH -14.9 kJ/mol
同一物质的不同状态的焓值不同:g l s
> >
1.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
活学活用
答案
解析
热方程式?
化学键 键能/kJ·mol-1
H—H 436
N—H 391
N≡N 946
下列说法正确的是
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
答案
解析
热方程式?
2.工业合成氨的反应为N2(g)+3H2(g)?? 2NH3(g),已知下列化学键的键能:
4.在常温常压下,1 g H2在足量Cl2中燃烧生成HCl气体,放出92.3 kJ 的热量。下列热化学方程式中正确的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=+92.3 kJ·mol-1
C.H2(g)+Cl2(g)===2HCl(g) ΔH=+184.6 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1
答案
解析
方法总结
答案
解析
√
1
2
3
4
5
6
4.下列热化学方程式或叙述正确的是
A.1 mol液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ热量:
N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ热量:
2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1,则
2H2O(l)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D.已知:N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条
件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ
的热量
化学 · 选修 1探究
中和反应的反应热及其测定
复习引入
写热化学方程式
⑴1L1mol/L稀盐酸和1L1mol/LNaOH溶液发生中和反应放出的热量为57.3kJ。
⑵1L1mol/LKOH溶液和1L1mol/L的硝酸发生中和反应放出的热量为57.3kJ。
⑶1L1mol/LH2SO4和2L1mol/LNaOH溶液发生中和反应放出的热量为114.6kJ。
问题导学
1.上述三个反应的反应热之间有何关系?为什么?
2.若是弱酸、弱碱反应,生成1molH2O时的反应热还是57.3kJ/mol吗?
若不是,是偏大还是偏小?
3.若是浓硫酸呢?烧碱固体呢?
HCl(aq)+NaOH (aq)= NaCl (aq) +H2O(l) ΔH=-57.3kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+ H2O(l) ΔH=-57.3kJ/mol
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
在稀溶液中,酸跟碱发生中和反应生成1molH2O的反应热。
①条件:稀溶液,表示符号为aq
②反应物:酸和碱
③生成水的物质的量:1mol
一、中和热
【结论】强酸和强碱生成可溶性盐的中和反应,中和热数值相同。
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
注意:
①条件:稀溶液。
②反应物:中和热不包括物质溶解或电离所伴随的热效应。
③生成1mol水,中和反应的实质是H+和OH-生成 H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④对应强酸强碱,中和热为:- 57.3kJ/mol
哪些药品?
需要哪些仪器?
如何设计实验?
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
二、中和反应反应热的测定
实验用品:
大烧杯(500 mL)
小烧杯(100 mL)
泡沫塑料或纸条
塑料板或硬纸板(两个孔)
温度计(1支)
环形玻璃搅拌棒
量筒(50 mL)两个
药品:
0.50 mol/L 盐酸
0.55 mol/L NaOH溶液
组装量热器
————测量反应前后的温度
和空气绝缘,防止热量损失
——搅拌,使反应液混合均匀
——量取反应液
迅速反应,
减小误差
使一个反应物过量
完全反应,减小误差
(1)组装量热计。注意保温、隔热效果一定要好,该实验也可在保温杯中进行。
(2)用一个量筒量取 50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入表格。然后把温度计上的酸用水冲洗干净。
实验步骤:
(3)用另一个量筒量取 50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入表格。
(4)把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度。
(5)重复实验两次,取测量所得数据的平均值作为计算依据。
实验步骤:
实验
次数
起始温度t1/℃
终止温度
t2/℃
温度差
(t2-t1)/℃
HCl
NaOH
平均值
1
2
3
(6)根据实验数据计算中和热。
实验步骤:
ΔH=-
0.418·(t2-t1)
kJ/mol
0.025
实验原理:
50 mL 0.50 mol/L 盐酸 和50 mL 0.55 mol/L NaOH溶液反应
测量反应放出的热量:
Q = m · c ·Δt = 100g×4.18J/(g ·℃) ×Δt = 0.418Δt kJ
计算生成 1 mol H2O 时的焓变:
ΔH=-
0.418·(t2-t1)
kJ/mol
0.025
近似:酸、碱的密度和比热容与水相同。
判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板( )
②用相同浓度和体积的氨水代替NaOH溶液进行实验 ( )
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验 ( )
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验( )
变小
变小
变小
不变
误差分析
Q
kJ/mol来判断
n(H2O)
根据公式
注意事项:
1.应选用强酸和强碱的稀溶液,不能生成沉淀。
浓——稀释放热,弱——电离吸热,其他反应也有热效应
2.要使用同一支温度计,测完第一种溶液后必须洗净、擦干
3.减少热量损失:动作快,装置绝热好
4.操作规范,读数准确
【练习】实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)在操作正确的前提下,提高中和热测定准确性的关键是______。
(2)做1次完整的中和热测定实验 ,温度计需使用__次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么 ______________________________
保温
3
不同意,因为不同温度计误差不同
温度 实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差平均值
(t2-t1)/ ℃
H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(3)取50mL0.50mol/LNaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
4.0
6.1
3.9
4.1
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=_____________(取小数点后一位)。
计算t2-t1的平均值时删除差别较大的第组数据后再取平均值,
即Δt=
生成的n(H2O)= 0.050L×0.50mol/L=0.025mol
则ΔH== 53.5kJ/mol
53.5kJ/mol
③上述实验结果与57.3kJ/mol(常温下中和热的值)有偏差,产生偏差的原因可能是(填字母)_______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
53.5<57.5,说明算出的结果偏小
a、b和c会导致放出的热量偏小,符合题意
d量取NaOH体积偏大,放出热量偏高,结果偏大,不符合题意
abc
作业
练习册
第一章 化学反应的热效应
第一节 反应热
化学 选修1 化学反应原理
知识回顾
1、化学反应必须遵循的两大守恒
化学反应
能量守恒
质量守恒
2、任何化学反应必定都伴随能量的变化
能量变化
热能
电能
光能
当能量变化以热能的形式表现时:
化学反应
放热反应
吸热反应
2.键能:
H2 与Cl2 反应的方程式?
思考
思考
一个反应放热还是吸热,是否取决于反应条件?
为什么有的反应会放热,有的需要吸热呢?
思考
H2 + Cl2 ====== 2HCl
点燃/强光
问题探究1
放出热量
生成物
图1
反应物
能量
生成物
反应物
能量
图2
吸收热量
结论:
(宏观)取决于反应物的总能量与生成物的总能量的相对大小。
化学反应中能量变化的原因(宏观)
问题探究2
化学反应的本质是什么?
旧键的断裂和新键的生成
旧键断裂需要 能量,
新键生成会 能量。
放 出
吸 收
化学反应中能量变化的原因(微观)
一 、反应热 焓变
1、反应热:
等温条件下,化学反应体系向环境释放或者吸收的热量,称为反应热.
2、焓:
同一物质的不同状态的焓值不同:g l s
3、焓变:
即△H = H(生成物)— H(反应物)
单位:
kJ/mol 或kJ·mol-1
阅读教材
> >
恒压条件下的反应热又称焓变。
与内能有关的物理量 符号:H
生成物与反应物的焓值差 符号:△H
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
放热
反应物
生成物
能量
反应过程
△H 0
吸热
反应物
生成物
能量
反应过程
△H 0
4、规定:
∑(E 生成物)– ∑ (E 反应物)
ΔH =
5、 ΔH的计算
( 2 )ΔH = ∑(反应物的键能)–∑(生成物的键能)
分析课本P2图1-1,键能与△H 有什么关系
∑(E 生成物)– ∑ (E 反应物)
(1)ΔH =
二、热化学方程式
什么是热化学方程式?化学方程式相比,热化学方程式有哪些不同?
表示参加反应物质的量和反应热的
关系的化学方程式。
1、定义:
2、含义:
H2(g) + I2 (g) ==== 2HI(g)
200℃
101kPa
ΔH =
-14.9 kJ/mol
3、书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol
2、需注明反应的温度和压强,如不注明条件,即指: 25℃ 1.01×105Pa;
3、物质后需注明物质状态(s、l、g、aq)
4、热化学方程式中各物质化学式前面的化学计量数仅表示物质的量,因此化学计量数可以是整数也可以是分数。
5、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但绝对值不变
6、 热化学方程式一般不写反应条件。
7、 kJ/mol的含义:每 mol 该系数对应的反应。
H2(g) + Cl2 (g) ==== 2HCl (g)
ΔH =
-183 kJ/mol
H2 + Cl2 ====== 2HCl
点燃/强光
H2 与Cl2 反应的热方程式?反应过程的能量图?
思考1
已知: H2(g)+I2(g) =2HI (g) ΔH=-14.9 kJ/mol
思考2
推测: H2(g)+I2(g) =2HI (s) ΔH - 14.9 kJ/mol
推测: H2(g)+I2(s) =2HI (g) ΔH - 14.9 kJ/mol
推测: 1/2H2(g)+1/2I2(g) =HI (g) ΔH -14.9 kJ/mol
同一物质的不同状态的焓值不同:g l s
> >
1.化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
A.每生成2 mol AB(g)吸收b kJ热量
B.反应热ΔH=+(a-b) kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
活学活用
答案
解析
热方程式?
化学键 键能/kJ·mol-1
H—H 436
N—H 391
N≡N 946
下列说法正确的是
A.该反应为吸热反应
B.该反应中反应物的总能量高于生成物的总能量
C.反应热ΔH=92 kJ·mol-1
D.生成1 mol NH3放出92 kJ热量
答案
解析
热方程式?
2.工业合成氨的反应为N2(g)+3H2(g)?? 2NH3(g),已知下列化学键的键能:
4.在常温常压下,1 g H2在足量Cl2中燃烧生成HCl气体,放出92.3 kJ 的热量。下列热化学方程式中正确的是
A.H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=+92.3 kJ·mol-1
C.H2(g)+Cl2(g)===2HCl(g) ΔH=+184.6 kJ·mol-1
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+184.6 kJ·mol-1
答案
解析
方法总结
答案
解析
√
1
2
3
4
5
6
4.下列热化学方程式或叙述正确的是
A.1 mol液态肼(N2H4)在足量氧气中完全燃烧生成水蒸气,放出642 kJ热量:
N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B.12 g石墨转化为CO时,放出110.5 kJ热量:
2C(石墨,s)+O2(g)===2CO(g) ΔH=-110.5 kJ·mol-1
C.已知:H2(g)+ O2(g)===H2O(l) ΔH=-286 kJ·mol-1,则
2H2O(l)===2H2(g)+O2(g) ΔH=+572 kJ·mol-1
D.已知:N2(g)+3H2(g)??2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条
件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ
的热量
化学 · 选修 1探究
中和反应的反应热及其测定
复习引入
写热化学方程式
⑴1L1mol/L稀盐酸和1L1mol/LNaOH溶液发生中和反应放出的热量为57.3kJ。
⑵1L1mol/LKOH溶液和1L1mol/L的硝酸发生中和反应放出的热量为57.3kJ。
⑶1L1mol/LH2SO4和2L1mol/LNaOH溶液发生中和反应放出的热量为114.6kJ。
问题导学
1.上述三个反应的反应热之间有何关系?为什么?
2.若是弱酸、弱碱反应,生成1molH2O时的反应热还是57.3kJ/mol吗?
若不是,是偏大还是偏小?
3.若是浓硫酸呢?烧碱固体呢?
HCl(aq)+NaOH (aq)= NaCl (aq) +H2O(l) ΔH=-57.3kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+ H2O(l) ΔH=-57.3kJ/mol
H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
在稀溶液中,酸跟碱发生中和反应生成1molH2O的反应热。
①条件:稀溶液,表示符号为aq
②反应物:酸和碱
③生成水的物质的量:1mol
一、中和热
【结论】强酸和强碱生成可溶性盐的中和反应,中和热数值相同。
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
注意:
①条件:稀溶液。
②反应物:中和热不包括物质溶解或电离所伴随的热效应。
③生成1mol水,中和反应的实质是H+和OH-生成 H2O,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
④对应强酸强碱,中和热为:- 57.3kJ/mol
哪些药品?
需要哪些仪器?
如何设计实验?
H+(aq)+OH-(aq)=H2O(l) ΔH =-57.3kJ/mol
二、中和反应反应热的测定
实验用品:
大烧杯(500 mL)
小烧杯(100 mL)
泡沫塑料或纸条
塑料板或硬纸板(两个孔)
温度计(1支)
环形玻璃搅拌棒
量筒(50 mL)两个
药品:
0.50 mol/L 盐酸
0.55 mol/L NaOH溶液
组装量热器
————测量反应前后的温度
和空气绝缘,防止热量损失
——搅拌,使反应液混合均匀
——量取反应液
迅速反应,
减小误差
使一个反应物过量
完全反应,减小误差
(1)组装量热计。注意保温、隔热效果一定要好,该实验也可在保温杯中进行。
(2)用一个量筒量取 50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入表格。然后把温度计上的酸用水冲洗干净。
实验步骤:
(3)用另一个量筒量取 50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入表格。
(4)把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度。
(5)重复实验两次,取测量所得数据的平均值作为计算依据。
实验步骤:
实验
次数
起始温度t1/℃
终止温度
t2/℃
温度差
(t2-t1)/℃
HCl
NaOH
平均值
1
2
3
(6)根据实验数据计算中和热。
实验步骤:
ΔH=-
0.418·(t2-t1)
kJ/mol
0.025
实验原理:
50 mL 0.50 mol/L 盐酸 和50 mL 0.55 mol/L NaOH溶液反应
测量反应放出的热量:
Q = m · c ·Δt = 100g×4.18J/(g ·℃) ×Δt = 0.418Δt kJ
计算生成 1 mol H2O 时的焓变:
ΔH=-
0.418·(t2-t1)
kJ/mol
0.025
近似:酸、碱的密度和比热容与水相同。
判断下列实验操作对中和热测定的数值有如何影响?填变大变小或者不变。
①大烧杯上没有盖硬纸板( )
②用相同浓度和体积的氨水代替NaOH溶液进行实验 ( )
③用相同浓度和体积的醋酸代替稀盐酸溶液 进行实验 ( )
④实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行实验( )
变小
变小
变小
不变
误差分析
Q
kJ/mol来判断
n(H2O)
根据公式
注意事项:
1.应选用强酸和强碱的稀溶液,不能生成沉淀。
浓——稀释放热,弱——电离吸热,其他反应也有热效应
2.要使用同一支温度计,测完第一种溶液后必须洗净、擦干
3.减少热量损失:动作快,装置绝热好
4.操作规范,读数准确
【练习】实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)在操作正确的前提下,提高中和热测定准确性的关键是______。
(2)做1次完整的中和热测定实验 ,温度计需使用__次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么 ______________________________
保温
3
不同意,因为不同温度计误差不同
温度 实验次数 起始温度t1/℃ 终止温度 t2/℃ 温度差平均值
(t2-t1)/ ℃
H2SO4 NaOH 平均值 1 26.2 26.0 26.1 30.1
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
(3)取50mL0.50mol/LNaOH溶液和30mL0.50mol/L硫酸溶液进行实验,实验数据如表所示。
①请填写表中的空白:
4.0
6.1
3.9
4.1
②近似认为0.5mol/LNaOH溶液和0.5mol/L硫酸溶液的密度都是1g/mL,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热ΔH=_____________(取小数点后一位)。
计算t2-t1的平均值时删除差别较大的第组数据后再取平均值,
即Δt=
生成的n(H2O)= 0.050L×0.50mol/L=0.025mol
则ΔH== 53.5kJ/mol
53.5kJ/mol
③上述实验结果与57.3kJ/mol(常温下中和热的值)有偏差,产生偏差的原因可能是(填字母)_______。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯
d.用量筒量取NaOH溶液的体积时仰视读数
53.5<57.5,说明算出的结果偏小
a、b和c会导致放出的热量偏小,符合题意
d量取NaOH体积偏大,放出热量偏高,结果偏大,不符合题意
abc
作业
练习册
