化学人教版(2019)必修第一册2.3物质的量(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3物质的量(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-26 19:03:47 | ||
图片预览









文档简介
(共34张PPT)
物质的量
情境导入
新知教学
“打包”
化为一个集合体
情境导入
新知教学
情境导入
新知教学
14亿人每人每秒数一个
一滴水中,有约1.67×1021个水分子
“打包”
微粒
“打包”
一堆
符号: n
单位:摩尔 (mol) ,简称摩
范围:所有微观粒子
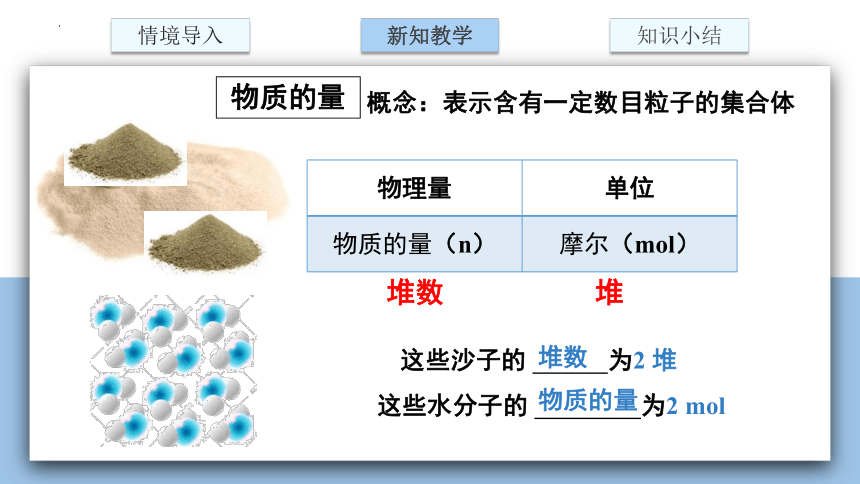
概念:表示含有一定数目粒子的集合体
物质的量
物理量 单位
物质的量(n) 摩尔(mol)
堆数 堆
这些水分子的 为2 mol
物质的量
这些沙子的 为2 堆
堆数
概念:表示含有一定数目粒子的集合体
物质的量
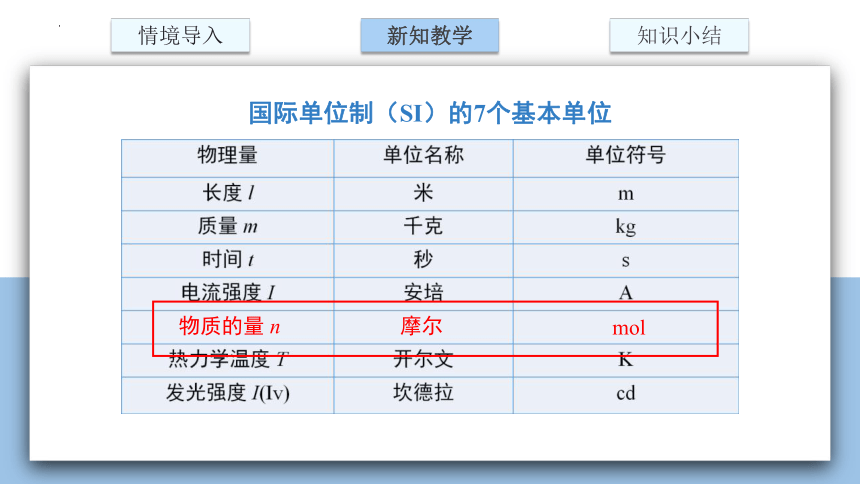
国际单位制(SI)的7个基本单位
物质的量 n
摩尔
mol
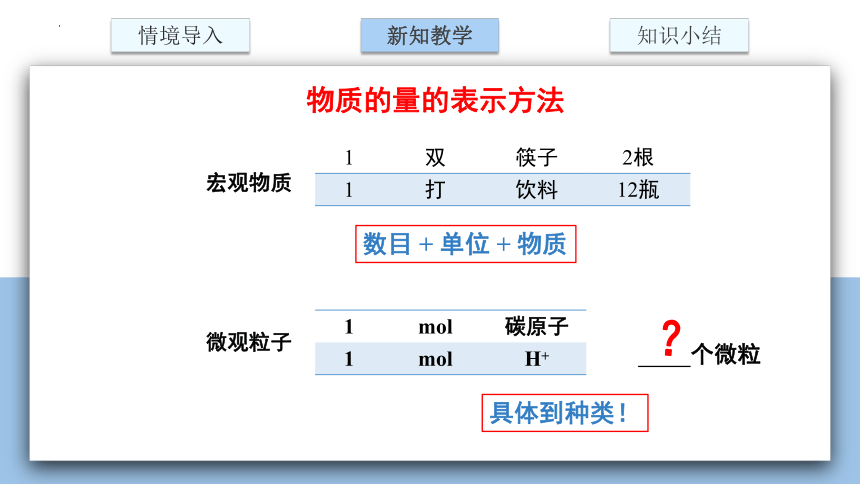
物质的量的表示方法
宏观物质
1 双 筷子
1 打 饮料
数目 + 单位 + 物质
微观粒子
1 mol 碳原子
1 mol H+
具体到种类!
2根
12瓶
个微粒
?
让佩兰
提出将1mol粒子集合体所含粒子数为:
阿伏伽德罗常数NA
1 mol微粒的“打包标准”
国际iupac
提出1 mol粒子集合体所含粒子数约为:
6.02×1023个
阿伏伽德罗常数
符号:NA
概念:1mol任何微粒中所含的微粒数
单位:mol-1
精确值
1mol微粒 = 1NA个
近似值
≈6.02×1023个
假如现有 6.02×1023 块钱,
分给全国14亿人花,
每人每天花一百万,
可以花118万年!
感知NA
物质的量只适用于描述微观粒子,不能描述宏观物质!
6.02 1023 到底有多大?
新知教学
知识小结
物质的量
符号: n
单位:摩尔 (mol)
概念:含有一定数目粒子的集合体
1 mol 微粒 = 1NA个 ≈ 6.021023个
概念:1mol任何微粒中所含的微粒数
“物质的量”专有名词
描述微观粒子
具体到粒子种类
专有化
微观化
具体化
阿伏伽德罗常数
新知教学
知识小结
请同学们思考如何求一个硅原子的质量?
并预习“摩尔质量”的定义。
单晶硅(宏观)
可称量,不可计数
硅原子 (微观)
可计数,不可称量
?
物质的量
人教版高中化学必修第一册第二章第三节
第2课时
1
2
学
习
目
标
掌握气体摩尔体积的概念,理解物质的量、物质的质量、气体摩尔体积之间的相互关系,能进行它们之间的简单计算,熟练掌握22.4 L·mol-1的应用。
掌握摩尔质量的概念,理解物质的量、物质的质量、摩尔质量之间的相互关系,能进行它们之间的简单计算。
分享“1 mol H2O”的含义
同学A: 水分子的物质的量为1 mol;
同学B: 1 mol H2O所含的分子数约为6.02×1023个;
同学C: 1 mol H2O中所含的氢原子数约为1.204×1024个;
同学D: 1 mol H2O中所含的氧原子数约为6.02×1023个;
同学E: 1 mol H2O中含有2 mol氢原子,1 mol氧原子
……
思考:1 mol H2O的有多少克?
温习旧知
物质的量为1 mol的几种物质
n和M的计量关系
1
一、摩尔质量
1. 定义:单位物质的量的物质所具有的质量。
2. 符号:M。
3. 单位: g mol-1或g/mol。
4. 数值:l mol任何粒子或物质的摩尔质量以g/mol为单位时,其数值等于该粒子的相对原子(分子)质量。
任务一 建立以物质的量为中心的计量体系:n和M的关系
意义不同,单位不同。两者仅数值相等。(前提:M以g/mol为单位)
摩尔质量和相对原子(分子)质量是否相同?
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
1 mol H2O的质量为18克。
微观
宏观
物质的量(n)
质量(m)
粒子数(N)
归纳总结——物质的量与质量之间的关系
物质的量
n(mol)
质量
m(g)
(g/mol)
n =
M
m
×M
÷M
(g/mol)
2
n和Vm的计量关系
图1 水在不同聚集状态的微观结构
固体
液体
气体
任务二 建立以物质的量为中心的计量体系:n和Vm的关系
任务二 建立以物质的量为中心的计量体系:n和Vm的关系
思考:物质的体积大小取决于什么?
温度、压强
因素 状态 粒子大小 粒子间距离
固体和液体
气体
当粒子数目(1mol)相同时:
主要因素
忽略
主要因素
忽略
气体粒子间的距离是固定不变的吗?
下表为1mol气体在00C、1.01×105Pa下的体积,观察并分析表中的数据,你能得到什么结论?
名称 状态 密 度(g/L) 质量(g) 体积(L)
H2 气体 0.0893
O2 气体 1.429
CO2 气体 1.965
N2 气体 1.25
2
22.4
32
22.39
44
22.39
28
22.4
结论:
00C、1.01×105Pa下,1mol任何气体的体积均约是22.4L
二、气体摩尔体积
1. 定义:单位物质的量的气体所占有的体积,叫做气体摩尔体积。
2. 符号:Vm
3. 单位:L·mol-1(或L/mol)
4. 数值:在标准状况(温度为0℃,压强为101 kPa)下,气体摩尔体积为22.4L/mol
5. 使用时的注意事项:
(1)条件:必须为标准状况,务必看清气体所处温度和压强。
(2)物质状态:在标准状况下该物质必须为气态,如水,乙醇标况下为液态。
(3)数值:22.4L/mol是近似值。
n V(气体,标况下)
1 mol
0.2 mol 3.36 L
22.4 L
0.15 mol
4.48 L
计算不同物质的量的气体所占的体积,找出n和Vm之间的关系。
6. n和Vm的关系:V=n·Vm
课堂小结
×M
× NA
×Vm
(只适用于气体)
评价任务
√
√
1.10月23日的6:02被誉为“摩尔日”,这个时间的美式写法为6:0210/23,与6.02×1023相似。通常用NA表示阿伏加德罗常数的值,下列叙述正确的是A.在标准状况下,25mLO2和10mLNH3所含原子个数比为5∶4B.标准状况下,22.4 L 中含有分子数为NAC.22.4LN2中含有N数目为一定为2NAD.20gD2O在标准状况下的体积约为22.4L
2.为阿伏加德罗常数的值,下列说法正确的是
A.Fe的摩尔质量是56
B.的体积约为22.4L
C.28g氮气中含有的原子数为
D.溶液中,含有的数约为
物质的量
情境导入
新知教学
“打包”
化为一个集合体
情境导入
新知教学
情境导入
新知教学
14亿人每人每秒数一个
一滴水中,有约1.67×1021个水分子
“打包”
微粒
“打包”
一堆
符号: n
单位:摩尔 (mol) ,简称摩
范围:所有微观粒子
概念:表示含有一定数目粒子的集合体
物质的量
物理量 单位
物质的量(n) 摩尔(mol)
堆数 堆
这些水分子的 为2 mol
物质的量
这些沙子的 为2 堆
堆数
概念:表示含有一定数目粒子的集合体
物质的量
国际单位制(SI)的7个基本单位
物质的量 n
摩尔
mol
物质的量的表示方法
宏观物质
1 双 筷子
1 打 饮料
数目 + 单位 + 物质
微观粒子
1 mol 碳原子
1 mol H+
具体到种类!
2根
12瓶
个微粒
?
让佩兰
提出将1mol粒子集合体所含粒子数为:
阿伏伽德罗常数NA
1 mol微粒的“打包标准”
国际iupac
提出1 mol粒子集合体所含粒子数约为:
6.02×1023个
阿伏伽德罗常数
符号:NA
概念:1mol任何微粒中所含的微粒数
单位:mol-1
精确值
1mol微粒 = 1NA个
近似值
≈6.02×1023个
假如现有 6.02×1023 块钱,
分给全国14亿人花,
每人每天花一百万,
可以花118万年!
感知NA
物质的量只适用于描述微观粒子,不能描述宏观物质!
6.02 1023 到底有多大?
新知教学
知识小结
物质的量
符号: n
单位:摩尔 (mol)
概念:含有一定数目粒子的集合体
1 mol 微粒 = 1NA个 ≈ 6.021023个
概念:1mol任何微粒中所含的微粒数
“物质的量”专有名词
描述微观粒子
具体到粒子种类
专有化
微观化
具体化
阿伏伽德罗常数
新知教学
知识小结
请同学们思考如何求一个硅原子的质量?
并预习“摩尔质量”的定义。
单晶硅(宏观)
可称量,不可计数
硅原子 (微观)
可计数,不可称量
?
物质的量
人教版高中化学必修第一册第二章第三节
第2课时
1
2
学
习
目
标
掌握气体摩尔体积的概念,理解物质的量、物质的质量、气体摩尔体积之间的相互关系,能进行它们之间的简单计算,熟练掌握22.4 L·mol-1的应用。
掌握摩尔质量的概念,理解物质的量、物质的质量、摩尔质量之间的相互关系,能进行它们之间的简单计算。
分享“1 mol H2O”的含义
同学A: 水分子的物质的量为1 mol;
同学B: 1 mol H2O所含的分子数约为6.02×1023个;
同学C: 1 mol H2O中所含的氢原子数约为1.204×1024个;
同学D: 1 mol H2O中所含的氧原子数约为6.02×1023个;
同学E: 1 mol H2O中含有2 mol氢原子,1 mol氧原子
……
思考:1 mol H2O的有多少克?
温习旧知
物质的量为1 mol的几种物质
n和M的计量关系
1
一、摩尔质量
1. 定义:单位物质的量的物质所具有的质量。
2. 符号:M。
3. 单位: g mol-1或g/mol。
4. 数值:l mol任何粒子或物质的摩尔质量以g/mol为单位时,其数值等于该粒子的相对原子(分子)质量。
任务一 建立以物质的量为中心的计量体系:n和M的关系
意义不同,单位不同。两者仅数值相等。(前提:M以g/mol为单位)
摩尔质量和相对原子(分子)质量是否相同?
1 mol H2O
6.02×1023个水分子
1.204×1024个氢原子
6.02×1023个氧原子
2 mol氢原子和1 mol氧原子
1 mol水分子
1个水分子中
有2个氢原子1个氧原子
18 g H2O
×18 g/mol
1 mol H2O的质量为18克。
微观
宏观
物质的量(n)
质量(m)
粒子数(N)
归纳总结——物质的量与质量之间的关系
物质的量
n(mol)
质量
m(g)
(g/mol)
n =
M
m
×M
÷M
(g/mol)
2
n和Vm的计量关系
图1 水在不同聚集状态的微观结构
固体
液体
气体
任务二 建立以物质的量为中心的计量体系:n和Vm的关系
任务二 建立以物质的量为中心的计量体系:n和Vm的关系
思考:物质的体积大小取决于什么?
温度、压强
因素 状态 粒子大小 粒子间距离
固体和液体
气体
当粒子数目(1mol)相同时:
主要因素
忽略
主要因素
忽略
气体粒子间的距离是固定不变的吗?
下表为1mol气体在00C、1.01×105Pa下的体积,观察并分析表中的数据,你能得到什么结论?
名称 状态 密 度(g/L) 质量(g) 体积(L)
H2 气体 0.0893
O2 气体 1.429
CO2 气体 1.965
N2 气体 1.25
2
22.4
32
22.39
44
22.39
28
22.4
结论:
00C、1.01×105Pa下,1mol任何气体的体积均约是22.4L
二、气体摩尔体积
1. 定义:单位物质的量的气体所占有的体积,叫做气体摩尔体积。
2. 符号:Vm
3. 单位:L·mol-1(或L/mol)
4. 数值:在标准状况(温度为0℃,压强为101 kPa)下,气体摩尔体积为22.4L/mol
5. 使用时的注意事项:
(1)条件:必须为标准状况,务必看清气体所处温度和压强。
(2)物质状态:在标准状况下该物质必须为气态,如水,乙醇标况下为液态。
(3)数值:22.4L/mol是近似值。
n V(气体,标况下)
1 mol
0.2 mol 3.36 L
22.4 L
0.15 mol
4.48 L
计算不同物质的量的气体所占的体积,找出n和Vm之间的关系。
6. n和Vm的关系:V=n·Vm
课堂小结
×M
× NA
×Vm
(只适用于气体)
评价任务
√
√
1.10月23日的6:02被誉为“摩尔日”,这个时间的美式写法为6:0210/23,与6.02×1023相似。通常用NA表示阿伏加德罗常数的值,下列叙述正确的是A.在标准状况下,25mLO2和10mLNH3所含原子个数比为5∶4B.标准状况下,22.4 L 中含有分子数为NAC.22.4LN2中含有N数目为一定为2NAD.20gD2O在标准状况下的体积约为22.4L
2.为阿伏加德罗常数的值,下列说法正确的是
A.Fe的摩尔质量是56
B.的体积约为22.4L
C.28g氮气中含有的原子数为
D.溶液中,含有的数约为
