1.3.2氧化剂和还原剂 课件(共36张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 1.3.2氧化剂和还原剂 课件(共36张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:05:38 | ||
图片预览








文档简介
(共36张PPT)
第三节 氧化还原反应
第三课时
氧化剂和还原剂
第一章 物质及其变化
00
学习目标
一
二
三
会判断常见的氧化剂和还原剂,会比较物质氧化性和还原性的强弱。
认识氧化还原反应的实际应用。
通过对“氧化剂和还原剂”的学习,培养证据推理与模型认知能力。
01
氧化剂和还原剂
氧化剂和还原剂
01
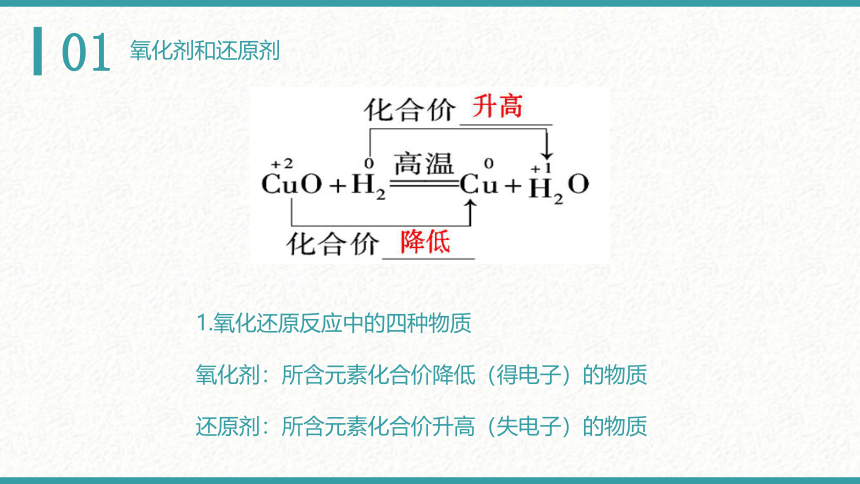
1.氧化还原反应中的四种物质
氧化剂:所含元素化合价降低(得电子)的物质
还原剂:所含元素化合价升高(失电子)的物质
氧化剂和还原剂
01
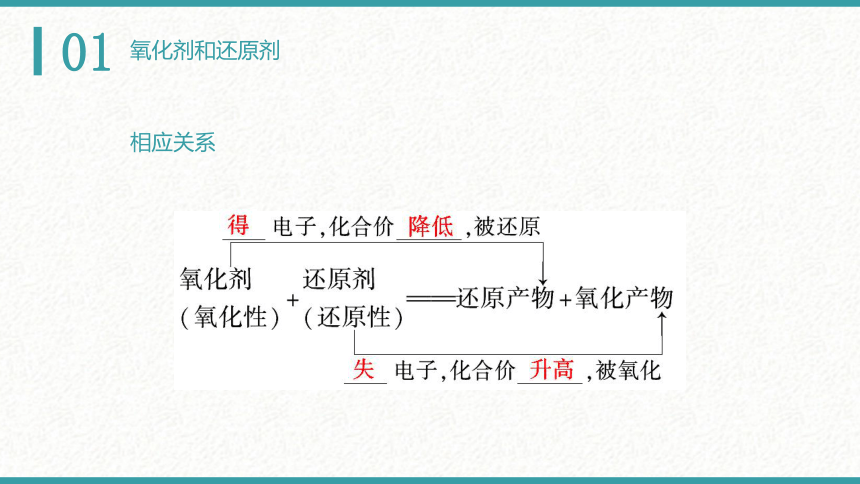
氧化产物:还原剂失电子(被氧化)后的生成物
还原产物:氧化剂得电子(被还原)后的生成物
2.两种性质
氧化性:得电子的性质(氧化剂的性质)
还原性:失电子的性质(还原剂的性质)
氧化剂和还原剂
01
相应关系
氧化剂和还原剂
01
思考与交流
金属原子失去电子的数目越多,其还原性越强吗?
非金属原子得到电子的数目越多,其氧化性越强吗?
氧化性、还原性只与原子得、失电子的难易程度有关,而与得、失电
子数目的多少无关。
金属原子失电子能力越强,其还原性就越强,如Na>Al;
非金属原子得电子能力越强,其氧化性就越强,如Cl>S。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的氧化剂
a.某些非金属单质,如O2、Cl2、Br2等;
b.某些含氧酸:浓硫酸、HNO3、HClO等;
c.含高价金属的盐:KMnO4、FeCl3等。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(2)常见的还原剂
a.活泼金属单质,如Al、Zn、Fe等;
b.某些非金属单质:C、H2等;
c.含低价元素的化合物:CO、H2S、Fe2+等。
氧化还原反应的规律
02
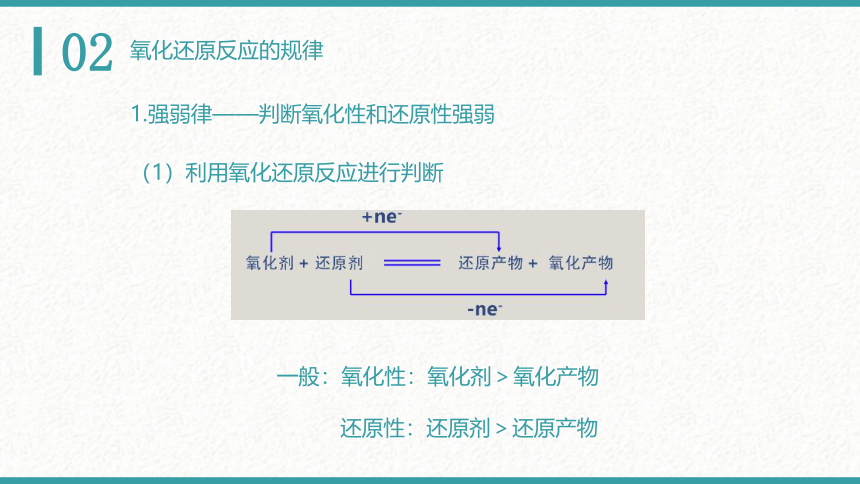
1.强弱律——判断氧化性和还原性强弱
(1)利用氧化还原反应进行判断
一般:氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化还原反应的规律
02
(2)根据金属活动性顺序进行判断
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H+)Cu2+ Hg+ Ag+
得电子能力逐渐增强,氧化性逐渐增强
氧化还原反应的规律
02
(3)根据氧化还原反应进行的难易程度(反应条件)的不同进行判断
同种氧化剂和不同的还原剂反应,易发生反应的还原剂的还原性强;
同种还原剂和不同的氧化剂反应,易发生反应的氧化剂的氧化性强。
例如:
前者比后者容易,可判断氧化性:
KMnO4>MnO2
氧化还原反应的规律
02
2.价态律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;
元素处于中间价态,既有氧化性又有还原性,但主要呈现一张
性质。
氧化还原反应的规律
02
3.转化律——只适用于一种元素发生发生化合价改变的反应
同种元素不同价态之间发生反应,元素的化合价只靠近
而不交叉;
同种元素相邻价态之间不发生氧化还原反应。
氧化还原反应的规律
02
4.守恒律
氧化还原反应中还原剂失去的电子总数一定和氧化剂得到
电子总数相等。一般应用于有关计算。
归纳总结
03
归纳总结
03
氧化还原反应方程式的配平
(1)配平原则
①得失电子守恒:氧化剂和还原剂得失电子总数相等,表现为化合价升降总数相等。
②质量守恒:反应前后原子的种类和个数不变。
③电荷守恒:反应前后离子所带电荷总数相等,主要针对离子方程式。
归纳总结
03
(2)配平步骤(以C与HNO3反应为例)
归纳总结
03
(3)氧化还原离子方程式的配平
氧化还原离子方程式的配平与其化学方程式的配平基本原理相同,都遵循得失电子守恒,但由于阴阳离子的存在,氧化还原离子方程式还要遵循电荷守恒。
归纳总结
03
归纳总结
03
氧化还原反应的计算
(1)计算方法
在任何氧化还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
(2)计算步骤
①找出氧化剂、还原剂及相应的还原产物和氧化产物。
②找准一个原子或离子得失电子数(注意化学式中粒子的个数)。
③根据题中物质的系数和得失电子守恒列出等式。氧化剂系数×变价原子个数×化合价变化值(高价-低价)=还原剂系数×变价原子个数×化合价变化值(高价-低价)。
随堂训练
04
下列关于氧化还原反应的叙述,正确的是 ( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.作氧化剂的物质不能是还原剂
B
随堂训练
04
2.在含有Cu(NO2)、Mg(NO3)、AgNO3的溶液中加入适量锌粉,首先置换出的是 ( )
A.Mg B.Cu
C.Ag D.H2
C
随堂训练
04
3.单宁是葡萄酒中所含有的两种酚类化合物其中的一种物质,单宁有独特的抗氧化性,能有效抵御生物氧化作用,它还有清除活性氧的功能。
随堂训练
04
3.下列对于单宁在保护葡萄酒过程中的有关说法中,正确的是( )
A.单宁作还原剂
B.单宁作氧化剂
C.单宁被还原
D.单宁中某元素化合价降低
A
随堂训练
04
D
随堂训练
04
5.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为__________。
AsH3
Br2
随堂训练
04
(3)根据上述反应可推知__________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
a、c
随堂训练
04
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
______________________________
随堂训练
04
6.从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,__________的还原性最强,在Cu2+、Fe2+、Ag+中,__________的氧化性最强。
(2)铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中,__________具有氧化性,__________的氧化性更强。
Fe
Ag+
Cl2、H+
Cl2
随堂训练
04
7.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 ( )
A.2?3 B.3?2
C.4?5 D.5?6
A
随堂训练
04
D
随堂训练
04
9.针对二氧化硫的以下反应说法不正确的是 ( )
①SO2+2NaOH===Na2SO3+H2O ②SO2+2H2S===3S↓+2H2O
③SO2+Cl2+2H2O===H2SO+2HCl
A.①反应由于元素的化合价没有发生变化,因此该反应不是氧化还原反应
B.②反应中二氧化硫作氧化剂
C.②中氧化产物和还原产物的质量之比为2?1
D.③中二氧化硫作氧化剂
D
随堂训练
04
B
随堂训练
04
B
感谢观看
THANK YOU
第三节 氧化还原反应
第三课时
氧化剂和还原剂
第一章 物质及其变化
00
学习目标
一
二
三
会判断常见的氧化剂和还原剂,会比较物质氧化性和还原性的强弱。
认识氧化还原反应的实际应用。
通过对“氧化剂和还原剂”的学习,培养证据推理与模型认知能力。
01
氧化剂和还原剂
氧化剂和还原剂
01
1.氧化还原反应中的四种物质
氧化剂:所含元素化合价降低(得电子)的物质
还原剂:所含元素化合价升高(失电子)的物质
氧化剂和还原剂
01
氧化产物:还原剂失电子(被氧化)后的生成物
还原产物:氧化剂得电子(被还原)后的生成物
2.两种性质
氧化性:得电子的性质(氧化剂的性质)
还原性:失电子的性质(还原剂的性质)
氧化剂和还原剂
01
相应关系
氧化剂和还原剂
01
思考与交流
金属原子失去电子的数目越多,其还原性越强吗?
非金属原子得到电子的数目越多,其氧化性越强吗?
氧化性、还原性只与原子得、失电子的难易程度有关,而与得、失电
子数目的多少无关。
金属原子失电子能力越强,其还原性就越强,如Na>Al;
非金属原子得电子能力越强,其氧化性就越强,如Cl>S。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(1)常见的氧化剂
a.某些非金属单质,如O2、Cl2、Br2等;
b.某些含氧酸:浓硫酸、HNO3、HClO等;
c.含高价金属的盐:KMnO4、FeCl3等。
氧化剂和还原剂
01
3.常见的氧化剂和还原剂
(2)常见的还原剂
a.活泼金属单质,如Al、Zn、Fe等;
b.某些非金属单质:C、H2等;
c.含低价元素的化合物:CO、H2S、Fe2+等。
氧化还原反应的规律
02
1.强弱律——判断氧化性和还原性强弱
(1)利用氧化还原反应进行判断
一般:氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
氧化还原反应的规律
02
(2)根据金属活动性顺序进行判断
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
失电子能力逐渐减弱,还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+(H+)Cu2+ Hg+ Ag+
得电子能力逐渐增强,氧化性逐渐增强
氧化还原反应的规律
02
(3)根据氧化还原反应进行的难易程度(反应条件)的不同进行判断
同种氧化剂和不同的还原剂反应,易发生反应的还原剂的还原性强;
同种还原剂和不同的氧化剂反应,易发生反应的氧化剂的氧化性强。
例如:
前者比后者容易,可判断氧化性:
KMnO4>MnO2
氧化还原反应的规律
02
2.价态律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;
元素处于中间价态,既有氧化性又有还原性,但主要呈现一张
性质。
氧化还原反应的规律
02
3.转化律——只适用于一种元素发生发生化合价改变的反应
同种元素不同价态之间发生反应,元素的化合价只靠近
而不交叉;
同种元素相邻价态之间不发生氧化还原反应。
氧化还原反应的规律
02
4.守恒律
氧化还原反应中还原剂失去的电子总数一定和氧化剂得到
电子总数相等。一般应用于有关计算。
归纳总结
03
归纳总结
03
氧化还原反应方程式的配平
(1)配平原则
①得失电子守恒:氧化剂和还原剂得失电子总数相等,表现为化合价升降总数相等。
②质量守恒:反应前后原子的种类和个数不变。
③电荷守恒:反应前后离子所带电荷总数相等,主要针对离子方程式。
归纳总结
03
(2)配平步骤(以C与HNO3反应为例)
归纳总结
03
(3)氧化还原离子方程式的配平
氧化还原离子方程式的配平与其化学方程式的配平基本原理相同,都遵循得失电子守恒,但由于阴阳离子的存在,氧化还原离子方程式还要遵循电荷守恒。
归纳总结
03
归纳总结
03
氧化还原反应的计算
(1)计算方法
在任何氧化还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
(2)计算步骤
①找出氧化剂、还原剂及相应的还原产物和氧化产物。
②找准一个原子或离子得失电子数(注意化学式中粒子的个数)。
③根据题中物质的系数和得失电子守恒列出等式。氧化剂系数×变价原子个数×化合价变化值(高价-低价)=还原剂系数×变价原子个数×化合价变化值(高价-低价)。
随堂训练
04
下列关于氧化还原反应的叙述,正确的是 ( )
A.失去电子的反应是还原反应
B.失去电子的物质是还原剂
C.发生氧化反应的物质是氧化剂
D.作氧化剂的物质不能是还原剂
B
随堂训练
04
2.在含有Cu(NO2)、Mg(NO3)、AgNO3的溶液中加入适量锌粉,首先置换出的是 ( )
A.Mg B.Cu
C.Ag D.H2
C
随堂训练
04
3.单宁是葡萄酒中所含有的两种酚类化合物其中的一种物质,单宁有独特的抗氧化性,能有效抵御生物氧化作用,它还有清除活性氧的功能。
随堂训练
04
3.下列对于单宁在保护葡萄酒过程中的有关说法中,正确的是( )
A.单宁作还原剂
B.单宁作氧化剂
C.单宁被还原
D.单宁中某元素化合价降低
A
随堂训练
04
D
随堂训练
04
5.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为__________。
AsH3
Br2
随堂训练
04
(3)根据上述反应可推知__________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
a、c
随堂训练
04
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:
______________________________
随堂训练
04
6.从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
(1)铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,__________的还原性最强,在Cu2+、Fe2+、Ag+中,__________的氧化性最强。
(2)铁钉在氯气中被锈蚀为棕褐色物质(FeCl3),而在盐酸中生成淡绿色溶液(FeCl2)。则在氯气分子(Cl2)、氯离子、氢离子中,__________具有氧化性,__________的氧化性更强。
Fe
Ag+
Cl2、H+
Cl2
随堂训练
04
7.一定条件下,氨气与一氧化氮发生反应:NH3+NO→N2+H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 ( )
A.2?3 B.3?2
C.4?5 D.5?6
A
随堂训练
04
D
随堂训练
04
9.针对二氧化硫的以下反应说法不正确的是 ( )
①SO2+2NaOH===Na2SO3+H2O ②SO2+2H2S===3S↓+2H2O
③SO2+Cl2+2H2O===H2SO+2HCl
A.①反应由于元素的化合价没有发生变化,因此该反应不是氧化还原反应
B.②反应中二氧化硫作氧化剂
C.②中氧化产物和还原产物的质量之比为2?1
D.③中二氧化硫作氧化剂
D
随堂训练
04
B
随堂训练
04
B
感谢观看
THANK YOU
