2.1.1活泼的金属单质—钠 课件(共39张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 2.1.1活泼的金属单质—钠 课件(共39张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:06:47 | ||
图片预览








文档简介
(共39张PPT)
第二章 海水中的重要元素
第一节 钠及其化合物
第一课时 活泼的金属单质——钠
目录
Contents
02.钠的原子结构与化学性质
01.钠的存在与物理性质
01
钠的存在与物理性质
钠的存在与物理性质
01
1、存在:
(1)已发现的100多种元素中,大约4/5是金属元素;
(2)形式:
化合态:活泼金属
游离态:极少数不活泼的金属(Ag、Au、Cu、Pt等)
2、钠元素在自然界都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
钠的存在与物理性质
01
3、钠的物理性质:
钠为银白色固体,密度为0.917g·cm-3,比水的密度小;熔点较低,硬度
小,用小刀可以切割。
02
钠的原子结构与化学性质
02
钠的原子结构与化学性质
钠原子的结构示意图为 ,最外层只有1个电子,在化学反应中容易失电子,表现很强的还原性。
1.钠与非金属单质反应:
(1)钠与氧气的反应
新切开的钠具有银白色的金属光泽,在空气中很快变暗。将钠块投入热坩埚中,钠先融化成小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体。
02
钠的原子结构与化学性质
(2)钠除与O2反应外,钠还可以与Cl2在加热条件下反应,化学方程式为
2Na+Cl2 2NaCl。
△
====
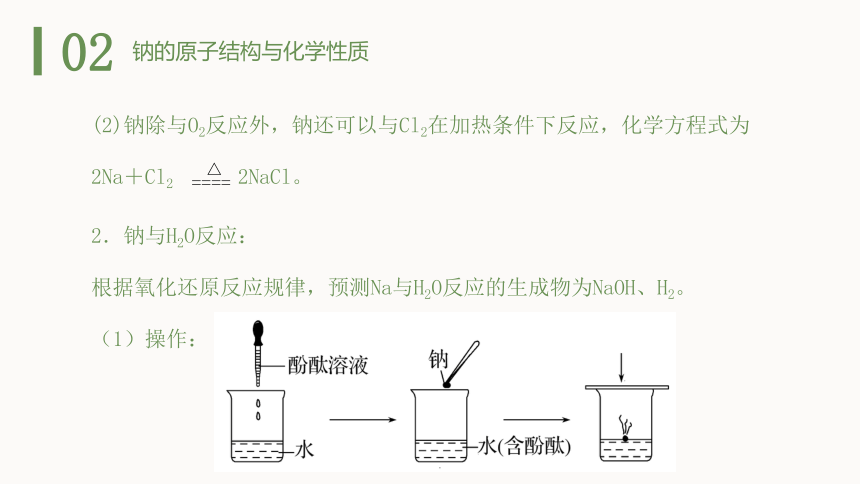
2.钠与H2O反应:
根据氧化还原反应规律,预测Na与H2O反应的生成物为NaOH、H2。
(1)操作:
02
钠的原子结构与化学性质
(2)现象及结论
现象 原因
钠浮在水面上 钠的密度比水___
熔成闪亮的小球 钠的熔点___且反应___热
钠在水面上迅速游动 反应产生_____推动钠游动
发出“嘶嘶”声响 钠与水反应剧烈
溶液变红 反应生成_____物质
低
小
放
气体
碱性
02
钠的原子结构与化学性质
思考:教材中描述“把一块绿豆大的钠放入水中”,实验中取“绿豆大”
的钠的目的是什么?
钠与水的反应剧烈,取“绿豆大”的钠可以保证实验的安全性,若颗粒
过大会发生爆炸。
02
钠的原子结构与化学性质
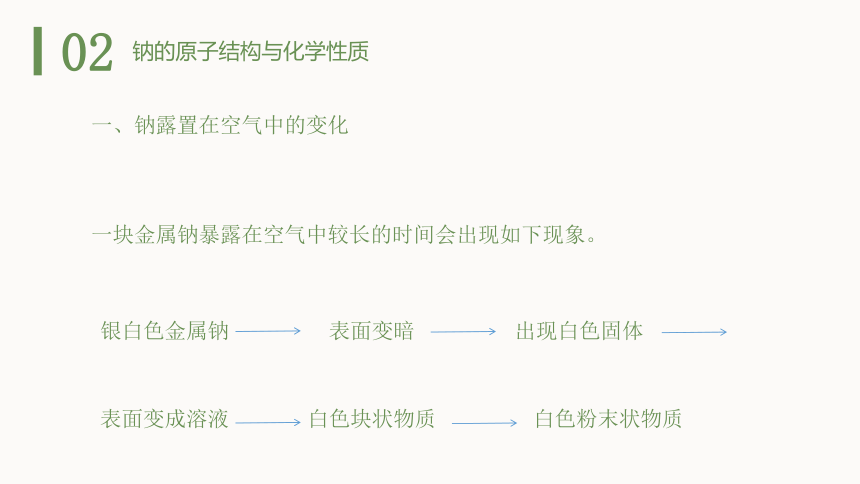
一、钠露置在空气中的变化
一块金属钠暴露在空气中较长的时间会出现如下现象。
银白色金属钠
表面变暗
出现白色固体
表面变成溶液
白色块状物质
白色粉末状物质
02
钠的原子结构与化学性质
钠在空气中的变化
(1)上述过程中钠表面变暗的原因是什么?
(2)上述过程中出现白色固体是什么?该过程表现含钠反应物的什么性质?
(3)写出上述过程中出现白色块状物质发生的化学反应方程式。
钠与氧气反应生成白色固体Na2O,失去金属光泽。
NaOH。Na2O与水反应生成NaOH,表现碱性氧化物的性质。
2NaOH+CO2===Na2CO3+H2O,Na2CO3+10H2O===Na2CO3·10H2O。
02
钠的原子结构与化学性质
总结:钠长期暴露在空气中,最终转化为Na2CO3,变化过程的现象及主
要反应如下:
02
钠的原子结构与化学性质
PS:(1)钠与氧气反应产物不同是由于反应条件不同,碳与氧气反应产物不同是由于氧气的量不同;
(2)空气中的CO2的量很少,故CO2与氢氧化钠反应只能生成碳酸钠,不能生成碳酸氢钠。
02
钠的原子结构与化学性质
思考:
(1)钠单质暴露在空气中会不会有Na2O2生成?
(2)钠与氧气反应时,条件不同,生成物不同,消耗等质量的钠,得到不同反应物时,转移电子数相同吗?
钠只有在加热条件下才会与O2反应生成Na2O2,故钠单质暴露在空气中不会有Na2O2生成。
相同。消耗等质量的钠,失去的电子的个数相同,与产物无关。
02
钠的原子结构与化学性质
二、钠与水、酸、碱、盐溶液的反应的实质
某同学为了探究钠单质与盐的反应,进行了以下两个实验:
实验一:将一块钠投入CuSO4溶液中,实验现象为钠立即熔为小球,并浮在水面四处游动,伴有嘶嘶的声响,同时溶液中有蓝色沉淀生成。
02
钠的原子结构与化学性质
实验二:如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。
(1)请解释实验一中现象并写出有关化学方程式。
02
钠的原子结构与化学性质
钠投入CuSO4溶液中,Na先与H2O反应生成NaOH和H2:2Na+2H2O===2NaOH+H2↑;生成的NaOH与CuSO4反应生成蓝色沉淀Cu(OH)2:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
02
钠的原子结构与化学性质
(2)请解释实验二中,是否发生了置换反应?上述反应能否证明钠可以从CuSO4溶液中置换出铜?能否说明钠比铜活泼?
(3)试分析钠单质与盐溶液反应的顺序,Na与盐反应冶炼金属的条件?
实验中有红色物质生成,说明熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,硫酸铜作氧化剂,说明钠比铜活泼。但不能证明钠可以从CuSO4溶液中置换出铜。
钠单质与盐溶液反应时,先与水反应生成氢氧化钠和氢气,再考虑氢氧化钠是否与盐发生复分解反应;Na与盐反应冶炼金属必须在无水条件下进行,即熔融状态下。
02
钠的原子结构与化学性质
总结:1.与酸溶液反应:
02
钠的原子结构与化学性质
2.与碱溶液反应:其实质是钠与水反应:
如钠氢氧化钠的反应,即钠与水的反应。
3.与盐溶液反应:
02
钠的原子结构与化学性质
PS:
(1)过量钠与酸溶液反应时,钠先与酸反应,再与水反应,最后消耗完。
(2)钠能与任何水溶液反应。不要认为盐不能与氢氧化钠反应,就不能与钠反应。
02
钠的原子结构与化学性质
思考:(1)钠投入FeCl3溶液中有什么现象出现?
(2)“钠不与氯化钠溶液反应”这种说法正确吗?
金属钠投入FeCl3溶液中,先与水反应,钠熔化成银白色小球,浮在水面上游动,听到嘶嘶声;然后再发生3NaOH+ FeCl3===Fe(OH)3↓+3NaCl,产生红褐色沉淀。
不正确。钠不与氯化钠反应,但钠与溶剂水发生氧化还原反应。
03
随堂训练
关于钠元素的单质及其化合物的叙述不正确的是( )
A.钠,银白色,质软,熔点相对较低,密度比水小
B.大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中
C.金属钠在空气中长期放置,最终变为碳酸钠
D.氧化钠和过氧化钠都是白色固体
D
03
随堂训练
取一支大试管,加入20 mL饱和澄清石灰水(ρ=1.6 g·cm-3),再加入5 mL苯(ρ=0.87 g·cm-3),静置后缓慢加入绿豆粒大小的钠块(ρ=0.971 g·cm-3)。下列实验现象中,能观察到的有( )
①钠在饱和澄清石灰水层反应并四处游动
②有气体产生
③溶液变浑浊
④钠在石灰水与苯的界面处反应并上下跳动
⑤钠停留在苯层不反应
⑥钠块最后消失
A.①②⑥ B.②③④⑥ C.⑤ D.①②③⑥
B
03
随堂训练
取一块金属钠放在燃烧匙里加热,下列关于该实验现象的描述不正确的是( )
A.金属钠先熔化
B.燃烧时火焰为黄色
C.燃烧后生成白色固体
D.燃烧后生成淡黄色固体
C
03
随堂训练
将钠和碳分别置于如图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个弹簧夹,这时观察到的现象是( )
A.水不进入任何一瓶 B.水进入左瓶
C.水进入右瓶 D.水同时进入两瓶
B
03
随堂训练
下列某学生将一小块钠投入滴有酚酞的水中,此实验能证明( )
①钠的密度比水的小 ②钠的熔点较低 ③钠与水反应时放出热量 ④钠与水反应后的溶液呈碱性
A.①④ B.①②④
C.①③④ D.①②③④
D
03
随堂训练
钛和钛的合金大量用于航空工业,有“空间金属”之称;金属钛可由反应TiCl4+4Na=====高温 4NaCl+Ti制得。对于反应,下列说法正确的是( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化剂
D.TiCl4是还原剂
A
03
随堂训练
根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
03
随堂训练
(2)由于金属钠很容易跟空气中的________、________等物质反应,通常将它保存在________里。
(3)将一小块钠投入下列溶液中,既能产生气体又会出现白色沉淀的是_____(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
03
随堂训练
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
①列出计算钠相对原子质量的数学表达式________(用含有a、b、c的算式表示)。
②无水氯化钙的作用____________________________________________。
03
随堂训练
解析:(1)钠是银白色金属,硬度很小,可以用小刀切,故A错误;钠在空气中燃烧产物是淡黄色的过氧化钠,故B正确;钠在空气中燃烧产物是淡黄色的过氧化钠,不是氧化钠,故C错误;金属钠的熔点很低,故D错误;
(2)钠性质很活泼,易和水、氧气反应,所以保存钠时要隔绝空气和水,钠和煤油不反应,且密度大于煤油,所以保存钠可以放在煤油中;
(3)A.钠和稀硫酸反应生成硫酸钠和氢气,没有沉淀产生,A不选;B.钠投入硫酸铜溶液中,首先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,但沉淀不是白色的,而是蓝色的,B不选;C.钠投入氢氧化
03
随堂训练
钠溶液中生成氢氧化钠和氢气,没有沉淀,C不选;D.钠投入氯化镁溶液中生成氯化钠、氢氧化镁白色沉淀和氢气,D选。
(4)①金属Na与水发生反应放出氢气的质量=ag+bg-cg=(a+b-c)g,其相对原子质量为M,金属钠与水反应放出氢气的关系如下:
2Na ~ H2
2M 2
b g (a+b-c)g
解得M=b/(a+b-c) ;
03
随堂训练
②氯化钙具有吸水能力,是常用的干燥剂,在装置中吸收生成氢气中的水,而防止水分流失。
答案:(1)B (2)氧气 水蒸气 煤油
(3)D (4)①b/(a+b-c) ②吸收H2中所含的水蒸气
03
随堂训练
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)===== 2Na+Cl2↑。回答下列有关单质钠的问题:
(1)保存金属钠的正确方法是________。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
电解
03
随堂训练
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式____________________,生成物的颜色为______。
(3)Na、NaOH久置空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的方程式为_______________。
03
随堂训练
【解析】(1)钠是很活泼的金属元素,其单质极易与水或氧气反应,又因为钠的密度小于水而大于煤油,因此钠通常保存在煤油中。
(2)将一小块钠放在水平放置的试管中部,加热,反应方程式为2Na+O2===== Na2O2。过氧化钠为淡黄色固体。
(3)Na、NaOH久置空气中最终都是变为碳酸钠,化学式为Na2CO3。
(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,发生反应的方程式为2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl。
△
03
随堂训练
第二章 海水中的重要元素
第一节 钠及其化合物
第一课时 活泼的金属单质——钠
目录
Contents
02.钠的原子结构与化学性质
01.钠的存在与物理性质
01
钠的存在与物理性质
钠的存在与物理性质
01
1、存在:
(1)已发现的100多种元素中,大约4/5是金属元素;
(2)形式:
化合态:活泼金属
游离态:极少数不活泼的金属(Ag、Au、Cu、Pt等)
2、钠元素在自然界都以化合物的形式存在,如NaCl、Na2CO3、Na2SO4等。
钠的存在与物理性质
01
3、钠的物理性质:
钠为银白色固体,密度为0.917g·cm-3,比水的密度小;熔点较低,硬度
小,用小刀可以切割。
02
钠的原子结构与化学性质
02
钠的原子结构与化学性质
钠原子的结构示意图为 ,最外层只有1个电子,在化学反应中容易失电子,表现很强的还原性。
1.钠与非金属单质反应:
(1)钠与氧气的反应
新切开的钠具有银白色的金属光泽,在空气中很快变暗。将钠块投入热坩埚中,钠先融化成小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体。
02
钠的原子结构与化学性质
(2)钠除与O2反应外,钠还可以与Cl2在加热条件下反应,化学方程式为
2Na+Cl2 2NaCl。
△
====
2.钠与H2O反应:
根据氧化还原反应规律,预测Na与H2O反应的生成物为NaOH、H2。
(1)操作:
02
钠的原子结构与化学性质
(2)现象及结论
现象 原因
钠浮在水面上 钠的密度比水___
熔成闪亮的小球 钠的熔点___且反应___热
钠在水面上迅速游动 反应产生_____推动钠游动
发出“嘶嘶”声响 钠与水反应剧烈
溶液变红 反应生成_____物质
低
小
放
气体
碱性
02
钠的原子结构与化学性质
思考:教材中描述“把一块绿豆大的钠放入水中”,实验中取“绿豆大”
的钠的目的是什么?
钠与水的反应剧烈,取“绿豆大”的钠可以保证实验的安全性,若颗粒
过大会发生爆炸。
02
钠的原子结构与化学性质
一、钠露置在空气中的变化
一块金属钠暴露在空气中较长的时间会出现如下现象。
银白色金属钠
表面变暗
出现白色固体
表面变成溶液
白色块状物质
白色粉末状物质
02
钠的原子结构与化学性质
钠在空气中的变化
(1)上述过程中钠表面变暗的原因是什么?
(2)上述过程中出现白色固体是什么?该过程表现含钠反应物的什么性质?
(3)写出上述过程中出现白色块状物质发生的化学反应方程式。
钠与氧气反应生成白色固体Na2O,失去金属光泽。
NaOH。Na2O与水反应生成NaOH,表现碱性氧化物的性质。
2NaOH+CO2===Na2CO3+H2O,Na2CO3+10H2O===Na2CO3·10H2O。
02
钠的原子结构与化学性质
总结:钠长期暴露在空气中,最终转化为Na2CO3,变化过程的现象及主
要反应如下:
02
钠的原子结构与化学性质
PS:(1)钠与氧气反应产物不同是由于反应条件不同,碳与氧气反应产物不同是由于氧气的量不同;
(2)空气中的CO2的量很少,故CO2与氢氧化钠反应只能生成碳酸钠,不能生成碳酸氢钠。
02
钠的原子结构与化学性质
思考:
(1)钠单质暴露在空气中会不会有Na2O2生成?
(2)钠与氧气反应时,条件不同,生成物不同,消耗等质量的钠,得到不同反应物时,转移电子数相同吗?
钠只有在加热条件下才会与O2反应生成Na2O2,故钠单质暴露在空气中不会有Na2O2生成。
相同。消耗等质量的钠,失去的电子的个数相同,与产物无关。
02
钠的原子结构与化学性质
二、钠与水、酸、碱、盐溶液的反应的实质
某同学为了探究钠单质与盐的反应,进行了以下两个实验:
实验一:将一块钠投入CuSO4溶液中,实验现象为钠立即熔为小球,并浮在水面四处游动,伴有嘶嘶的声响,同时溶液中有蓝色沉淀生成。
02
钠的原子结构与化学性质
实验二:如图,在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成。
(1)请解释实验一中现象并写出有关化学方程式。
02
钠的原子结构与化学性质
钠投入CuSO4溶液中,Na先与H2O反应生成NaOH和H2:2Na+2H2O===2NaOH+H2↑;生成的NaOH与CuSO4反应生成蓝色沉淀Cu(OH)2:2NaOH+CuSO4===Cu(OH)2↓+Na2SO4。
02
钠的原子结构与化学性质
(2)请解释实验二中,是否发生了置换反应?上述反应能否证明钠可以从CuSO4溶液中置换出铜?能否说明钠比铜活泼?
(3)试分析钠单质与盐溶液反应的顺序,Na与盐反应冶炼金属的条件?
实验中有红色物质生成,说明熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,硫酸铜作氧化剂,说明钠比铜活泼。但不能证明钠可以从CuSO4溶液中置换出铜。
钠单质与盐溶液反应时,先与水反应生成氢氧化钠和氢气,再考虑氢氧化钠是否与盐发生复分解反应;Na与盐反应冶炼金属必须在无水条件下进行,即熔融状态下。
02
钠的原子结构与化学性质
总结:1.与酸溶液反应:
02
钠的原子结构与化学性质
2.与碱溶液反应:其实质是钠与水反应:
如钠氢氧化钠的反应,即钠与水的反应。
3.与盐溶液反应:
02
钠的原子结构与化学性质
PS:
(1)过量钠与酸溶液反应时,钠先与酸反应,再与水反应,最后消耗完。
(2)钠能与任何水溶液反应。不要认为盐不能与氢氧化钠反应,就不能与钠反应。
02
钠的原子结构与化学性质
思考:(1)钠投入FeCl3溶液中有什么现象出现?
(2)“钠不与氯化钠溶液反应”这种说法正确吗?
金属钠投入FeCl3溶液中,先与水反应,钠熔化成银白色小球,浮在水面上游动,听到嘶嘶声;然后再发生3NaOH+ FeCl3===Fe(OH)3↓+3NaCl,产生红褐色沉淀。
不正确。钠不与氯化钠反应,但钠与溶剂水发生氧化还原反应。
03
随堂训练
关于钠元素的单质及其化合物的叙述不正确的是( )
A.钠,银白色,质软,熔点相对较低,密度比水小
B.大量的钠着火时可以用沙子扑灭,少量的钠应保存在煤油中
C.金属钠在空气中长期放置,最终变为碳酸钠
D.氧化钠和过氧化钠都是白色固体
D
03
随堂训练
取一支大试管,加入20 mL饱和澄清石灰水(ρ=1.6 g·cm-3),再加入5 mL苯(ρ=0.87 g·cm-3),静置后缓慢加入绿豆粒大小的钠块(ρ=0.971 g·cm-3)。下列实验现象中,能观察到的有( )
①钠在饱和澄清石灰水层反应并四处游动
②有气体产生
③溶液变浑浊
④钠在石灰水与苯的界面处反应并上下跳动
⑤钠停留在苯层不反应
⑥钠块最后消失
A.①②⑥ B.②③④⑥ C.⑤ D.①②③⑥
B
03
随堂训练
取一块金属钠放在燃烧匙里加热,下列关于该实验现象的描述不正确的是( )
A.金属钠先熔化
B.燃烧时火焰为黄色
C.燃烧后生成白色固体
D.燃烧后生成淡黄色固体
C
03
随堂训练
将钠和碳分别置于如图所示的两个盛满氧气的集气瓶中,燃烧完毕冷却至室温后,打开装置中的两个弹簧夹,这时观察到的现象是( )
A.水不进入任何一瓶 B.水进入左瓶
C.水进入右瓶 D.水同时进入两瓶
B
03
随堂训练
下列某学生将一小块钠投入滴有酚酞的水中,此实验能证明( )
①钠的密度比水的小 ②钠的熔点较低 ③钠与水反应时放出热量 ④钠与水反应后的溶液呈碱性
A.①④ B.①②④
C.①③④ D.①②③④
D
03
随堂训练
钛和钛的合金大量用于航空工业,有“空间金属”之称;金属钛可由反应TiCl4+4Na=====高温 4NaCl+Ti制得。对于反应,下列说法正确的是( )
A.该反应说明钠是强还原剂,可用于冶炼金属
B.该反应条件是TiCl4在熔融状态或水溶液中
C.Ti是氧化剂
D.TiCl4是还原剂
A
03
随堂训练
根据你对金属钠性质的了解,回答下列问题:
(1)关于钠的叙述中,正确的是________(填字母)。
A.钠是银白色金属,硬度很大
B.将金属钠放在石棉网上,用酒精灯加热后金属钠剧烈燃烧,产生黄色火焰,生成过氧化钠
C.金属钠在空气中燃烧,生成氧化钠
D.金属钠的熔点很高
03
随堂训练
(2)由于金属钠很容易跟空气中的________、________等物质反应,通常将它保存在________里。
(3)将一小块钠投入下列溶液中,既能产生气体又会出现白色沉淀的是_____(填字母)。
A.稀硫酸 B.硫酸铜溶液
C.氢氧化钠溶液 D.氯化镁溶液
03
随堂训练
(4)为粗略测定金属钠的相对原子质量,设计的装置如图所示,该装置(包括水)的总质量为ag,将质量为bg的钠(不足量)放入水中,立即塞紧瓶塞。完全反应后再称量此装置的总质量为cg。
①列出计算钠相对原子质量的数学表达式________(用含有a、b、c的算式表示)。
②无水氯化钙的作用____________________________________________。
03
随堂训练
解析:(1)钠是银白色金属,硬度很小,可以用小刀切,故A错误;钠在空气中燃烧产物是淡黄色的过氧化钠,故B正确;钠在空气中燃烧产物是淡黄色的过氧化钠,不是氧化钠,故C错误;金属钠的熔点很低,故D错误;
(2)钠性质很活泼,易和水、氧气反应,所以保存钠时要隔绝空气和水,钠和煤油不反应,且密度大于煤油,所以保存钠可以放在煤油中;
(3)A.钠和稀硫酸反应生成硫酸钠和氢气,没有沉淀产生,A不选;B.钠投入硫酸铜溶液中,首先和水反应生成氢氧化钠和氢气,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,但沉淀不是白色的,而是蓝色的,B不选;C.钠投入氢氧化
03
随堂训练
钠溶液中生成氢氧化钠和氢气,没有沉淀,C不选;D.钠投入氯化镁溶液中生成氯化钠、氢氧化镁白色沉淀和氢气,D选。
(4)①金属Na与水发生反应放出氢气的质量=ag+bg-cg=(a+b-c)g,其相对原子质量为M,金属钠与水反应放出氢气的关系如下:
2Na ~ H2
2M 2
b g (a+b-c)g
解得M=b/(a+b-c) ;
03
随堂训练
②氯化钙具有吸水能力,是常用的干燥剂,在装置中吸收生成氢气中的水,而防止水分流失。
答案:(1)B (2)氧气 水蒸气 煤油
(3)D (4)①b/(a+b-c) ②吸收H2中所含的水蒸气
03
随堂训练
金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)===== 2Na+Cl2↑。回答下列有关单质钠的问题:
(1)保存金属钠的正确方法是________。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
电解
03
随堂训练
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式____________________,生成物的颜色为______。
(3)Na、NaOH久置空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的方程式为_______________。
03
随堂训练
【解析】(1)钠是很活泼的金属元素,其单质极易与水或氧气反应,又因为钠的密度小于水而大于煤油,因此钠通常保存在煤油中。
(2)将一小块钠放在水平放置的试管中部,加热,反应方程式为2Na+O2===== Na2O2。过氧化钠为淡黄色固体。
(3)Na、NaOH久置空气中最终都是变为碳酸钠,化学式为Na2CO3。
(4)将一小块金属钠投入CuCl2溶液中,首先钠与水反应生成氢氧化钠和氢气,然后氢氧化钠与氯化铜发生复分解反应,发生反应的方程式为2Na+CuCl2+2H2O===Cu(OH)2↓+H2↑+2NaCl。
△
03
随堂训练
