2.1.2氧化钠和过氧化钠 课件(共29张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 2.1.2氧化钠和过氧化钠 课件(共29张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:00:00 | ||
图片预览







文档简介
(共29张PPT)
第二章 海水中的重要元素——钠和氧
第一节 钠及其化合物
第二课时 氧化钠和过氧化钠
02.过氧化钠的性质与应用
01.氧化钠的性质
目录
Contents
氧化钠的性质
01
氧化钠的性质
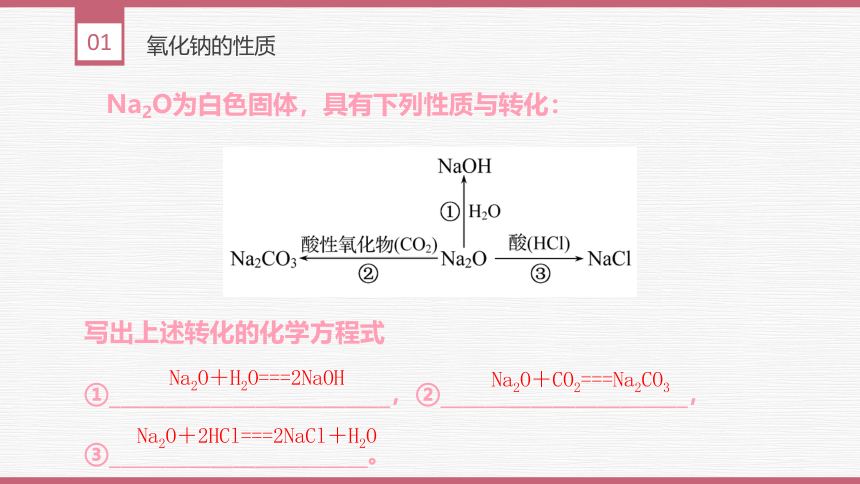
Na2O为白色固体,具有下列性质与转化:
写出上述转化的化学方程式
①_________________________,②______________________,
③_______________________。
Na2O+H2O===2NaOH
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
01
氧化钠的性质
【小结】(1)Na2O是一种碱性氧化物。
(2)将氧化钠投入酚酞溶液中溶液变红。
(3)碱性氧化物的通性:①部分(如Na2O、CaO)能与水反应生成碱;②与酸性氧
化物反应生成盐;③与酸反应生成盐和水。
过氧化钠的性质与应用
02
过氧化钠的性质与应用
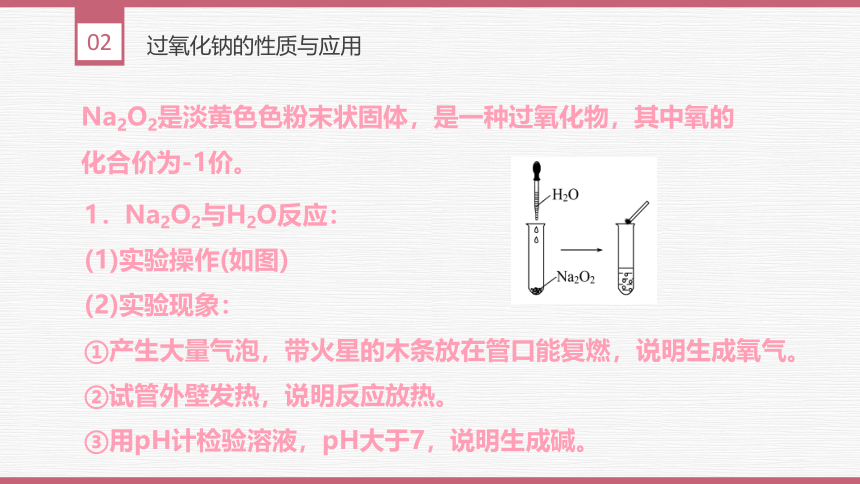
Na2O2是淡黄色色粉末状固体,是一种过氧化物,其中氧的化合价为-1价。
1.Na2O2与H2O反应:
(1)实验操作(如图)
(2)实验现象:
①产生大量气泡,带火星的木条放在管口能复燃,说明生成氧气。
②试管外壁发热,说明反应放热。
③用pH计检验溶液,pH大于7,说明生成碱。
02
过氧化钠的性质与应用
(3)化学方程式:2Na2O2+2H2O===4NaOH+O2↑
2.Na2O2与CO2反应:
反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2。
【小结】
(1)Na2O2不是碱性氧化物,既有氧化性又有还原剂,常作强氧化剂剂,用于杀菌消毒,作漂白剂。
02
过氧化钠的性质与应用
(2)Na2O2与H2O、CO2反应生成氧气,故Na2O2可在呼吸面具或潜水艇中作氧气的来源,作供养剂。
02
过氧化钠的性质与应用
思考:教材中描述“当火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火”,那么能否使用泡沫灭火器进行灭火?为什么?
不能。钠着火时生成的Na2O2会与泡沫灭火器喷出的CO2反应生成氧气,促进钠的燃烧。
02
过氧化钠的性质与应用
一、某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
02
过氧化钠的性质与应用
氧化钠和过氧化钠的比较
(1)脱脂棉剧烈燃烧的原因是什么?
(2)写出上述魔术的反应的化学方程式。反应中的氧化剂、还原剂分别是什么?
过氧化钠与水反应放热并生成O2,使脱脂棉在O2中达到着火点而燃烧。
2Na2O2+2H2O===4NaOH+O2↑。反应中的氧化剂、还原剂都是Na2O2。
02
过氧化钠的性质与应用
(3)魔术前后固体的质量如何变化?
增大。反应前后2个Na2O2生成4个NaOH,质量增加。
02
过氧化钠的性质与应用
总结:
1.氧化钠和过氧化钠的比较:
02
过氧化钠的性质与应用
02
过氧化钠的性质与应用
PS:
Na2O2与H2O反应原理
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得:2Na2O2+2H2O===4NaOH+O2↑。
02
过氧化钠的性质与应用
2.Na2O2强氧化性的表现:
3.从氧化还原的角度探究Na2O2与CO2和H2O的反应:
2Na2O2+2CO2===2Na2CO3+O2 ①
2Na2O2+2H2O===4NaOH+O2↑ ②
02
过氧化钠的性质与应用
(1)在反应①②中,Na2O2既表现出氧化性也表现出还原性,H2O、CO2既不是氧化剂,也不是还原剂。
(2)在反应①②中,2个Na2O2均生成1 个O2,转移2个的电子。如图:
02
过氧化钠的性质与应用
思考:将足量的Na2O2投入酚酞溶液中会有什么现象?
Na2O2与H2O反应生成氢氧化钠,使酚酞溶液变红,但Na2O2具有漂白性,足量的Na2O2又会使红色褪去。
03
随堂训练
在深海中作业的潜水员的呼吸面具上,往往装入一定量的Na2O2,目的是给潜水员提供氧气。
下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
03
随堂训练
对于反应:2Na2O2+2H2O===4NaOH+O2↑,下列说法中正确的是( )
A.Na2O2是氧化剂,H2O是还原剂
B.当2分子H2O参加反应时,生成1分子O2
C.当生成1分子O2时,转移的电子数为4
D.每有18 g H2O与足量Na2O2反应,则固体增重4 g
B
03
随堂训练
下列关于金属钠及钠的化合物叙述中正确的是( )
A.常温下,将金属钠加入饱和食盐水中,可以在溶液底部出现固体
B.将过量Na2O2投入滴有少量的酚酞水溶液中,溶液有气泡生成,且溶液最终呈红色
C.Na2O2与水反应生成碱,Na2O2属于碱性氧化物
D.切开的金属钠暴露在空气中,光亮表面逐渐变暗的原因是2Na+O2===Na2O2
A
03
随堂训练
把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH C.Na2CO3 D.CuSO4
D
03
随堂训练
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大 B.试管b内有气泡冒出
C.U形管内红色褪去 D.U形管水位d高于c
C
03
随堂训练
下列关于Na2O和Na2O2的叙述正确的是( )
A.Na2O与Na2O2均可与盐酸反应,故二者均为碱性氧化物
B.Na2O在一定条件下可以转化为Na2O2
C.Na2O与H2O的反应属于化合反应,而Na2O2与H2O的反应属于氧化还原反应,其中Na2O2是氧化剂,H2O是还原剂
D.在呼吸面具中,Na2O常作供氧剂
B
03
随堂训练
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
C
03
随堂训练
氧化钠与过氧化钠的相同点是( )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
C
03
随堂训练
过氧化钠可作呼吸面具中的供氧剂,实验室可用如图装置制取少量过氧化钠。下列说法错误的是( )
A.装置X还可以制取H2、CO2等气体
B.②中所盛试剂为饱和小苏打溶液
C.③的作用是防止空气中的水蒸气和二氧化碳进入硬质玻璃管
D.实验时需先让X装置反应一会儿,再点燃装置Z处的酒精灯
B
感谢观看
THANK YOU
第二章 海水中的重要元素——钠和氧
第一节 钠及其化合物
第二课时 氧化钠和过氧化钠
02.过氧化钠的性质与应用
01.氧化钠的性质
目录
Contents
氧化钠的性质
01
氧化钠的性质
Na2O为白色固体,具有下列性质与转化:
写出上述转化的化学方程式
①_________________________,②______________________,
③_______________________。
Na2O+H2O===2NaOH
Na2O+CO2===Na2CO3
Na2O+2HCl===2NaCl+H2O
01
氧化钠的性质
【小结】(1)Na2O是一种碱性氧化物。
(2)将氧化钠投入酚酞溶液中溶液变红。
(3)碱性氧化物的通性:①部分(如Na2O、CaO)能与水反应生成碱;②与酸性氧
化物反应生成盐;③与酸反应生成盐和水。
过氧化钠的性质与应用
02
过氧化钠的性质与应用
Na2O2是淡黄色色粉末状固体,是一种过氧化物,其中氧的化合价为-1价。
1.Na2O2与H2O反应:
(1)实验操作(如图)
(2)实验现象:
①产生大量气泡,带火星的木条放在管口能复燃,说明生成氧气。
②试管外壁发热,说明反应放热。
③用pH计检验溶液,pH大于7,说明生成碱。
02
过氧化钠的性质与应用
(3)化学方程式:2Na2O2+2H2O===4NaOH+O2↑
2.Na2O2与CO2反应:
反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2。
【小结】
(1)Na2O2不是碱性氧化物,既有氧化性又有还原剂,常作强氧化剂剂,用于杀菌消毒,作漂白剂。
02
过氧化钠的性质与应用
(2)Na2O2与H2O、CO2反应生成氧气,故Na2O2可在呼吸面具或潜水艇中作氧气的来源,作供养剂。
02
过氧化钠的性质与应用
思考:教材中描述“当火灾现场存放有大量活泼金属时,不能用水而需要用干燥的沙土来灭火”,那么能否使用泡沫灭火器进行灭火?为什么?
不能。钠着火时生成的Na2O2会与泡沫灭火器喷出的CO2反应生成氧气,促进钠的燃烧。
02
过氧化钠的性质与应用
一、某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
02
过氧化钠的性质与应用
氧化钠和过氧化钠的比较
(1)脱脂棉剧烈燃烧的原因是什么?
(2)写出上述魔术的反应的化学方程式。反应中的氧化剂、还原剂分别是什么?
过氧化钠与水反应放热并生成O2,使脱脂棉在O2中达到着火点而燃烧。
2Na2O2+2H2O===4NaOH+O2↑。反应中的氧化剂、还原剂都是Na2O2。
02
过氧化钠的性质与应用
(3)魔术前后固体的质量如何变化?
增大。反应前后2个Na2O2生成4个NaOH,质量增加。
02
过氧化钠的性质与应用
总结:
1.氧化钠和过氧化钠的比较:
02
过氧化钠的性质与应用
02
过氧化钠的性质与应用
PS:
Na2O2与H2O反应原理
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得:2Na2O2+2H2O===4NaOH+O2↑。
02
过氧化钠的性质与应用
2.Na2O2强氧化性的表现:
3.从氧化还原的角度探究Na2O2与CO2和H2O的反应:
2Na2O2+2CO2===2Na2CO3+O2 ①
2Na2O2+2H2O===4NaOH+O2↑ ②
02
过氧化钠的性质与应用
(1)在反应①②中,Na2O2既表现出氧化性也表现出还原性,H2O、CO2既不是氧化剂,也不是还原剂。
(2)在反应①②中,2个Na2O2均生成1 个O2,转移2个的电子。如图:
02
过氧化钠的性质与应用
思考:将足量的Na2O2投入酚酞溶液中会有什么现象?
Na2O2与H2O反应生成氢氧化钠,使酚酞溶液变红,但Na2O2具有漂白性,足量的Na2O2又会使红色褪去。
03
随堂训练
在深海中作业的潜水员的呼吸面具上,往往装入一定量的Na2O2,目的是给潜水员提供氧气。
下列对于Na2O、Na2O2的比较正确的一项是( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O、Na2O2都是易溶于水(与水反应)的白色固体
C.Na2O2在和CO2的反应中既是氧化剂又是还原剂
D.Na2O2、Na2O均可作供氧剂
C
03
随堂训练
对于反应:2Na2O2+2H2O===4NaOH+O2↑,下列说法中正确的是( )
A.Na2O2是氧化剂,H2O是还原剂
B.当2分子H2O参加反应时,生成1分子O2
C.当生成1分子O2时,转移的电子数为4
D.每有18 g H2O与足量Na2O2反应,则固体增重4 g
B
03
随堂训练
下列关于金属钠及钠的化合物叙述中正确的是( )
A.常温下,将金属钠加入饱和食盐水中,可以在溶液底部出现固体
B.将过量Na2O2投入滴有少量的酚酞水溶液中,溶液有气泡生成,且溶液最终呈红色
C.Na2O2与水反应生成碱,Na2O2属于碱性氧化物
D.切开的金属钠暴露在空气中,光亮表面逐渐变暗的原因是2Na+O2===Na2O2
A
03
随堂训练
把Na2O2投入下列各物质的稀溶液中,充分反应后可能有浑浊产生的是( )
A.HCl B.NaOH C.Na2CO3 D.CuSO4
D
03
随堂训练
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的。将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
A.气球a变大 B.试管b内有气泡冒出
C.U形管内红色褪去 D.U形管水位d高于c
C
03
随堂训练
下列关于Na2O和Na2O2的叙述正确的是( )
A.Na2O与Na2O2均可与盐酸反应,故二者均为碱性氧化物
B.Na2O在一定条件下可以转化为Na2O2
C.Na2O与H2O的反应属于化合反应,而Na2O2与H2O的反应属于氧化还原反应,其中Na2O2是氧化剂,H2O是还原剂
D.在呼吸面具中,Na2O常作供氧剂
B
03
随堂训练
下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),化学反应的本质并不改变的是( )
A.Na和O2 B.澄清石灰水和CO2
C.Na2O2和CO2 D.木炭(C)和O2
C
03
随堂训练
氧化钠与过氧化钠的相同点是( )
A.均是淡黄色固体
B.均是碱性氧化物
C.均能与水反应生成碱
D.均能与二氧化碳反应放出氧气
C
03
随堂训练
过氧化钠可作呼吸面具中的供氧剂,实验室可用如图装置制取少量过氧化钠。下列说法错误的是( )
A.装置X还可以制取H2、CO2等气体
B.②中所盛试剂为饱和小苏打溶液
C.③的作用是防止空气中的水蒸气和二氧化碳进入硬质玻璃管
D.实验时需先让X装置反应一会儿,再点燃装置Z处的酒精灯
B
感谢观看
THANK YOU
