2.2.1氯气的性质 课件(共35张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 2.2.1氯气的性质 课件(共35张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:08:16 | ||
图片预览






文档简介
(共35张PPT)
第二章 海水中的重要元素
第二节 氯及其化合物
第一课时 氯气的性质
阅读有关“从氯气的发现到被确认为一种新元素”的历史进程,感受化学对人类文明进步的贡献。
一
从氯原子结构角度,结合实验探究认识氯气的强氧化性。
二
认识次氯酸的强氧化性和不稳定性及其在生产、生活中的应用。
三
通过对“氯气的发现”的学习,培养实验探究和创新意识。
四
00
学习目标
一、氯气的发现
18世纪70年代,瑞典化学家________将__________与__________混合加热制得了氯气,但未确认,直到1810年,英国化学家________才确认氯气。
二、氯的存在及氯原子结构
1.氯元素在自然界中主要以________、MgCl2、CaCl2等形式存在于海水、________和盐矿中。
2.氯的原子结构示意图为_______________,氯原子最外电子层上有7个电子,在化学反应中很容易_______________,使最外层达到8个电子的稳定结构。氯气是很活泼的非金属单质,具有__________性。
软锰矿
浓盐酸
舍勒
戴维
NaCl
盐湖
得到一个电子
强氧化性
一、氯气的性质
1.物理性质
氯气是一种颜色为_________,带有___________的有毒气体。
它在25℃的溶解性为____________________________。
PS:闻气体气味的方法是用手在瓶口轻轻扇动,仅使少量气体飘进鼻孔。
2.化学性质
(1)与金属单质反应
黄绿色
刺激性气味
1体积的水可溶解约2体积的氯气
Cl2是一种强氧化剂,和变价金属反应时,生成最高价态金属氯化物。
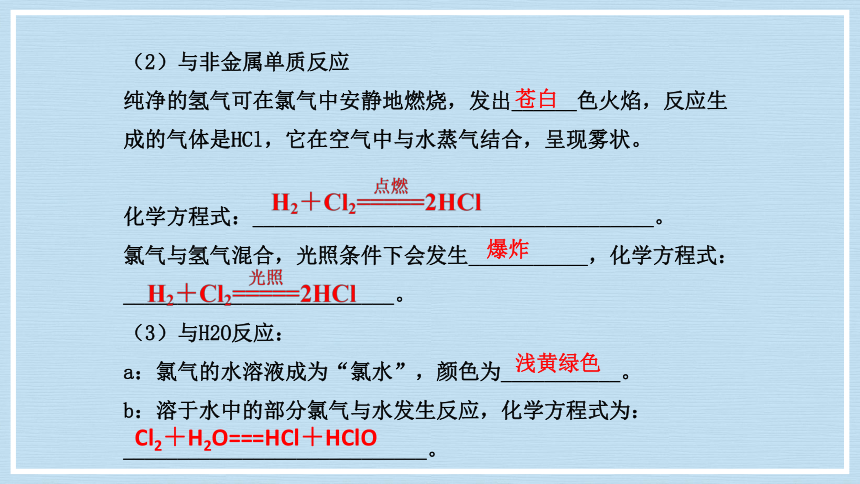
(2)与非金属单质反应
纯净的氢气可在氯气中安静地燃烧,发出______色火焰,反应生成的气体是HCl,它在空气中与水蒸气结合,呈现雾状。
化学方程式:_____________________________________。
氯气与氢气混合,光照条件下会发生___________,化学方程式:_________________________。
(3)与H2O反应:
a:氯气的水溶液成为“氯水”,颜色为___________。
b:溶于水中的部分氯气与水发生反应,化学方程式为:
____________________________。
苍白
爆炸
浅黄绿色
Cl2+H2O===HCl+HClO
(4)与碱反应:
漂白粉在空气中长期放置易实效,其原因为(用化学方程式表示):_________________________________________,
_________________________________________。
3.用途:大量用于制造________、有机溶剂、农药、染料和药品等。
Ca(ClO)2+H2O+CO2===CaCO3+2HClO
盐酸
四、次氯酸
1、性质
(1)弱酸性(酸性小于碳酸):NaClO+CO2+H2O===NaHCO3+HClO。
(2)不稳定性:次氯酸不稳定,只存在于水溶液中,见光易分解,化学方程式为:___________________________________。
(3)强氧化性
①漂白性。
用途:次氯酸可用作棉、麻和纸张的漂白剂。
没有
褪色
HClO
不褪色
四、氯水的成分:
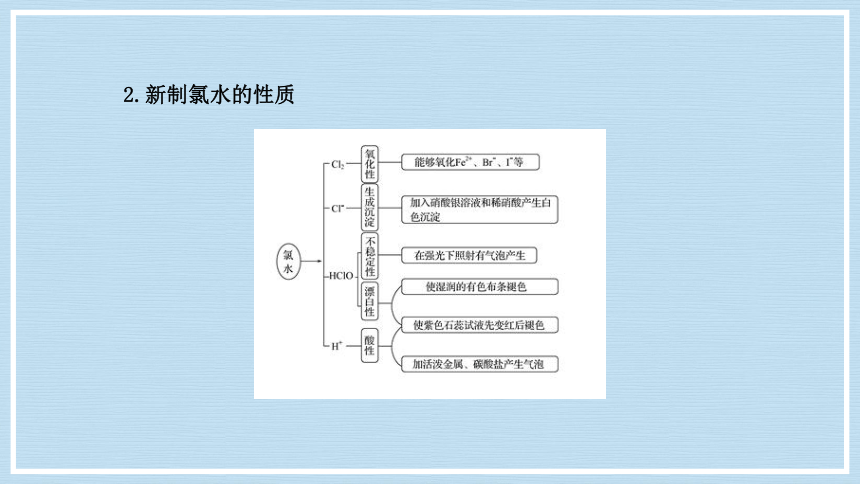
1.氯水中存在反应:Cl2+H2O===HCl+HClO,HClO和HCl发生电离。氯水中含有以下微粒:
2.新制氯水的性质
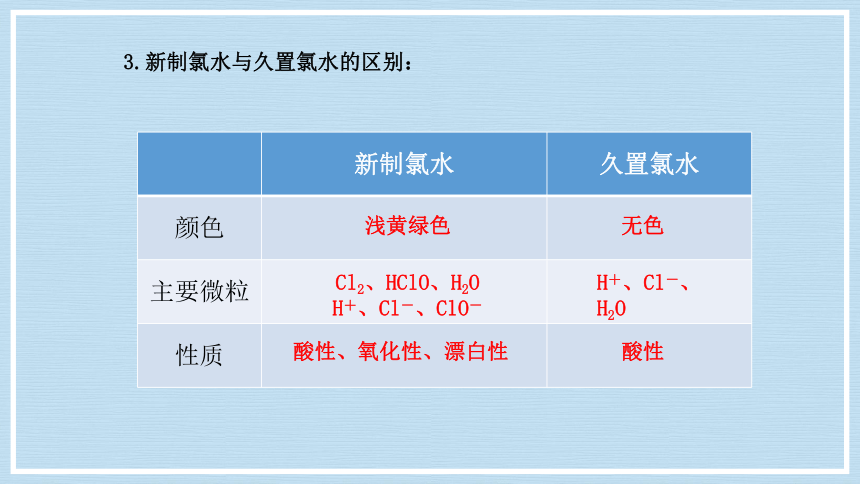
3.新制氯水与久置氯水的区别:
新制氯水 久置氯水
颜色
主要微粒
性质
浅黄绿色
无色
Cl2、HClO、H2O
H+、Cl-、ClO-
H+、Cl-、H2O
酸性、氧化性、漂白性
酸性
思考:
(1)将盛有氯水的烧瓶置于阳光下照射,有气泡产生,此气泡成分是氯气吗?烧瓶内溶液的酸碱性有何变化?
光照
不是 酸性增强。因反应2HClO===== 2HCl+O2↑,放出O2,有HCl生成,酸性增强。
(2)向含有酚酞的氢氧化钠溶液中滴加氯水,溶液红色褪去,如何验证是什么原因造成的?
可能有两种原因:①氯水中含具有强氧化性的HClO,它的漂白性使溶液褪色;②氯水中含有H+能中和OH-使溶液褪色。通过向褪色后的溶液中再加入氢氧化钠溶液,若溶液重新变为红色则原因②正确,若溶液无明显变化则原因①正确。
(2)向含有酚酞的氢氧化钠溶液中滴加氯水,溶液红色褪去,如何验证是什么原因造成的?
可能有两种原因:①氯水中含具有强氧化性的HClO,它的漂白性使溶液褪色;②氯水中含有H+能中和OH-使溶液褪色。通过向褪色后的溶液中再加入氢氧化钠溶液,若溶液重新变为红色则原因②正确,若溶液无明显变化则原因①正确。
(3)若将集气瓶丙长时间放置在阳光下,会发生什么现象?
溶液中有少量的气泡生成,集气瓶中的气体的颜色和溶液的颜色逐渐变浅,最后变为无色气体和无色的溶液。
(4)向集气瓶丙中加入一定量的石蕊试液,会观察到什么现象,为什么?
紫色石蕊试液先变红色后褪色。原因是氯水溶液中含有HCl和HClO,溶液呈酸性,因此能使紫色石蕊试液变红,而其中的HClO又具有漂白性,因此又能使变色的石蕊褪为无色。
随堂训练
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙中注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水
A. ②①③ B. ①②③ C.③②① D. ①③②
A
随堂训练
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
B
选项 方法 现象 结论
A 观察氯水颜色 氯水呈黄绿色 氯水中含Cl2
B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO
C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性
D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性
随堂训练
下列有关于Cl2的说法中,不正确的是( )
A.Cl2是一种黄绿色、密度比空气大的有毒气体
B.Cl2能与水反应生成盐酸和次氯酸
C.工业上用Cl2和石灰水为原料制造漂白粉
D.红热的铁丝在Cl2中剧烈燃烧,产生棕色烟
C
随堂训练
某同学用氯气消毒的自来水配制下列物质的溶液,会产生明显变质的是( )
①FeCl2 ②AgNO3 ③NaHCO3 ④AlCl3 ⑤KI
A.①②④ B.①②③⑤
C.①④⑤ D.全部
B
随堂训练
下列关于氯气的说法中正确的是( )
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.点燃氢气和氯气的混合气体可以制取氯化氢
C.氯气氧化性很强,一般都能将还原剂氧化为它的最高价态
D.氯原子最外层有7个电子,所以氯元素只有-1和+7价
C
随堂训练
下列有关实验的现象描述正确的是( )
A.氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾
B.磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大量白色烟雾
C.铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
A
随堂训练
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D
随堂训练
自来水厂在配水前的最后一步是向水中通入Cl2,下列有关说法错误的是( )
A.自来水中起杀菌、消毒作用的是HCl
B.自来水散发出的少量刺激性气味是Cl2的气味
C.自来水在阳光下晒一段时间后水中出现的气泡是O2
D.长期用自来水养鱼,鱼身颜色逐渐变浅,可能是由HClO引起
A
随堂训练
下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯与氯水均有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
随堂训练
海啸、地震、洪水等自然灾害过后,地下水等饮用水都会受到一定程度的污染,为了保证人民身心健康,下列物质不能用于水源消毒的是( )
A.氯气 B.漂白粉 C.烧碱 D.次氯酸钠
C
随堂训练
某化学小组进行了以下实验:
发现氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
随堂训练
(1)提出问题:氯水中哪种物质能使红色布条褪色?
(2)收集资料:①氯气有强氧化性;②氯气与水反应生成稀盐酸和次氯酸;③次氯酸有强氧化性。
(3)提出假设:
①______________________________________________________;
②_____________________________________________________;
③____________________________________________________;
④水使红色布条褪色。
随堂训练
(4)验证假设:实验①:把红色布条放入充满氯气的集气瓶中,布条不褪色;
实验②:________________________________________________;
实验③:_______________________________________________;
实验④:把红色布条放在水里,布条不褪色。
(5)得出的实验结论是____________________________________。
随堂训练
【解析】提出假设是根据收集到的资料结合所学知识进行的。氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色。氯水中的氯气、盐酸、水均不能使红色布条褪色,说明是次氯酸使红色布条褪色。
随堂训练
答案:(3)①氯气使红色布条褪色 ②次氯酸使红色布条褪色 ③稀盐酸使红色布条褪色
(4)②把红色布条伸入次氯酸溶液中,红色布条褪色
③把红色布条伸入稀盐酸中,红色布条不褪色
(5)次氯酸使红色布条褪色
随堂训练
氯水是一种环境消毒剂,在生活中有着广泛的应用。氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。
随堂训练
Ⅰ.(1)能证明氯水具有漂白性的是________(填“a”“b”“c”或“d”)。
(2)c过程中的现象是________________,b过程中反应的化学方程式为_________________________________________________。
(3)久置的氯水变为________,用化学反应方程式表示为________________。
(4)实验室保存饱和氯水的方法是________________。
随堂训练
Ⅱ.(1)化学研究小组发现在强光照射下新制氯水产生细小气泡,且浅黄绿色逐渐消失,请预测气泡的成分___________________________________________。
(2)请设计实验测定强光照射下久置氯水中氯元素的质量(简单叙述实验过程即可,不涉及具体数值计算):_____________________________。
随堂训练
答案:Ⅰ.(1)d (2)有白色沉淀生成 Na2CO3+2HCl===2NaCl+H2O+CO2↑
光照
(3)稀盐酸 2HClO===== 2HCl+O2↑
(4)在阴凉处置于棕色试剂瓶中密封保存
Ⅱ.(1)氧气 (2)量取一定量的试样,加入足量的硝酸银溶液,过滤、洗涤,干燥,称量沉淀质量
感谢观看
THANK YOU
第二章 海水中的重要元素
第二节 氯及其化合物
第一课时 氯气的性质
阅读有关“从氯气的发现到被确认为一种新元素”的历史进程,感受化学对人类文明进步的贡献。
一
从氯原子结构角度,结合实验探究认识氯气的强氧化性。
二
认识次氯酸的强氧化性和不稳定性及其在生产、生活中的应用。
三
通过对“氯气的发现”的学习,培养实验探究和创新意识。
四
00
学习目标
一、氯气的发现
18世纪70年代,瑞典化学家________将__________与__________混合加热制得了氯气,但未确认,直到1810年,英国化学家________才确认氯气。
二、氯的存在及氯原子结构
1.氯元素在自然界中主要以________、MgCl2、CaCl2等形式存在于海水、________和盐矿中。
2.氯的原子结构示意图为_______________,氯原子最外电子层上有7个电子,在化学反应中很容易_______________,使最外层达到8个电子的稳定结构。氯气是很活泼的非金属单质,具有__________性。
软锰矿
浓盐酸
舍勒
戴维
NaCl
盐湖
得到一个电子
强氧化性
一、氯气的性质
1.物理性质
氯气是一种颜色为_________,带有___________的有毒气体。
它在25℃的溶解性为____________________________。
PS:闻气体气味的方法是用手在瓶口轻轻扇动,仅使少量气体飘进鼻孔。
2.化学性质
(1)与金属单质反应
黄绿色
刺激性气味
1体积的水可溶解约2体积的氯气
Cl2是一种强氧化剂,和变价金属反应时,生成最高价态金属氯化物。
(2)与非金属单质反应
纯净的氢气可在氯气中安静地燃烧,发出______色火焰,反应生成的气体是HCl,它在空气中与水蒸气结合,呈现雾状。
化学方程式:_____________________________________。
氯气与氢气混合,光照条件下会发生___________,化学方程式:_________________________。
(3)与H2O反应:
a:氯气的水溶液成为“氯水”,颜色为___________。
b:溶于水中的部分氯气与水发生反应,化学方程式为:
____________________________。
苍白
爆炸
浅黄绿色
Cl2+H2O===HCl+HClO
(4)与碱反应:
漂白粉在空气中长期放置易实效,其原因为(用化学方程式表示):_________________________________________,
_________________________________________。
3.用途:大量用于制造________、有机溶剂、农药、染料和药品等。
Ca(ClO)2+H2O+CO2===CaCO3+2HClO
盐酸
四、次氯酸
1、性质
(1)弱酸性(酸性小于碳酸):NaClO+CO2+H2O===NaHCO3+HClO。
(2)不稳定性:次氯酸不稳定,只存在于水溶液中,见光易分解,化学方程式为:___________________________________。
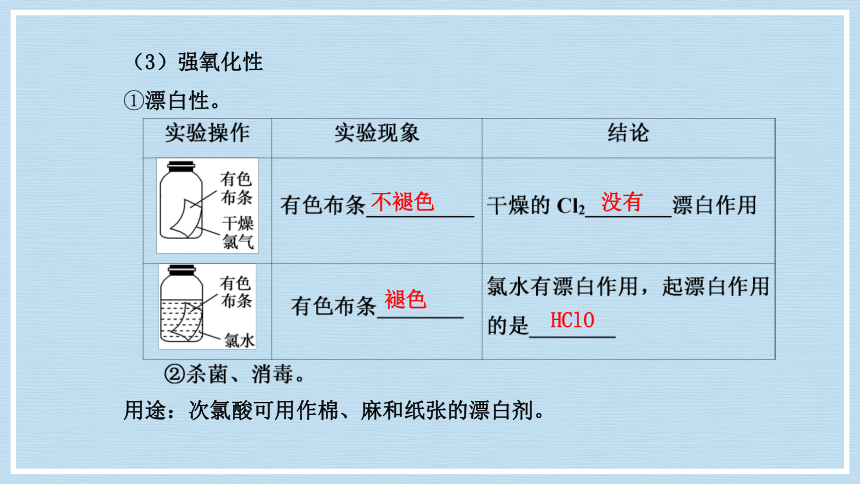
(3)强氧化性
①漂白性。
用途:次氯酸可用作棉、麻和纸张的漂白剂。
没有
褪色
HClO
不褪色
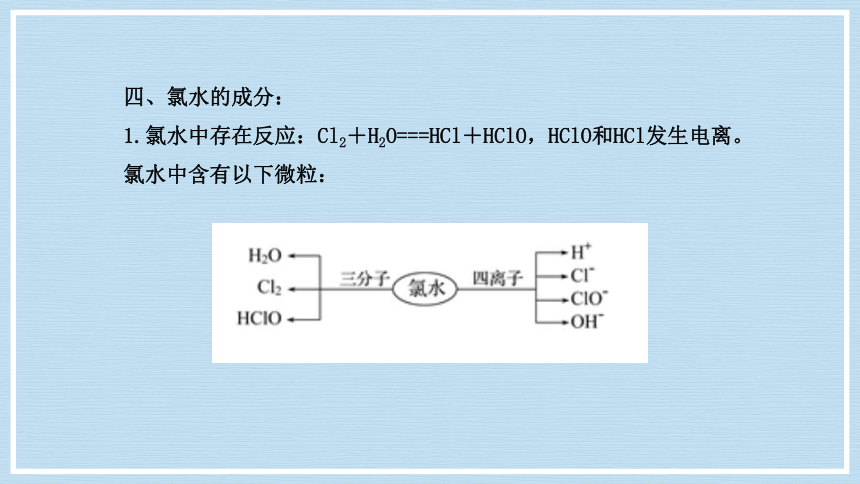
四、氯水的成分:
1.氯水中存在反应:Cl2+H2O===HCl+HClO,HClO和HCl发生电离。氯水中含有以下微粒:
2.新制氯水的性质
3.新制氯水与久置氯水的区别:
新制氯水 久置氯水
颜色
主要微粒
性质
浅黄绿色
无色
Cl2、HClO、H2O
H+、Cl-、ClO-
H+、Cl-、H2O
酸性、氧化性、漂白性
酸性
思考:
(1)将盛有氯水的烧瓶置于阳光下照射,有气泡产生,此气泡成分是氯气吗?烧瓶内溶液的酸碱性有何变化?
光照
不是 酸性增强。因反应2HClO===== 2HCl+O2↑,放出O2,有HCl生成,酸性增强。
(2)向含有酚酞的氢氧化钠溶液中滴加氯水,溶液红色褪去,如何验证是什么原因造成的?
可能有两种原因:①氯水中含具有强氧化性的HClO,它的漂白性使溶液褪色;②氯水中含有H+能中和OH-使溶液褪色。通过向褪色后的溶液中再加入氢氧化钠溶液,若溶液重新变为红色则原因②正确,若溶液无明显变化则原因①正确。
(2)向含有酚酞的氢氧化钠溶液中滴加氯水,溶液红色褪去,如何验证是什么原因造成的?
可能有两种原因:①氯水中含具有强氧化性的HClO,它的漂白性使溶液褪色;②氯水中含有H+能中和OH-使溶液褪色。通过向褪色后的溶液中再加入氢氧化钠溶液,若溶液重新变为红色则原因②正确,若溶液无明显变化则原因①正确。
(3)若将集气瓶丙长时间放置在阳光下,会发生什么现象?
溶液中有少量的气泡生成,集气瓶中的气体的颜色和溶液的颜色逐渐变浅,最后变为无色气体和无色的溶液。
(4)向集气瓶丙中加入一定量的石蕊试液,会观察到什么现象,为什么?
紫色石蕊试液先变红色后褪色。原因是氯水溶液中含有HCl和HClO,溶液呈酸性,因此能使紫色石蕊试液变红,而其中的HClO又具有漂白性,因此又能使变色的石蕊褪为无色。
随堂训练
向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如图所示,则甲、乙、丙中注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水
A. ②①③ B. ①②③ C.③②① D. ①③②
A
随堂训练
在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是( )
B
选项 方法 现象 结论
A 观察氯水颜色 氯水呈黄绿色 氯水中含Cl2
B 向饱和NaHCO3溶液中加入足量氯水 有无色气体产生 氯水中含HClO
C 向红色纸条上滴加氯水 红色纸条褪色 氯水具有漂白性
D 向FeCl2溶液中滴加氯水 溶液变成棕黄色 氯水具有氧化性
随堂训练
下列有关于Cl2的说法中,不正确的是( )
A.Cl2是一种黄绿色、密度比空气大的有毒气体
B.Cl2能与水反应生成盐酸和次氯酸
C.工业上用Cl2和石灰水为原料制造漂白粉
D.红热的铁丝在Cl2中剧烈燃烧,产生棕色烟
C
随堂训练
某同学用氯气消毒的自来水配制下列物质的溶液,会产生明显变质的是( )
①FeCl2 ②AgNO3 ③NaHCO3 ④AlCl3 ⑤KI
A.①②④ B.①②③⑤
C.①④⑤ D.全部
B
随堂训练
下列关于氯气的说法中正确的是( )
A.氯气在常温下能与铁反应,故不能用铁罐存放液氯
B.点燃氢气和氯气的混合气体可以制取氯化氢
C.氯气氧化性很强,一般都能将还原剂氧化为它的最高价态
D.氯原子最外层有7个电子,所以氯元素只有-1和+7价
C
随堂训练
下列有关实验的现象描述正确的是( )
A.氢气在氯气中燃烧,火焰呈苍白色,瓶口出现大量白雾
B.磷在氯气中燃烧,发出明亮的蓝紫色火焰,产生大量白色烟雾
C.铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液
D.用洁净的铂丝沾取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰
A
随堂训练
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
D
随堂训练
自来水厂在配水前的最后一步是向水中通入Cl2,下列有关说法错误的是( )
A.自来水中起杀菌、消毒作用的是HCl
B.自来水散发出的少量刺激性气味是Cl2的气味
C.自来水在阳光下晒一段时间后水中出现的气泡是O2
D.长期用自来水养鱼,鱼身颜色逐渐变浅,可能是由HClO引起
A
随堂训练
下列关于液氯和氯水的叙述中正确的是( )
A.液氯是纯净物,而氯水是混合物
B.液氯与氯水均有酸性
C.液氯较氯水的漂白作用更强
D.液氯无色,氯水呈黄绿色
A
随堂训练
海啸、地震、洪水等自然灾害过后,地下水等饮用水都会受到一定程度的污染,为了保证人民身心健康,下列物质不能用于水源消毒的是( )
A.氯气 B.漂白粉 C.烧碱 D.次氯酸钠
C
随堂训练
某化学小组进行了以下实验:
发现氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
随堂训练
(1)提出问题:氯水中哪种物质能使红色布条褪色?
(2)收集资料:①氯气有强氧化性;②氯气与水反应生成稀盐酸和次氯酸;③次氯酸有强氧化性。
(3)提出假设:
①______________________________________________________;
②_____________________________________________________;
③____________________________________________________;
④水使红色布条褪色。
随堂训练
(4)验证假设:实验①:把红色布条放入充满氯气的集气瓶中,布条不褪色;
实验②:________________________________________________;
实验③:_______________________________________________;
实验④:把红色布条放在水里,布条不褪色。
(5)得出的实验结论是____________________________________。
随堂训练
【解析】提出假设是根据收集到的资料结合所学知识进行的。氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色。氯水中的氯气、盐酸、水均不能使红色布条褪色,说明是次氯酸使红色布条褪色。
随堂训练
答案:(3)①氯气使红色布条褪色 ②次氯酸使红色布条褪色 ③稀盐酸使红色布条褪色
(4)②把红色布条伸入次氯酸溶液中,红色布条褪色
③把红色布条伸入稀盐酸中,红色布条不褪色
(5)次氯酸使红色布条褪色
随堂训练
氯水是一种环境消毒剂,在生活中有着广泛的应用。氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。
随堂训练
Ⅰ.(1)能证明氯水具有漂白性的是________(填“a”“b”“c”或“d”)。
(2)c过程中的现象是________________,b过程中反应的化学方程式为_________________________________________________。
(3)久置的氯水变为________,用化学反应方程式表示为________________。
(4)实验室保存饱和氯水的方法是________________。
随堂训练
Ⅱ.(1)化学研究小组发现在强光照射下新制氯水产生细小气泡,且浅黄绿色逐渐消失,请预测气泡的成分___________________________________________。
(2)请设计实验测定强光照射下久置氯水中氯元素的质量(简单叙述实验过程即可,不涉及具体数值计算):_____________________________。
随堂训练
答案:Ⅰ.(1)d (2)有白色沉淀生成 Na2CO3+2HCl===2NaCl+H2O+CO2↑
光照
(3)稀盐酸 2HClO===== 2HCl+O2↑
(4)在阴凉处置于棕色试剂瓶中密封保存
Ⅱ.(1)氧气 (2)量取一定量的试样,加入足量的硝酸银溶液,过滤、洗涤,干燥,称量沉淀质量
感谢观看
THANK YOU
