2.1.3碳酸钠和碳酸氢钠及焰色反应 课件(共35张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 2.1.3碳酸钠和碳酸氢钠及焰色反应 课件(共35张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 16.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:08:56 | ||
图片预览











文档简介
(共35张PPT)
第一节 钠及其化合物
第三课时
碳酸钠与碳酸氢钠及焰色反应
第二章 海水中的重要元素
目录
o1.碳酸钠与碳酸氢钠
o2.碳酸铵与碳酸氢钠的性质比较及相互转化
o3.焰色试验
o1
碳酸钠与碳酸氢铵
01
碳酸钠与碳酸氢钠
1.用途:
碳酸钠:造纸、纺织、石油、合成洗涤剂、制玻璃、肥皂。
碳酸氢钠:发酵粉、治疗胃酸过多。
2.物理性质:
(1)碳酸钠俗名纯碱,为白色粉末,易溶于水,水溶液显碱性,遇少量水变成晶体(水合碳酸钠,化学式为Na2CO3·XH2O)
(2)碳酸氢钠俗名小苏打,为细小白色晶体,水中易溶,但比Na2CO3的溶解度小。加少量水溶解吸热,溶液呈碱性。
01
碳酸钠与碳酸氢钠
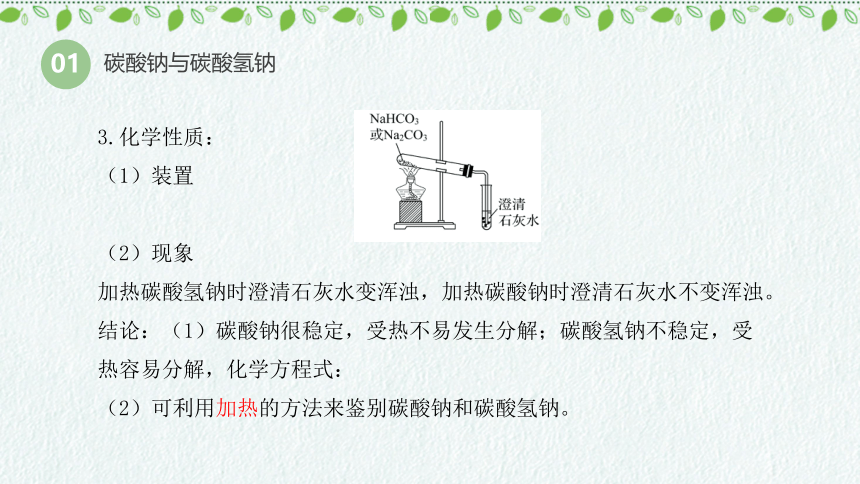
3.化学性质:
(1)装置
(2)现象
加热碳酸氢钠时澄清石灰水变浑浊,加热碳酸钠时澄清石灰水不变浑浊。
结论:(1)碳酸钠很稳定,受热不易发生分解;碳酸氢钠不稳定,受热容易分解,化学方程式:
(2)可利用加热的方法来鉴别碳酸钠和碳酸氢钠。
01
碳酸钠与碳酸氢钠
教材中描述“碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末”,该变化是物理变化还是化学变化?
化学变化
01
碳酸钠与碳酸氢钠
面包松软可口,深受人们喜爱,这么好的食物离不开一种物质——发酵粉。发酵粉主要用作面制品和膨化食品的生产。发酵粉的主要成分为碳酸氢钠和酒石酸。请分析碳酸氢钠在面包制作中的作用是什么?化学反应原理是什么?
发酵粉溶于水后,碳酸氢钠与酒石酸和食物里含有的酸性物质发生反应生成水和二氧化碳气体,二氧化碳可以起膨松食物的作用。
o2
碳酸钠与碳酸氢钠的性质比较及相互转化
02
碳酸钠与碳酸氢钠的性质比较及相互转化
苏打和小苏打是日常生活中的必需品,在生活和生产中有非常重要的应用。以下是NaHCO3及碳酸盐的一些用途及现象:
(1)碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。
(2)碳酸氢钠干粉灭火器不能用来灭钠起火。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(1)你知道“加入发酵粉的面团加热焙烤后体积比原来大”的原因是什么吗?
(2)为什么“碳酸氢钠干粉灭火器不能用来灭钠起火”?
加热时碳酸氢钠发生反应为2NaHCO3=====Na2CO3+H2O+CO2↑,产生大量气体,从而使面包体积增大。
△
碳酸氢钠干粉灭火器是利用受热分解得到的二氧化碳灭火,而钠的燃烧产物过氧化钠可以和二氧化碳反应。所以碳酸氢钠干粉灭火器不能用来灭钠起火。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
碳酸钠、碳酸氢钠与常见物质的反应
(1)与盐酸反应
①碳酸钠
少量盐酸:Na2CO3 + HCl===NaHCO3 + NaCl;
过量盐酸:Na2CO3 + 2HCl===2NaCl+H2O+CO2↑。
②碳酸氢钠:NaHCO3 +HCl===NaCl+H2O+CO2↑。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(2)与NaOH反应
①碳酸钠不与NaOH反应;
②碳酸氢钠:NaHCO3+NaOH===Na2CO3+ H2O。
(3)与Ca(OH)2反应
①碳酸钠:Na2CO3 + Ca(OH)2===CaCO3↓+ 2NaOH。
②碳酸氢钠:NaHCO3(少量)+ Ca(OH)2===NaOH+ CaCO3↓+ H2O。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(4)与CO2反应
①碳酸钠:Na2CO3 + CO2+ H2O===2NaHCO3。
②碳酸氢钠不与CO2反应。
(5)与BaCl2反应
①碳酸钠:Na2CO3 + BaCl2===BaCO3↓+ 2NaCl。
②碳酸氢钠不与BaCl2反应。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(1)若碳酸钠固体中混有少量碳酸氢钠,如何除去?
(2)Na2CO3溶液中混有NaHCO3,应该如何除去?
(3)碳酸氢钠溶液中混有少量碳酸钠,能否向溶液中滴加盐酸而除去?最好的方法是什么?
可采用加热的方法,碳酸氢钠分解生成碳酸钠。
加入适量NaOH溶液。发生反应为NaHCO3+NaOH===Na2CO3+H2O。
不能用滴加盐酸的方法,因为两种物质均能与盐酸反应,无法控制加入盐酸的量;可向溶液中通入CO2气体,发生反应Na2CO3+CO2+H2O===2NaHCO3,达到除去杂质的目的。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
测定纯碱纯度的两种常见方法
气体法
沉淀法
发生反应Na2CO3+H2SO4===Na2SO4+H2O+CO2↑,依据CO2的体积确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的纯度。但要注意CO2中杂质的干扰。
发生反应Na2CO3+BaCl2===BaCO3↓+2NaCl,依据BaCO3沉淀的质量,确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的纯度。
o3
焰色试验
03
焰色试验
实验步骤:
(1)烧:将洗净的铂丝(或光洁无锈的铁丝)在火焰上灼烧至与_________
______相同。
(2)蘸:蘸取碳酸钠或碳酸钾溶液。
(3)烧:在无色的外焰上灼烧,并观察_________。
(4)洗:再用_____洗净铂丝(或铁丝)。
(5)烧:在无色的外焰上烧至_____。
原来的火
焰颜色
火焰颜色
盐酸
无色
03
焰色试验
结论:
(1)某些金属及其化合物灼烧时火焰呈现出特征_____,根据呈现的特
征颜色,判断试样所含的_____元素,化学上把这样的_____分析操作称为焰色试
验。
(2)常见元素的焰色实验:钠——___色,钾——___色(要透过___________观察,
避免钠的黄色光干扰),钡——黄绿色,钙——砖红色。
颜色
金属
定性
黄
紫
蓝色钴玻璃
03
焰色试验
探究焰色试验的操作与应用
(1)五彩缤纷的烟花产生的原因是什么?
(2)除金属的化合物外,单质金属能不能也有同样的焰色试验?
(3)是不是所有的金属都有焰色试验?
烟花燃放时发生化学反应放热,不同的金属元素在加热条件下发生焰色试验,产生不同的火焰颜色。
能。因为焰色试验是金属元素的性质,无论是化合物还是单质,只要含有某种金属元素,这种物质就能有这种金属元素的焰色试验。
不是。并非所有金属都有焰色试验(Pt、Fe、Al、Ni、Cr、W等就没有)。
03
焰色试验
不一定。观察钾的焰色时需要透过蓝色钴玻璃,以滤去黄色光。
思考:
(1)用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时火焰呈黄色,该无色溶液中一定不含K+吗?
(2)如何利用物理方法鉴别K2CO3溶液和Na2CO3溶液?
先用铂丝分别蘸取少量上述溶液,放到酒精灯上灼烧,看火焰颜色。若为黄色,为Na2CO3溶液;若透过蓝色钴玻璃观察为紫色,则为K2CO3溶液。
03
焰色试验
(3)焰色试验中使用铂丝的原因是什么?
(4)灼烧氯化钠和碳酸钠的火焰颜色是否相同?
金属铂不存在焰色试验。
相同。焰色试验是元素的性质,只要含有钠元素灼烧时火焰颜色就为黄色。
04
随堂训练
下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是( )
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液
D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg
C
04
随堂训练
比较是学习中最好用的方法之一。下列关于碳酸钠和碳酸氢钠的比较中,说法错误的是( )
A.热稳定性:碳酸钠大于碳酸氢钠
B.在其溶液中滴加澄清石灰水:它们都有白色沉淀生成
C.做焰色试验:它们的火焰都呈黄色
D.与相同浓度的盐酸反应产生CO2的速率:碳酸钠大于碳酸氢钠
D
04
随堂训练
有同学利用如图装置鉴别碳酸钠和碳酸氢钠的稳定性。点燃酒精灯,加热盛有固体药品的部位。请结合实验现象,完成下面的填空。
(1)[实验现象]加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的石灰水________,且固体附近的玻璃管内壁上附有大量的____________。
(2)[实验结论]该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有________。而盛有碳酸钠的长柄V形玻璃管里的石灰水____________。
04
随堂训练
加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的石灰水变浑浊,且固体附近的玻璃管内壁上附有大量的小液滴;该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有二氧化碳和水。而盛有碳酸钠的长柄V形玻璃管里的石灰水不变浑浊。
答案:(1)变浑浊 小液滴
(2)二氧化碳和水 不变浑浊
04
随堂训练
下列有关焰色试验叙述错误的是( )
A.氯化钠在火焰上灼烧时,火焰呈黄色
B.焰色试验是金属单质的特性
C.连续做两个样品时,应将铂丝用盐酸洗净并灼烧至无色
D.可用洁净的铁丝代替铂丝做焰色试验
B
04
随堂训练
小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
D
04
随堂训练
能证明某溶液中含有氯化钠的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.既出现A项中的现象,又出现C项中的现象
D
04
随堂训练
如图所示是某化学兴趣小组根据教材知识设计的能说明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
A.甲为Na2CO3,乙为NaHCO3
B.要证明NaHCO3受热能产生水,可在小试管内放置沾有
少量无水硫酸铜粉末的棉花球
C.加热不久就能看到B烧杯中的澄清石灰水变浑浊
D.整个实验过程中A烧杯中的澄清石灰水无明显变化
A
04
随堂训练
Na2CO3和NaHCO3是重要的化工原料,请回答:
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别________
________________、___________________________________________。
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式______________
_________________________。
(3)Na2CO3和NaHCO3的焰色试验分别为________色、________色。
(4)检验某盐中含有钾元素的方法是__________________________________,
具体操作为_______________________________________________________。
04
随堂训练
(1)碳酸钠和碳酸氢钠与盐酸反应都生成二氧化碳、氯化钠和水,根据离子方程式的书写原则书写离子方程式;(2)碳酸钠溶液中通入二氧化碳反应生成碳酸氢钠;(3)钠元素的焰色试验的火焰为黄色;(4)利用焰色试验证明钾元素的存在。
答案:(1)CO32- +2H+===CO2↑+H2O HCO3- +H+===CO2↑+H2O
(2) Na2CO3+CO2+H2O ===2NaHCO3 (3)黄 黄(4)焰色试验 用洁净的铂丝蘸取样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,有紫色火焰则证明样品含有钾元素
04
随堂训练
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),加入适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
D
04
随堂训练
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
A.溶液呈碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.受热易分解
D
04
随堂训练
如图装置所示,试管中盛有水,气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将出现的现象是( )
A.U形管内红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:dC
THANK
YOU
第一节 钠及其化合物
第三课时
碳酸钠与碳酸氢钠及焰色反应
第二章 海水中的重要元素
目录
o1.碳酸钠与碳酸氢钠
o2.碳酸铵与碳酸氢钠的性质比较及相互转化
o3.焰色试验
o1
碳酸钠与碳酸氢铵
01
碳酸钠与碳酸氢钠
1.用途:
碳酸钠:造纸、纺织、石油、合成洗涤剂、制玻璃、肥皂。
碳酸氢钠:发酵粉、治疗胃酸过多。
2.物理性质:
(1)碳酸钠俗名纯碱,为白色粉末,易溶于水,水溶液显碱性,遇少量水变成晶体(水合碳酸钠,化学式为Na2CO3·XH2O)
(2)碳酸氢钠俗名小苏打,为细小白色晶体,水中易溶,但比Na2CO3的溶解度小。加少量水溶解吸热,溶液呈碱性。
01
碳酸钠与碳酸氢钠
3.化学性质:
(1)装置
(2)现象
加热碳酸氢钠时澄清石灰水变浑浊,加热碳酸钠时澄清石灰水不变浑浊。
结论:(1)碳酸钠很稳定,受热不易发生分解;碳酸氢钠不稳定,受热容易分解,化学方程式:
(2)可利用加热的方法来鉴别碳酸钠和碳酸氢钠。
01
碳酸钠与碳酸氢钠
教材中描述“碳酸钠晶体在干燥空气里逐渐失去结晶水变成碳酸钠粉末”,该变化是物理变化还是化学变化?
化学变化
01
碳酸钠与碳酸氢钠
面包松软可口,深受人们喜爱,这么好的食物离不开一种物质——发酵粉。发酵粉主要用作面制品和膨化食品的生产。发酵粉的主要成分为碳酸氢钠和酒石酸。请分析碳酸氢钠在面包制作中的作用是什么?化学反应原理是什么?
发酵粉溶于水后,碳酸氢钠与酒石酸和食物里含有的酸性物质发生反应生成水和二氧化碳气体,二氧化碳可以起膨松食物的作用。
o2
碳酸钠与碳酸氢钠的性质比较及相互转化
02
碳酸钠与碳酸氢钠的性质比较及相互转化
苏打和小苏打是日常生活中的必需品,在生活和生产中有非常重要的应用。以下是NaHCO3及碳酸盐的一些用途及现象:
(1)碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一,我们发现,加入发酵粉的面团加热焙烤后体积比原来大了好多。
(2)碳酸氢钠干粉灭火器不能用来灭钠起火。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(1)你知道“加入发酵粉的面团加热焙烤后体积比原来大”的原因是什么吗?
(2)为什么“碳酸氢钠干粉灭火器不能用来灭钠起火”?
加热时碳酸氢钠发生反应为2NaHCO3=====Na2CO3+H2O+CO2↑,产生大量气体,从而使面包体积增大。
△
碳酸氢钠干粉灭火器是利用受热分解得到的二氧化碳灭火,而钠的燃烧产物过氧化钠可以和二氧化碳反应。所以碳酸氢钠干粉灭火器不能用来灭钠起火。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
碳酸钠、碳酸氢钠与常见物质的反应
(1)与盐酸反应
①碳酸钠
少量盐酸:Na2CO3 + HCl===NaHCO3 + NaCl;
过量盐酸:Na2CO3 + 2HCl===2NaCl+H2O+CO2↑。
②碳酸氢钠:NaHCO3 +HCl===NaCl+H2O+CO2↑。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(2)与NaOH反应
①碳酸钠不与NaOH反应;
②碳酸氢钠:NaHCO3+NaOH===Na2CO3+ H2O。
(3)与Ca(OH)2反应
①碳酸钠:Na2CO3 + Ca(OH)2===CaCO3↓+ 2NaOH。
②碳酸氢钠:NaHCO3(少量)+ Ca(OH)2===NaOH+ CaCO3↓+ H2O。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(4)与CO2反应
①碳酸钠:Na2CO3 + CO2+ H2O===2NaHCO3。
②碳酸氢钠不与CO2反应。
(5)与BaCl2反应
①碳酸钠:Na2CO3 + BaCl2===BaCO3↓+ 2NaCl。
②碳酸氢钠不与BaCl2反应。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
(1)若碳酸钠固体中混有少量碳酸氢钠,如何除去?
(2)Na2CO3溶液中混有NaHCO3,应该如何除去?
(3)碳酸氢钠溶液中混有少量碳酸钠,能否向溶液中滴加盐酸而除去?最好的方法是什么?
可采用加热的方法,碳酸氢钠分解生成碳酸钠。
加入适量NaOH溶液。发生反应为NaHCO3+NaOH===Na2CO3+H2O。
不能用滴加盐酸的方法,因为两种物质均能与盐酸反应,无法控制加入盐酸的量;可向溶液中通入CO2气体,发生反应Na2CO3+CO2+H2O===2NaHCO3,达到除去杂质的目的。
02
碳酸钠与碳酸氢钠的性质比较及相互转化
测定纯碱纯度的两种常见方法
气体法
沉淀法
发生反应Na2CO3+H2SO4===Na2SO4+H2O+CO2↑,依据CO2的体积确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的纯度。但要注意CO2中杂质的干扰。
发生反应Na2CO3+BaCl2===BaCO3↓+2NaCl,依据BaCO3沉淀的质量,确定Na2CO3的物质的量,进而确定纯碱中Na2CO3的纯度。
o3
焰色试验
03
焰色试验
实验步骤:
(1)烧:将洗净的铂丝(或光洁无锈的铁丝)在火焰上灼烧至与_________
______相同。
(2)蘸:蘸取碳酸钠或碳酸钾溶液。
(3)烧:在无色的外焰上灼烧,并观察_________。
(4)洗:再用_____洗净铂丝(或铁丝)。
(5)烧:在无色的外焰上烧至_____。
原来的火
焰颜色
火焰颜色
盐酸
无色
03
焰色试验
结论:
(1)某些金属及其化合物灼烧时火焰呈现出特征_____,根据呈现的特
征颜色,判断试样所含的_____元素,化学上把这样的_____分析操作称为焰色试
验。
(2)常见元素的焰色实验:钠——___色,钾——___色(要透过___________观察,
避免钠的黄色光干扰),钡——黄绿色,钙——砖红色。
颜色
金属
定性
黄
紫
蓝色钴玻璃
03
焰色试验
探究焰色试验的操作与应用
(1)五彩缤纷的烟花产生的原因是什么?
(2)除金属的化合物外,单质金属能不能也有同样的焰色试验?
(3)是不是所有的金属都有焰色试验?
烟花燃放时发生化学反应放热,不同的金属元素在加热条件下发生焰色试验,产生不同的火焰颜色。
能。因为焰色试验是金属元素的性质,无论是化合物还是单质,只要含有某种金属元素,这种物质就能有这种金属元素的焰色试验。
不是。并非所有金属都有焰色试验(Pt、Fe、Al、Ni、Cr、W等就没有)。
03
焰色试验
不一定。观察钾的焰色时需要透过蓝色钴玻璃,以滤去黄色光。
思考:
(1)用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察时火焰呈黄色,该无色溶液中一定不含K+吗?
(2)如何利用物理方法鉴别K2CO3溶液和Na2CO3溶液?
先用铂丝分别蘸取少量上述溶液,放到酒精灯上灼烧,看火焰颜色。若为黄色,为Na2CO3溶液;若透过蓝色钴玻璃观察为紫色,则为K2CO3溶液。
03
焰色试验
(3)焰色试验中使用铂丝的原因是什么?
(4)灼烧氯化钠和碳酸钠的火焰颜色是否相同?
金属铂不存在焰色试验。
相同。焰色试验是元素的性质,只要含有钠元素灼烧时火焰颜色就为黄色。
04
随堂训练
下列实验方案中,不能测定出Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是( )
A.取ag混合物充分加热,质量减少bg
B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体
C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液
D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg
C
04
随堂训练
比较是学习中最好用的方法之一。下列关于碳酸钠和碳酸氢钠的比较中,说法错误的是( )
A.热稳定性:碳酸钠大于碳酸氢钠
B.在其溶液中滴加澄清石灰水:它们都有白色沉淀生成
C.做焰色试验:它们的火焰都呈黄色
D.与相同浓度的盐酸反应产生CO2的速率:碳酸钠大于碳酸氢钠
D
04
随堂训练
有同学利用如图装置鉴别碳酸钠和碳酸氢钠的稳定性。点燃酒精灯,加热盛有固体药品的部位。请结合实验现象,完成下面的填空。
(1)[实验现象]加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的石灰水________,且固体附近的玻璃管内壁上附有大量的____________。
(2)[实验结论]该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有________。而盛有碳酸钠的长柄V形玻璃管里的石灰水____________。
04
随堂训练
加热开始后,很快可以看到,盛有碳酸氢钠的长柄V形玻璃管内的石灰水变浑浊,且固体附近的玻璃管内壁上附有大量的小液滴;该实验现象充分说明,碳酸氢钠受热易分解,并且分解的产物有二氧化碳和水。而盛有碳酸钠的长柄V形玻璃管里的石灰水不变浑浊。
答案:(1)变浑浊 小液滴
(2)二氧化碳和水 不变浑浊
04
随堂训练
下列有关焰色试验叙述错误的是( )
A.氯化钠在火焰上灼烧时,火焰呈黄色
B.焰色试验是金属单质的特性
C.连续做两个样品时,应将铂丝用盐酸洗净并灼烧至无色
D.可用洁净的铁丝代替铂丝做焰色试验
B
04
随堂训练
小明同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
D
04
随堂训练
能证明某溶液中含有氯化钠的是( )
A.焰色试验是黄色
B.溶液有咸味
C.取少量溶液于试管中,滴加稀硝酸酸化的硝酸银溶液,出现白色沉淀
D.既出现A项中的现象,又出现C项中的现象
D
04
随堂训练
如图所示是某化学兴趣小组根据教材知识设计的能说明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
A.甲为Na2CO3,乙为NaHCO3
B.要证明NaHCO3受热能产生水,可在小试管内放置沾有
少量无水硫酸铜粉末的棉花球
C.加热不久就能看到B烧杯中的澄清石灰水变浑浊
D.整个实验过程中A烧杯中的澄清石灰水无明显变化
A
04
随堂训练
Na2CO3和NaHCO3是重要的化工原料,请回答:
(1)两物质的水溶液分别与足量盐酸混合,反应的离子方程式分别________
________________、___________________________________________。
(2)除去NaHCO3溶液中少量Na2CO3的方法,写出化学方程式______________
_________________________。
(3)Na2CO3和NaHCO3的焰色试验分别为________色、________色。
(4)检验某盐中含有钾元素的方法是__________________________________,
具体操作为_______________________________________________________。
04
随堂训练
(1)碳酸钠和碳酸氢钠与盐酸反应都生成二氧化碳、氯化钠和水,根据离子方程式的书写原则书写离子方程式;(2)碳酸钠溶液中通入二氧化碳反应生成碳酸氢钠;(3)钠元素的焰色试验的火焰为黄色;(4)利用焰色试验证明钾元素的存在。
答案:(1)CO32- +2H+===CO2↑+H2O HCO3- +H+===CO2↑+H2O
(2) Na2CO3+CO2+H2O ===2NaHCO3 (3)黄 黄(4)焰色试验 用洁净的铂丝蘸取样品,在无色火焰上灼烧,透过蓝色钴玻璃观察,有紫色火焰则证明样品含有钾元素
04
随堂训练
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),加入适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
D
04
随堂训练
已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
A.溶液呈碱性
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.受热易分解
D
04
随堂训练
如图装置所示,试管中盛有水,气球a中盛有干燥的Na2O2颗粒。U形管中注有浅红色的水。将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,将出现的现象是( )
A.U形管内红水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:d
THANK
YOU
