3.2.1 铁合金 铝和铝合金 新型合金(教学课件42张)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 3.2.1 铁合金 铝和铝合金 新型合金(教学课件42张)—2023-2024学年高中化学人教版-2019·高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 08:31:28 | ||
图片预览









文档简介
(共41张PPT)
第三章 铁 金属材料
第二节 金属材料
第一课时 铁合金 铝和铝合金 新型合金
0.5 秒延迟符,无
意义,可删除.
学习目标
1.认识合金的组成及特性,深入了解常见铁合金、铝合金、新型合金的组成及用途。
2.结合生活中铝制品的使用,认识氧化膜对铝制品的保护作用,通过实验探究认识铝、氧化铝的两性。
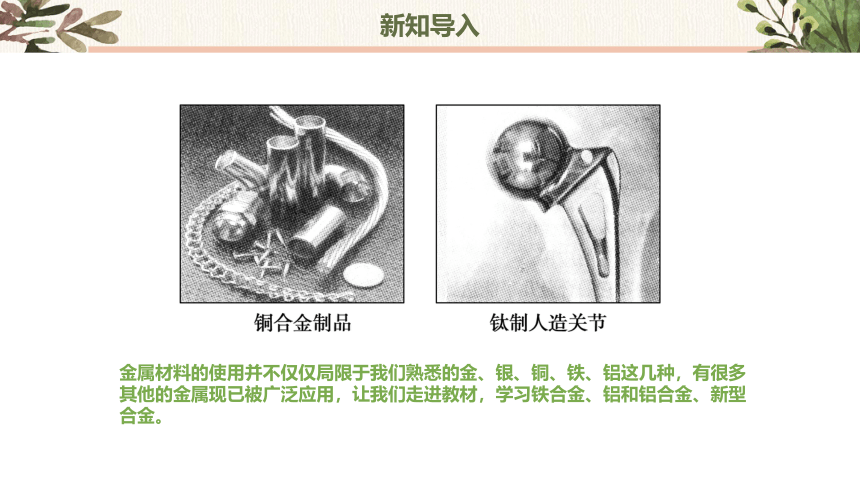
金属材料的使用并不仅仅局限于我们熟悉的金、银、铜、铁、铝这几种,有很多其他的金属现已被广泛应用,让我们走进教材,学习铁合金、铝和铝合金、新型合金。
新知导入
知识回顾
1.金属具有许多共同的物理性质,如不透明、有金属光泽、___________、___________、有_________性。
2.生产生活中应用较多的合金是_____________,历史上应用最早的金属是_________。
易导电
易导热
延展
生铁和钢
铜
初步认识
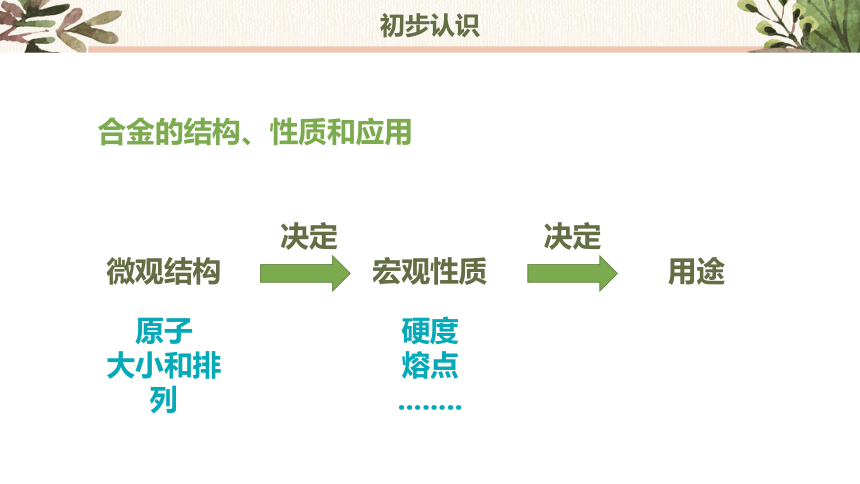
合金的结构、性质和应用
宏观性质
硬度
熔点
........
微观结构
原子
大小和排列
决定
决定
用途
0.5 秒延迟符,无
意义,可删除.
新知学习
一、合金的概念和特性
概念 由两种或两种以上的________(或________________)熔合而成的具有________特性的物质
性能 硬度 硬度一般________它的纯金属成分
熔点 熔点一般________它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能
金属
金属与非金属
金属
大于
低于
0.5 秒延迟符,无
意义,可删除.
新知学习
二、铁合金
1.铁合金的分类
铁合金 分类 含碳量 性能 用途
生铁 2%~ 4.3% ________大、抗压,性脆、可铸造成型 制造________和管道等
钢 0.03% ~2% 良好的________性,机械性能好,可锻轧和铸造 制造机械和交通工具
硬度
机座
延展
0.5 秒延迟符,无
意义,可删除.
新知学习
2.钢的分类
(1)钢是用量__________、用途最广的合金,根据其化学成分,分为:___________和_____________。
(2)碳素钢
a:低碳钢(含碳量低于0.3%):__________、焊接性好,但强度低,用于_________、钢丝、钢管等。
b:中碳钢(含碳量为_____________):强度高,韧性及加工性好,用于制造_________、车轮和建材等。
c:高碳钢(含碳量高于0.6%):___________,热处理后________好,用于制造器械、____________、刀具等。
最大
碳素钢
合金钢
韧性
钢板
0.3%~0.6%
钢轨
硬而脆
弹性
弹簧
0.5 秒延迟符,无
意义,可删除.
新知学习
(3)合金钢
①又叫特种钢,特殊性能:强度、__________大,可塑性、________好,耐磨,_____________等。
②不锈钢
合金元素 性能 用途
主要是 Cr、Ni 在大气中稳定,不容易生锈,具有很强的__________能力 制造________器材、厨房用具和餐具;地铁列车的车体等
硬度
韧性
耐腐蚀
抗腐蚀
医疗
0.5 秒延迟符,无
意义,可删除.
新知学习
三、铝和铝合金
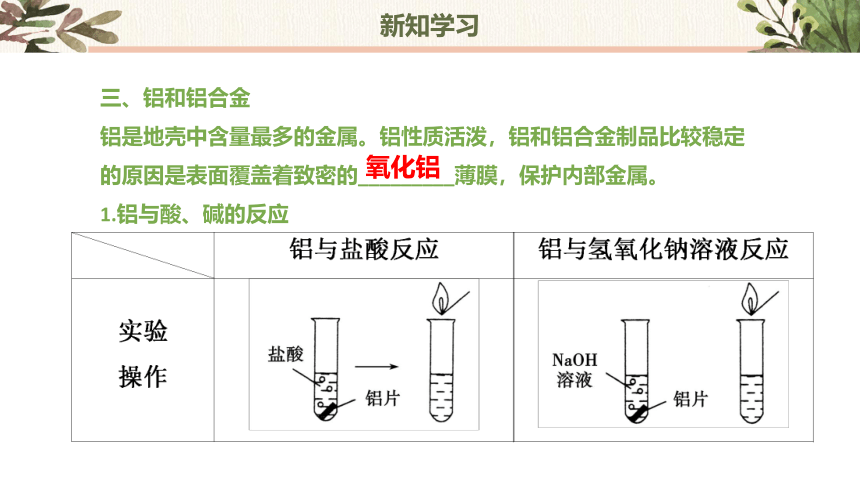
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的_________薄膜,保护内部金属。
1.铝与酸、碱的反应
氧化铝
新知学习
铝与盐酸反应 铝与氢氧化钠溶液反应
实验 现象 铝片____________,有无色气泡冒出,将点燃的木条放在试管口有__________
化学方 程式 ____________________________ ________________________________________
离子方 程式 ____________________________ _______________________________________
实验 结论 铝既能与盐酸反应,又能与氢氧化钠溶液反应,都产生________
逐渐溶解
爆鸣声
2Al+6HCl===2AlCl3+3H2↑
2Al+2H2O+2NaOH=== 2NaAlO2+3H2↑
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O=== 2AlO+3H2↑
氢气
新知学习
2.氧化铝与酸、碱的反应
(1)两性氧化物:既能与酸反应生成___________,又能与碱反应生成______________的氧化物,如Al2O3.
(2)氧化铝的两性
盐和水
盐和水
新知学习
3.铝合金
(1)铝合金中的合金元素有:_________、__________、Si、Mn、Zn及__________________等。
(2)硬铝
Cu
Mg
稀土元素
合金元素 性能 用途
Cu、Mg、 Mn、Si ________小、强度高、抗腐蚀能力较强 制造________、宇宙飞船
密度
飞机
新知学习
(3)稀土元素
包含元素:镧系元素(从镧到镥),原子序数从57~71的15种元素及____________、_________共17种元素。
点拨:稀土元素成为冶金工业的维生素,因为在合金中加入适量稀土元素,能大大改善合金的性能。
(4)铝合金用途是制造飞机和宇宙飞船的理想材料。
钪
钇
新知学习
四、新型合金
储氢合金,记忆合金,钛合金,耐热合金.......
“蛟龙号”载人潜水器
钛合金
储氢合金
La-Ni合金
新知学习
了解储氢合金工作原理
常温、常压吸收H2
升温或减压释放H2
储氢合金
金属氢化物
深入认识
合金的结构、性质和应用
性质
物理、化学、机械性能
熔合条件
组成结构
元素
种类、含量
决定
决定
用途
时间、温度等
相应
应用领域
0.5 秒延迟符,无
意义,可删除.
铝的物理性质
具有金属光泽,良好的延展性,密度小,质地软,是电、热的良导体。
“硬铝”(含Cu4%、Mg0.5%、Mn0.5%、Si0.7%的铝合金)
0.5 秒延迟符,无
意义,可删除.
铝的性质
铝的性质
原子结构
物质类别
0.5 秒延迟符,无
意义,可删除.
铝的化学性质
1.与非金属反应
4Al+3O2====2Al2O3
2.与酸反应
2Al+6H+===2Al3++3H2↑
3.与盐溶液反应
2Al+3Cu2+===2Al3++3Cu
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
问题探究:
1.厨房中能够用铝制容器长时间存放食醋吗?
2.根据铝的性质分析,如何除去镁粉中的铝粉
1.不能,因为铝能与醋酸反应。
2.将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
铝片与盐酸和氢氧化钠溶液反应的对比
实验操作
实验现象
试管中有气泡冒出,铝片慢慢溶解;点燃的木条放在试管口时发出爆鸣声
试管中有气泡冒出,铝片慢慢溶解;点燃的木条放在试管口时发出爆鸣声
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
铝片与盐酸和氢氧化钠溶液反应的对比
有关化学方程式
化学方程式:
2Al+6HCl===2AlCl3+3H2↑
化学方程式:
2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
离子方程式:
2Al+6H+===2Al3++3H2↑
离子方程式:
2Al+2OH-+2H2O=== 2AlO2-+3H2↑
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液反应的定量关系
铝与盐酸、NaOH溶液反应的定量关系
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O===2AlO-+3H2↑
1.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
2.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为VHCl(H2)∶VNaOH(H2)=1∶1。
3.足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为VHCl(H2)∶VNaOH(H2)=1∶3。
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液反应的定量关系
4.一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为1∶35.铝既能与非氧化性酸反应产生氢气,也能与碱反应产生氢气,前者是置换反应,后者不是置换反应。
6.铝与盐酸、氢氧化钠的反应中,还原剂都是铝,还原产物都是氢气,故铝与产生氢气的关系式是相同的。
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
(1)物理性质
Al(OH)3是白色固体,几乎不溶于水,但能凝聚水中的悬浮物,并能吸附色素。
(2)化学性质
①两性氢氧化物:像Al(OH)3这样既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物。
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
2.既能与酸反应,又能与碱反应的物质有:(1)某些金属,如Al;(2)两性氧化物,如Al2O3;(3)两性氢氧化物,如Al(OH)3;(4)弱酸的酸式盐,如NaHCO3、NaHS、NaHSO3、Na2HPO4;(5)弱酸的铵盐,如(NH4)2S、(NH4)2CO3、CH3COONH4、NH4HCO3。
铝三角
0.5 秒延迟符,无
意义,可删除.
随堂训练
沈括根据变法需要,悉心总结了兵器制作技术。《梦溪笔谈·器用》中记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。剑之钢者,刃多毁缺,巨阙是也,故不可纯用剂钢。”以所学合金的知识,分析古人铸剑时剑身的材料为( )
A.钢 B.生铁
C.青铜 D.白铜
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
下列有关厨房铝制品的使用中,你认为合理的是 ( )
A.盛放食醋 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
B
0.5 秒延迟符,无
意义,可删除.
随堂训练
下列关于合金的说法正确的是 ( )
A.合金中可能含有非金属元素
B.合金中至少含有两种金属元素
C.铜合金是纯净物
D.合金中的金属元素以化合态的形式存在
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
2019年10月24日,中国第5架国产大飞机C919大型客机完成首次试验飞行成功。C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是 ( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D
0.5 秒延迟符,无
意义,可删除.
随堂训练
合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·L-1的NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为 ( )
A.1∶1 B.2∶3
C.3∶2 D.3∶1
B
0.5 秒延迟符,无
意义,可删除.
随堂训练
足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是 ( )
A.盐酸 B.稀硫酸
C.氢氧化钠溶液 D.氯化钠溶液
C
0.5 秒延迟符,无
意义,可删除.
随堂训练
已知单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转化关系,其中A为常见金属,C为密度最小的气体,甲是一种高熔点的物质,丙常温下是一种液体。
0.5 秒延迟符,无
意义,可删除.
随堂训练
根据以上转化关系回答:
(1)写出下列物质的化学式:
A______;B______;乙__________;丁_____________。
(2)①写出A与NaOH溶液反应的化学方程式:
________________________________________。
②写出甲与NaOH溶液反应的离子方程式:
_________________________________。
(3)将一定量的A加入NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为_____________,转移电子的物质的量为_____________。
Al
O2
NaAlO2
Al(OH)3
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2O3+2OH-===2AlO+H2O
0.1 mol
0.3 mol
0.5 秒延迟符,无
意义,可删除.
随堂训练
铝既能与硫酸溶液反应,又能与烧碱溶液反应,下列说法不正确的是( )
A.两个反应都是氧化还原反应
B.铝与硫酸反应时,硫酸作氧化剂
C.铝与烧碱溶液反应时,氢氧化钠作氧化剂
D.两个反应都有气体生成
C
0.5 秒延迟符,无
意义,可删除.
随堂训练
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为a g,则原合金中铁的质量分数为 ( )
A.70% B.52.4%
C.47.6% D.30%
A
感谢观看
THANK YOU
第三章 铁 金属材料
第二节 金属材料
第一课时 铁合金 铝和铝合金 新型合金
0.5 秒延迟符,无
意义,可删除.
学习目标
1.认识合金的组成及特性,深入了解常见铁合金、铝合金、新型合金的组成及用途。
2.结合生活中铝制品的使用,认识氧化膜对铝制品的保护作用,通过实验探究认识铝、氧化铝的两性。
金属材料的使用并不仅仅局限于我们熟悉的金、银、铜、铁、铝这几种,有很多其他的金属现已被广泛应用,让我们走进教材,学习铁合金、铝和铝合金、新型合金。
新知导入
知识回顾
1.金属具有许多共同的物理性质,如不透明、有金属光泽、___________、___________、有_________性。
2.生产生活中应用较多的合金是_____________,历史上应用最早的金属是_________。
易导电
易导热
延展
生铁和钢
铜
初步认识
合金的结构、性质和应用
宏观性质
硬度
熔点
........
微观结构
原子
大小和排列
决定
决定
用途
0.5 秒延迟符,无
意义,可删除.
新知学习
一、合金的概念和特性
概念 由两种或两种以上的________(或________________)熔合而成的具有________特性的物质
性能 硬度 硬度一般________它的纯金属成分
熔点 熔点一般________它的成分金属
与纯金属材料相比,合金具有优良的物理、化学或机械性能
金属
金属与非金属
金属
大于
低于
0.5 秒延迟符,无
意义,可删除.
新知学习
二、铁合金
1.铁合金的分类
铁合金 分类 含碳量 性能 用途
生铁 2%~ 4.3% ________大、抗压,性脆、可铸造成型 制造________和管道等
钢 0.03% ~2% 良好的________性,机械性能好,可锻轧和铸造 制造机械和交通工具
硬度
机座
延展
0.5 秒延迟符,无
意义,可删除.
新知学习
2.钢的分类
(1)钢是用量__________、用途最广的合金,根据其化学成分,分为:___________和_____________。
(2)碳素钢
a:低碳钢(含碳量低于0.3%):__________、焊接性好,但强度低,用于_________、钢丝、钢管等。
b:中碳钢(含碳量为_____________):强度高,韧性及加工性好,用于制造_________、车轮和建材等。
c:高碳钢(含碳量高于0.6%):___________,热处理后________好,用于制造器械、____________、刀具等。
最大
碳素钢
合金钢
韧性
钢板
0.3%~0.6%
钢轨
硬而脆
弹性
弹簧
0.5 秒延迟符,无
意义,可删除.
新知学习
(3)合金钢
①又叫特种钢,特殊性能:强度、__________大,可塑性、________好,耐磨,_____________等。
②不锈钢
合金元素 性能 用途
主要是 Cr、Ni 在大气中稳定,不容易生锈,具有很强的__________能力 制造________器材、厨房用具和餐具;地铁列车的车体等
硬度
韧性
耐腐蚀
抗腐蚀
医疗
0.5 秒延迟符,无
意义,可删除.
新知学习
三、铝和铝合金
铝是地壳中含量最多的金属。铝性质活泼,铝和铝合金制品比较稳定的原因是表面覆盖着致密的_________薄膜,保护内部金属。
1.铝与酸、碱的反应
氧化铝
新知学习
铝与盐酸反应 铝与氢氧化钠溶液反应
实验 现象 铝片____________,有无色气泡冒出,将点燃的木条放在试管口有__________
化学方 程式 ____________________________ ________________________________________
离子方 程式 ____________________________ _______________________________________
实验 结论 铝既能与盐酸反应,又能与氢氧化钠溶液反应,都产生________
逐渐溶解
爆鸣声
2Al+6HCl===2AlCl3+3H2↑
2Al+2H2O+2NaOH=== 2NaAlO2+3H2↑
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O=== 2AlO+3H2↑
氢气
新知学习
2.氧化铝与酸、碱的反应
(1)两性氧化物:既能与酸反应生成___________,又能与碱反应生成______________的氧化物,如Al2O3.
(2)氧化铝的两性
盐和水
盐和水
新知学习
3.铝合金
(1)铝合金中的合金元素有:_________、__________、Si、Mn、Zn及__________________等。
(2)硬铝
Cu
Mg
稀土元素
合金元素 性能 用途
Cu、Mg、 Mn、Si ________小、强度高、抗腐蚀能力较强 制造________、宇宙飞船
密度
飞机
新知学习
(3)稀土元素
包含元素:镧系元素(从镧到镥),原子序数从57~71的15种元素及____________、_________共17种元素。
点拨:稀土元素成为冶金工业的维生素,因为在合金中加入适量稀土元素,能大大改善合金的性能。
(4)铝合金用途是制造飞机和宇宙飞船的理想材料。
钪
钇
新知学习
四、新型合金
储氢合金,记忆合金,钛合金,耐热合金.......
“蛟龙号”载人潜水器
钛合金
储氢合金
La-Ni合金
新知学习
了解储氢合金工作原理
常温、常压吸收H2
升温或减压释放H2
储氢合金
金属氢化物
深入认识
合金的结构、性质和应用
性质
物理、化学、机械性能
熔合条件
组成结构
元素
种类、含量
决定
决定
用途
时间、温度等
相应
应用领域
0.5 秒延迟符,无
意义,可删除.
铝的物理性质
具有金属光泽,良好的延展性,密度小,质地软,是电、热的良导体。
“硬铝”(含Cu4%、Mg0.5%、Mn0.5%、Si0.7%的铝合金)
0.5 秒延迟符,无
意义,可删除.
铝的性质
铝的性质
原子结构
物质类别
0.5 秒延迟符,无
意义,可删除.
铝的化学性质
1.与非金属反应
4Al+3O2====2Al2O3
2.与酸反应
2Al+6H+===2Al3++3H2↑
3.与盐溶液反应
2Al+3Cu2+===2Al3++3Cu
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
问题探究:
1.厨房中能够用铝制容器长时间存放食醋吗?
2.根据铝的性质分析,如何除去镁粉中的铝粉
1.不能,因为铝能与醋酸反应。
2.将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
铝片与盐酸和氢氧化钠溶液反应的对比
实验操作
实验现象
试管中有气泡冒出,铝片慢慢溶解;点燃的木条放在试管口时发出爆鸣声
试管中有气泡冒出,铝片慢慢溶解;点燃的木条放在试管口时发出爆鸣声
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液的反应
铝片与盐酸和氢氧化钠溶液反应的对比
有关化学方程式
化学方程式:
2Al+6HCl===2AlCl3+3H2↑
化学方程式:
2Al+2NaOH+2H2O=== 2NaAlO2+3H2↑
离子方程式:
2Al+6H+===2Al3++3H2↑
离子方程式:
2Al+2OH-+2H2O=== 2AlO2-+3H2↑
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液反应的定量关系
铝与盐酸、NaOH溶液反应的定量关系
2Al+6H+===2Al3++3H2↑
2Al+2OH-+2H2O===2AlO-+3H2↑
1.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
2.等量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为VHCl(H2)∶VNaOH(H2)=1∶1。
3.足量的铝分别与等物质的量的盐酸和氢氧化钠溶液反应,产生氢气的体积比为VHCl(H2)∶VNaOH(H2)=1∶3。
0.5 秒延迟符,无
意义,可删除.
铝与盐酸、NaOH溶液反应的定量关系
4.一定量的铝分别与一定量的盐酸和氢氧化钠溶液反应,若产生氢气的体积比为1∶3
6.铝与盐酸、氢氧化钠的反应中,还原剂都是铝,还原产物都是氢气,故铝与产生氢气的关系式是相同的。
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
(1)物理性质
Al(OH)3是白色固体,几乎不溶于水,但能凝聚水中的悬浮物,并能吸附色素。
(2)化学性质
①两性氢氧化物:像Al(OH)3这样既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物。
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
0.5 秒延迟符,无
意义,可删除.
氢氧化铝
2.既能与酸反应,又能与碱反应的物质有:(1)某些金属,如Al;(2)两性氧化物,如Al2O3;(3)两性氢氧化物,如Al(OH)3;(4)弱酸的酸式盐,如NaHCO3、NaHS、NaHSO3、Na2HPO4;(5)弱酸的铵盐,如(NH4)2S、(NH4)2CO3、CH3COONH4、NH4HCO3。
铝三角
0.5 秒延迟符,无
意义,可删除.
随堂训练
沈括根据变法需要,悉心总结了兵器制作技术。《梦溪笔谈·器用》中记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折。剑之钢者,刃多毁缺,巨阙是也,故不可纯用剂钢。”以所学合金的知识,分析古人铸剑时剑身的材料为( )
A.钢 B.生铁
C.青铜 D.白铜
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
下列有关厨房铝制品的使用中,你认为合理的是 ( )
A.盛放食醋 B.烧煮开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
B
0.5 秒延迟符,无
意义,可删除.
随堂训练
下列关于合金的说法正确的是 ( )
A.合金中可能含有非金属元素
B.合金中至少含有两种金属元素
C.铜合金是纯净物
D.合金中的金属元素以化合态的形式存在
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
2019年10月24日,中国第5架国产大飞机C919大型客机完成首次试验飞行成功。C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是 ( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
D
0.5 秒延迟符,无
意义,可删除.
随堂训练
合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
A
0.5 秒延迟符,无
意义,可删除.
随堂训练
甲、乙两个烧杯中分别盛有100 mL 4.0 mol·L-1的盐酸和100 mL 4.0 mol·L-1的NaOH溶液,向两个烧杯中均加入5.4 g铝粉,在相同状况下产生气体的体积比为 ( )
A.1∶1 B.2∶3
C.3∶2 D.3∶1
B
0.5 秒延迟符,无
意义,可删除.
随堂训练
足量下列物质与相同质量的铝反应,放出氢气且消耗溶质物质的量最少的是 ( )
A.盐酸 B.稀硫酸
C.氢氧化钠溶液 D.氯化钠溶液
C
0.5 秒延迟符,无
意义,可删除.
随堂训练
已知单质A、B、C和甲、乙、丙、丁四种化合物有下图所示的转化关系,其中A为常见金属,C为密度最小的气体,甲是一种高熔点的物质,丙常温下是一种液体。
0.5 秒延迟符,无
意义,可删除.
随堂训练
根据以上转化关系回答:
(1)写出下列物质的化学式:
A______;B______;乙__________;丁_____________。
(2)①写出A与NaOH溶液反应的化学方程式:
________________________________________。
②写出甲与NaOH溶液反应的离子方程式:
_________________________________。
(3)将一定量的A加入NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为_____________,转移电子的物质的量为_____________。
Al
O2
NaAlO2
Al(OH)3
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2O3+2OH-===2AlO+H2O
0.1 mol
0.3 mol
0.5 秒延迟符,无
意义,可删除.
随堂训练
铝既能与硫酸溶液反应,又能与烧碱溶液反应,下列说法不正确的是( )
A.两个反应都是氧化还原反应
B.铝与硫酸反应时,硫酸作氧化剂
C.铝与烧碱溶液反应时,氢氧化钠作氧化剂
D.两个反应都有气体生成
C
0.5 秒延迟符,无
意义,可删除.
随堂训练
把a g铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红色粉末的质量仍为a g,则原合金中铁的质量分数为 ( )
A.70% B.52.4%
C.47.6% D.30%
A
感谢观看
THANK YOU
