4.1.1 原子结构(教学课件)(33张)2023-2024学年人教版(2019)必修一
文档属性
| 名称 | 4.1.1 原子结构(教学课件)(33张)2023-2024学年人教版(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 944.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:00:00 | ||
图片预览







文档简介
(共33张PPT)
第四单元 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时
原子结构
学习目标
1.回顾初中所学原子结构知识,了解核外电子能量高低与分层排布的关系;
2.依据稀有气体元素原子的电子排布,总结出核外电子排布规律,学会书写简单原子结构示意图。
旧知回顾
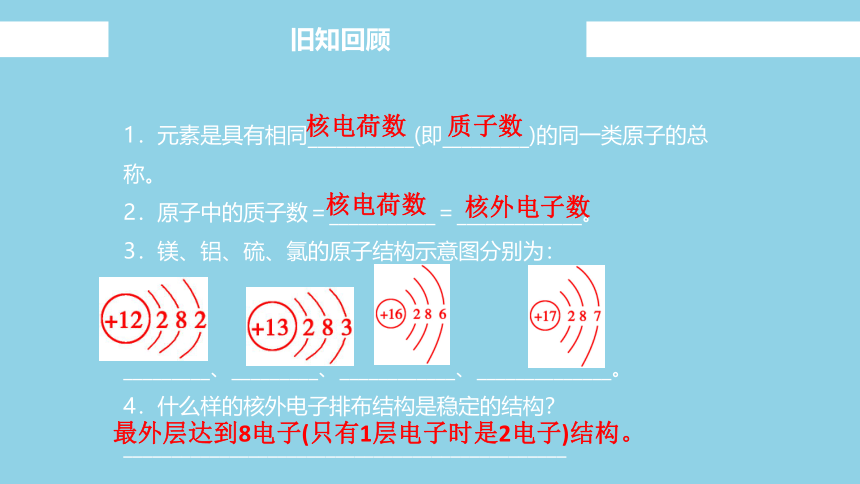
1.元素是具有相同___________(即_________)的同一类原子的总称。
2.原子中的质子数=___________=_____________。
3.镁、铝、硫、氯的原子结构示意图分别为:
_________、_________、____________、______________。
4.什么样的核外电子排布结构是稳定的结构?
______________________________________________
核电荷数
质子数
核外电子数
核电荷数
最外层达到8电子(只有1层电子时是2电子)结构。
旧知回顾
观察图片,想到了什么?
1.原子是由居于原子中心的原子核和核外电子构成的;
2.原子核由质子和中子构成;
3.原子核带正电荷,电子带负电荷。
一、原子结构
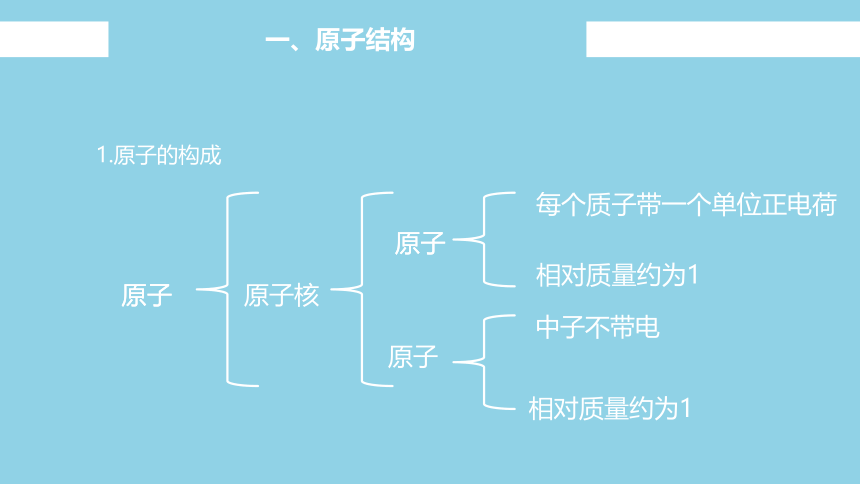
1.原子的构成
原子
原子核
原子
原子
原子
原子
每个质子带一个单位正电荷
相对质量约为1
中子不带电
相对质量约为1
一、原子结构
原子
核外电子
原子
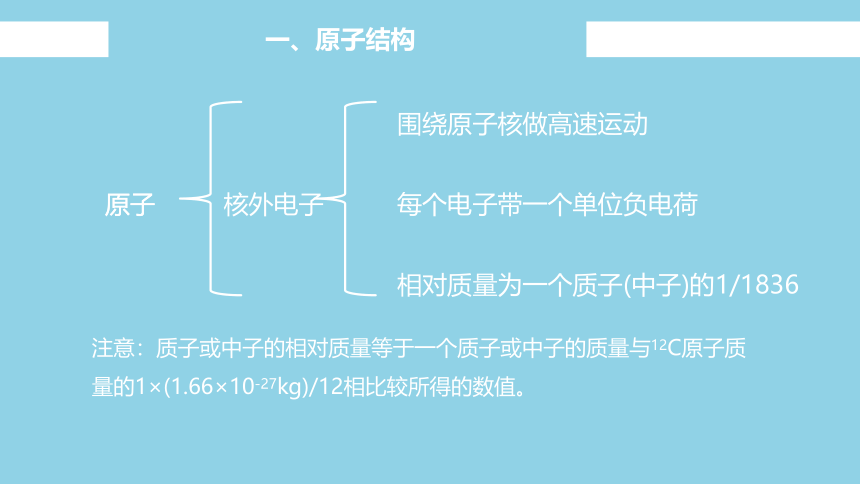
围绕原子核做高速运动
每个电子带一个单位负电荷
相对质量为一个质子(中子)的1/1836
注意:质子或中子的相对质量等于一个质子或中子的质量与12C原子质量的1×(1.66×10-27kg)/12相比较所得的数值。
一、原子结构
2.质量数
(1)概念:质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有_______和_______的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)=_______________________
质子
中子
质子数(Z)+中子数(N)
二、核外电子排布
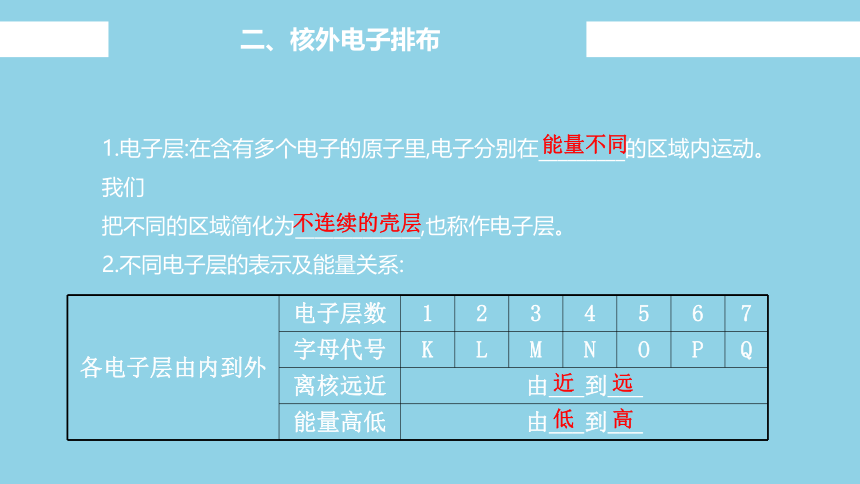
1.电子层:在含有多个电子的原子里,电子分别在_________的区域内运动。我们
把不同的区域简化为_____________,也称作电子层。
2.不同电子层的表示及能量关系:
能量不同
不连续的壳层
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由___到___
能量高低 由___到___
近
远
低
高
二、核外电子排布
3.电子分层排布:
(1)能量最低原理
核外电子总是优先排布在_________的电子层里,然后再由里往外排布在______________的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①第n层最多容纳___个电子。如K、L、M、N层最多容纳电子数分别为______________。
②最外层电子数目最多不能超过__个(K层为最外层时不能超过__个)。
③次外层最多能容纳的电子数不超过___个。
能量最低
能量逐步升高
2n2
2、8、18、32
8
2
18
二、核外电子排布
4.原子结构模型的演变
年代 模型 观点或理论
1803年 道尔顿模型 原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
1904年 汤姆孙模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
二、核外电子排布
年代 模型 观点或理论
1911年 卢瑟福原子模型 在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
1913年 玻尔原子模型 电子在原子核外空间的一定轨道上绕核做高速圆周运动。
1926~1935年 电子云 模型 电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
注意:电子云模型理论认为电子在原子核外运动没有固定的轨道。
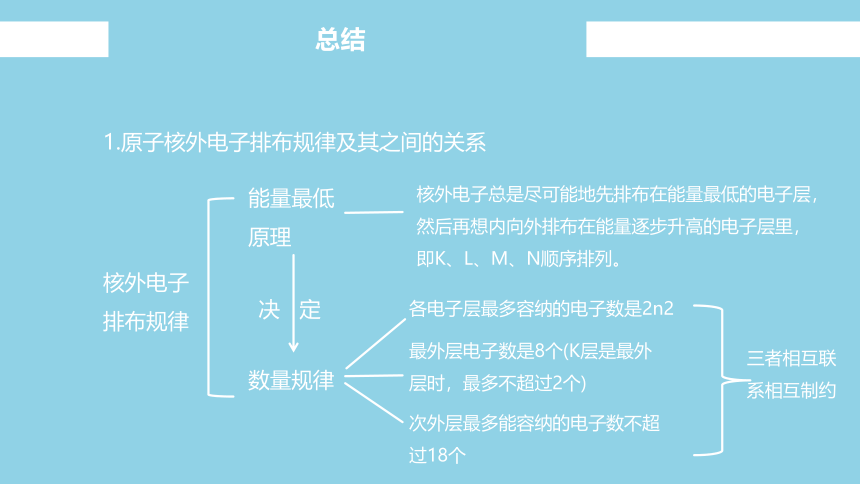
总结
1.原子核外电子排布规律及其之间的关系
核外电子排布规律
能量最低原理
数量规律
决 定
核外电子总是尽可能地先排布在能量最低的电子层,然后再想内向外排布在能量逐步升高的电子层里,即K、L、M、N顺序排列。
各电子层最多容纳的电子数是2n2
最外层电子数是8个(K层是最外层时,最多不超过2个)
次外层最多能容纳的电子数不超过18个
三者相互联系相互制约
总结
2.原子核外电子排布的表示方法
(1)原子结构示意图。
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
总结
(2)离子结构示意图。
①当主族中的金属元素原子失去最外层所有的电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构。
如
总结
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
如
总结
1~20号元素原子核外电子排布特征
1.最外层电子数为1的原子有H、Li、Na、K。
2.最外层电子数为2的原子有He、Be、Mg、Ca。
3.原子最外层电子数与次外层电子数存在倍数关系:
(1)最外层电子数与次外层电子数相等的原子有Be、Ar。
(2)最外层电子数是次外层电子数2倍的原子是C。
(3)最外层电子数是次外层电子数3倍的原子是O。
(4)最外层电子数是次外层电子数4倍的原子是Ne。
(5)次外层电子数是最外层电子数2倍的原子有Li、Si。
总结
4.原子最外层电子数与其他相关数的关系:
(1)内层电子总数是最外层电子数2倍的原子有Li、P。
(2)电子层数与最外层电子数相等的原子有H、Be、Al。
(3)电子层数是最外层电子数2倍的原子有Li、Ca。
(4)电子层数是最外层电子数3倍的原子是Na。
(5)最外层电子数是电子层数2倍的原子有He、C、S。
(6)最外层电子数是电子层数3倍的原子是O。
随堂训练
A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )
A.硅原子和钠原子 B.硼原子和氦原子
C.氯原子和碳原子 D.碳原子和铝原子
随堂训练
答案:D
解析:A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,说明A、B为第二、第三周期元素;L层最多排8个电子,B原子的L层电子数恰为A原子L层电子数的2倍,说明B原子的L层有8个电子,A原子的L层有4个电子,故A是碳原子;A原子的M层比B原子的M层少3个电子,故B为铝原子。
随堂训练
观察下列A、B、C、D、E五种粒子(原子或离子)的示意图,用化学用语回答下列有关问题。
(1)其中属于阴离子的是_______。
(2)其中化学性质最稳定的是_____。
O2-
Ne
随堂训练
(3)已知A元素的某种核素的中子数为18,该核素的符号是_______。
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该
元素的离子结构示意图为____________。
解析:(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+ ,则属于阴离子的是O2-。
(2)稀有气体元素的化学性质最稳定,所以性质最稳定的是Ne。
随堂训练
解析:(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+ ,则属于阴离子的是O2-。
(2)稀有气体元素的化学性质最稳定,所以性质最稳定的是Ne。
(3)已知A元素的某种核素的中子数为18,质子数为17,质量数=质子数+中子数=17+18=35,该核素的符号是3517Cl。
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,最外层电子为6个,则该元素核电荷数为16,为硫元素,该元素的离子为得到两个电子的阴离子,该元素的离子结构示意图为 。
随堂训练
下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③
C.①③ D.②④
随堂训练
答案:A;
解析:原子核外电子是分层运动的,能量越低离核越近,能量越高离核越远。
随堂训练
下列微粒结构示意图中,不正确的是 ( )
随堂训练
答案:B
解析:A中核电荷数和核外电子数都是8,这是氧原子的结构示意图,正确;B中核电荷数为11,这是Na的原子核,钠原子的核外有11个电子,钠元素的最高化合价为+1价,Na+的核外应有10个电子,而图中核外只有9个电子,错误;C中核电荷数和核外电子数都是17,这是氯原子的结构示意图,正确;D中核电荷数和核外电子数分别是17和18,这是Cl-的结构示意图,正确。
随堂训练
已知A、B、C三种元素的原子中,质子数为A(1)三种元素的名称和符号:A______,B_______,C_______。
(2)画出三种元素的原子结构示意图:
A________,B_________,C_____________。
碳C
硅Si
氯Cl
随堂训练
解析:由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
随堂训练
原子的构成示意图如图,下列叙述正确的是 ( )
A.原子是实心球体
B.质子、中子、电子均匀分布在原子中
C.质子与电子质量相等
D.整个原子的质量主要集中在原子核上
随堂训练
答案:D;
解析:原子不是实心的球体,故A错误;正中央有原子核,核外有电子围绕原子核运动,故B错误;一个电子的质量约为一个质子质量的1/1836 ,故C错误;整个原子的大部分质量集中在原子核上,原子核中有质子和中子,质子数=核电荷数=电子数,电子质量很少,忽略不计,故D正确。
随堂训练
下列说法中正确的是( )
A.有一种氢原子中的原子核中有2个中子,1个质子,则其质量数为3
B.钠原子和钠离子质量相差很大
C.在原子中质子数一定等于中子数
D.所有的原子都是由质子、中子、电子构成
随堂训练
答案:A;
解析:质量数=质子数+中子数,故A正确;钠原子失去1个电子形成钠离子,电子的质量很小,可以忽略,所以钠原子和钠离子的质量几乎相等,故B错误;在原子中质子数不一定等于中子数,例如2311Na中质子数就不等于中子数,故C错误;并不是所有的原子都是由质子、中子、电子构成,例如11 H中不含有中子,故D错误。
感谢观看
THANK YOU
第四单元 物质结构 元素周期律
第一节 原子结构与元素周期表
第一课时
原子结构
学习目标
1.回顾初中所学原子结构知识,了解核外电子能量高低与分层排布的关系;
2.依据稀有气体元素原子的电子排布,总结出核外电子排布规律,学会书写简单原子结构示意图。
旧知回顾
1.元素是具有相同___________(即_________)的同一类原子的总称。
2.原子中的质子数=___________=_____________。
3.镁、铝、硫、氯的原子结构示意图分别为:
_________、_________、____________、______________。
4.什么样的核外电子排布结构是稳定的结构?
______________________________________________
核电荷数
质子数
核外电子数
核电荷数
最外层达到8电子(只有1层电子时是2电子)结构。
旧知回顾
观察图片,想到了什么?
1.原子是由居于原子中心的原子核和核外电子构成的;
2.原子核由质子和中子构成;
3.原子核带正电荷,电子带负电荷。
一、原子结构
1.原子的构成
原子
原子核
原子
原子
原子
原子
每个质子带一个单位正电荷
相对质量约为1
中子不带电
相对质量约为1
一、原子结构
原子
核外电子
原子
围绕原子核做高速运动
每个电子带一个单位负电荷
相对质量为一个质子(中子)的1/1836
注意:质子或中子的相对质量等于一个质子或中子的质量与12C原子质量的1×(1.66×10-27kg)/12相比较所得的数值。
一、原子结构
2.质量数
(1)概念:质子和中子的相对质量都近似为1,忽略电子的质量,将原子核内所有_______和_______的相对质量取近似整数值相加,所得的数值叫做质量数。
(2)关系:质量数(A)=_______________________
质子
中子
质子数(Z)+中子数(N)
二、核外电子排布
1.电子层:在含有多个电子的原子里,电子分别在_________的区域内运动。我们
把不同的区域简化为_____________,也称作电子层。
2.不同电子层的表示及能量关系:
能量不同
不连续的壳层
各电子层由内到外 电子层数 1 2 3 4 5 6 7
字母代号 K L M N O P Q
离核远近 由___到___
能量高低 由___到___
近
远
低
高
二、核外电子排布
3.电子分层排布:
(1)能量最低原理
核外电子总是优先排布在_________的电子层里,然后再由里往外排布在______________的电子层里,即按K→L→M→N……顺序排列。
(2)电子层最多容纳的电子数
①第n层最多容纳___个电子。如K、L、M、N层最多容纳电子数分别为______________。
②最外层电子数目最多不能超过__个(K层为最外层时不能超过__个)。
③次外层最多能容纳的电子数不超过___个。
能量最低
能量逐步升高
2n2
2、8、18、32
8
2
18
二、核外电子排布
4.原子结构模型的演变
年代 模型 观点或理论
1803年 道尔顿模型 原子是构成物质的基本粒子,是坚实的、不可再分的实心球。
1904年 汤姆孙模型 原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了正电荷,从而形成了中性原子。
二、核外电子排布
年代 模型 观点或理论
1911年 卢瑟福原子模型 在原子的中心有一个带正电荷的核,它的质量几乎等于原子的全部质量,电子在它的周围沿着不同的轨道运转,就像行星环绕太阳运转一样。
1913年 玻尔原子模型 电子在原子核外空间的一定轨道上绕核做高速圆周运动。
1926~1935年 电子云 模型 电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
注意:电子云模型理论认为电子在原子核外运动没有固定的轨道。
总结
1.原子核外电子排布规律及其之间的关系
核外电子排布规律
能量最低原理
数量规律
决 定
核外电子总是尽可能地先排布在能量最低的电子层,然后再想内向外排布在能量逐步升高的电子层里,即K、L、M、N顺序排列。
各电子层最多容纳的电子数是2n2
最外层电子数是8个(K层是最外层时,最多不超过2个)
次外层最多能容纳的电子数不超过18个
三者相互联系相互制约
总结
2.原子核外电子排布的表示方法
(1)原子结构示意图。
①小圆圈和圆圈内的符号及数字表示原子核及核内质子数。
②弧线表示电子层。
③弧线内数字表示该层中的电子数。
总结
(2)离子结构示意图。
①当主族中的金属元素原子失去最外层所有的电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构。
如
总结
②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
如
总结
1~20号元素原子核外电子排布特征
1.最外层电子数为1的原子有H、Li、Na、K。
2.最外层电子数为2的原子有He、Be、Mg、Ca。
3.原子最外层电子数与次外层电子数存在倍数关系:
(1)最外层电子数与次外层电子数相等的原子有Be、Ar。
(2)最外层电子数是次外层电子数2倍的原子是C。
(3)最外层电子数是次外层电子数3倍的原子是O。
(4)最外层电子数是次外层电子数4倍的原子是Ne。
(5)次外层电子数是最外层电子数2倍的原子有Li、Si。
总结
4.原子最外层电子数与其他相关数的关系:
(1)内层电子总数是最外层电子数2倍的原子有Li、P。
(2)电子层数与最外层电子数相等的原子有H、Be、Al。
(3)电子层数是最外层电子数2倍的原子有Li、Ca。
(4)电子层数是最外层电子数3倍的原子是Na。
(5)最外层电子数是电子层数2倍的原子有He、C、S。
(6)最外层电子数是电子层数3倍的原子是O。
随堂训练
A、B两种原子,A的M电子层比B的M电子层少3个电子,B的L电子层电子数恰为A的L电子层电子数的2倍。A和B分别是( )
A.硅原子和钠原子 B.硼原子和氦原子
C.氯原子和碳原子 D.碳原子和铝原子
随堂训练
答案:D
解析:A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,说明A、B为第二、第三周期元素;L层最多排8个电子,B原子的L层电子数恰为A原子L层电子数的2倍,说明B原子的L层有8个电子,A原子的L层有4个电子,故A是碳原子;A原子的M层比B原子的M层少3个电子,故B为铝原子。
随堂训练
观察下列A、B、C、D、E五种粒子(原子或离子)的示意图,用化学用语回答下列有关问题。
(1)其中属于阴离子的是_______。
(2)其中化学性质最稳定的是_____。
O2-
Ne
随堂训练
(3)已知A元素的某种核素的中子数为18,该核素的符号是_______。
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,该
元素的离子结构示意图为____________。
解析:(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+ ,则属于阴离子的是O2-。
(2)稀有气体元素的化学性质最稳定,所以性质最稳定的是Ne。
随堂训练
解析:(1)原子或离子结构示意图中,如果核内质子数不等于核外电子数,则该结构示意图为离子结构示意图,如果核外电子数等于核内质子数,则为原子结构示意图,A、B、C、D、E分别是Cl、O2-、Ne、Na、Mg2+ ,则属于阴离子的是O2-。
(2)稀有气体元素的化学性质最稳定,所以性质最稳定的是Ne。
(3)已知A元素的某种核素的中子数为18,质子数为17,质量数=质子数+中子数=17+18=35,该核素的符号是3517Cl。
(4)某元素的原子核外有3个电子层,最外层比次外层少2个电子,最外层电子为6个,则该元素核电荷数为16,为硫元素,该元素的离子为得到两个电子的阴离子,该元素的离子结构示意图为 。
随堂训练
下面关于多电子原子的核外电子的运动规律的叙述正确的是( )
①核外电子是分层运动的
②所有电子在同一区域里运动
③能量高的电子在离核近的区域内运动
④能量低的电子在离核近的区域内运动
A.①④ B.②③
C.①③ D.②④
随堂训练
答案:A;
解析:原子核外电子是分层运动的,能量越低离核越近,能量越高离核越远。
随堂训练
下列微粒结构示意图中,不正确的是 ( )
随堂训练
答案:B
解析:A中核电荷数和核外电子数都是8,这是氧原子的结构示意图,正确;B中核电荷数为11,这是Na的原子核,钠原子的核外有11个电子,钠元素的最高化合价为+1价,Na+的核外应有10个电子,而图中核外只有9个电子,错误;C中核电荷数和核外电子数都是17,这是氯原子的结构示意图,正确;D中核电荷数和核外电子数分别是17和18,这是Cl-的结构示意图,正确。
随堂训练
已知A、B、C三种元素的原子中,质子数为A
(2)画出三种元素的原子结构示意图:
A________,B_________,C_____________。
碳C
硅Si
氯Cl
随堂训练
解析:由A元素的原子最外层电子数是次外层电子数的2倍,可知A是碳元素;B元素的原子核外M层电子数是L层电子数的一半,可知B为硅元素;C元素的原子次外层电子数比最外层电子数多1个,可知C应为氯元素。
随堂训练
原子的构成示意图如图,下列叙述正确的是 ( )
A.原子是实心球体
B.质子、中子、电子均匀分布在原子中
C.质子与电子质量相等
D.整个原子的质量主要集中在原子核上
随堂训练
答案:D;
解析:原子不是实心的球体,故A错误;正中央有原子核,核外有电子围绕原子核运动,故B错误;一个电子的质量约为一个质子质量的1/1836 ,故C错误;整个原子的大部分质量集中在原子核上,原子核中有质子和中子,质子数=核电荷数=电子数,电子质量很少,忽略不计,故D正确。
随堂训练
下列说法中正确的是( )
A.有一种氢原子中的原子核中有2个中子,1个质子,则其质量数为3
B.钠原子和钠离子质量相差很大
C.在原子中质子数一定等于中子数
D.所有的原子都是由质子、中子、电子构成
随堂训练
答案:A;
解析:质量数=质子数+中子数,故A正确;钠原子失去1个电子形成钠离子,电子的质量很小,可以忽略,所以钠原子和钠离子的质量几乎相等,故B错误;在原子中质子数不一定等于中子数,例如2311Na中质子数就不等于中子数,故C错误;并不是所有的原子都是由质子、中子、电子构成,例如11 H中不含有中子,故D错误。
感谢观看
THANK YOU
