3.2.2 物质的量在化学方程式计算中的应用 课件(共36张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 3.2.2 物质的量在化学方程式计算中的应用 课件(共36张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |  | |
| 格式 | pptx | ||
| 文件大小 | 690.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 10:42:10 | ||
图片预览











文档简介
(共36张PPT)
第三单元
铁 金属材料
第二课时 物质的量在化学方程式计算中的应用
第二节 金属材料
学习目标
1.复习回顾有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算方法。
2.掌握物质的量在化学方程式计算中的一般方法和步骤。能逐步熟练在计算中应用物质的量,掌握计算的技巧和方法。
旧知回顾
1.在化学变化前后,原子的_______和_______都保持不变,所以任何化学反应都遵循__________定律。
2.在标准状况下,46g钠和足量的水反应生成H2的质量为______,即2mol钠和足量的水反应,生成H2的物质的量为____mol,其体积为_______L。
种类
个数
质量守恒
2g
1
22.4
新知学习
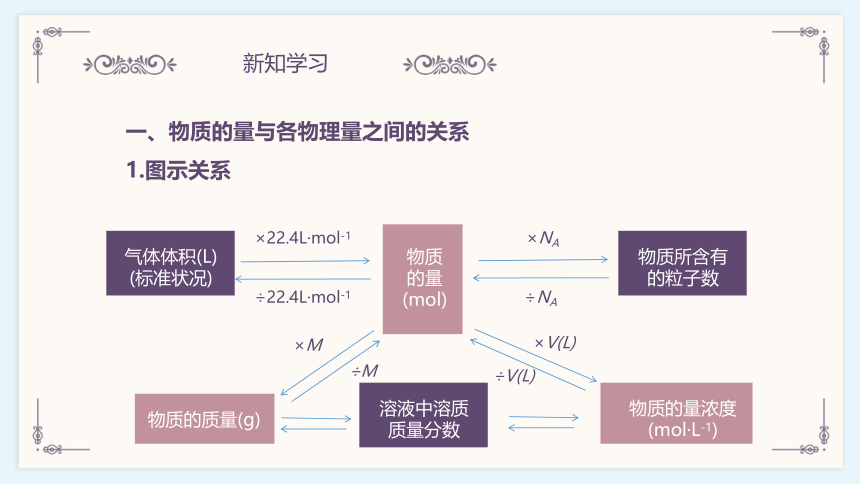
一、物质的量与各物理量之间的关系
1.图示关系
气体体积(L)
(标准状况)
物质的量
(mol)
物质所含有的粒子数
物质的质量(g)
物质的量浓度
(mol·L-1)
溶液中溶质质量分数
×22.4L·mol-1
÷22.4L·mol-1
×NA
÷NA
×M
÷M
×V(L)
÷V(L)
新知学习
2.计算公式
(1)已知物质的质量:n(B)=______;
(2)已知标准状况时的气体体积:n(B)=_________;
(3)已知物质的粒子数:n(B)=______;
(4)已知溶液中的物质的量浓度:n(B)=________________。
c(B)·V[B(aq)]
新知学习
二、化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O === 2NaOH + H2↑
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比:2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
结论:化学方程式中化学计量数之比等于____________之比,也等于____________之比,对于有气体参与的反应还等于________之比。
粒子个数
物质的量
体积
新知学习
三、根据化学方程式进行计算的基本步骤
有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应的HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
有关物质的量的计算中的“三个规范”
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
2.物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
有关物质的量的计算中的“三个规范”
3.化学计算中常用的三种方法
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。如把CO还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量,根据化学方程式知3CO~3CO2~3CaCO3,即CO~CaCO3。
有关物质的量的计算中的“三个规范”
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
有关物质的量的计算中的“三个规范”
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。
有关物质的量的计算中的“三个规范”
例如,把一铁棒插入CuSO4溶液中,过一段时间取出,铁棒质量增加了4 g,据此可求出参加反应的Fe的质量。
Fe+CuSO4=FeSO4+Cu Δm(质量增加)
56 64 64-56=8
m(Fe) 4 g
56/8=m(Fe)/4g,
解得m(Fe)=28g。
随堂训练
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2mol
B.参加反应的HCl为0.4mol
C.Mg、Al在反应中共失去0.4mol电子
D.若与足量的稀硫酸反应能产生0.2molH2
随堂训练
答案:A
解析:反应的实质为Mg+2H+=Mg2++H2↑,2Al+6H+=2Al3++3H2↑,n(H2)=(4. 48L)/(22.4L mol-1 )=0.2 mol,则参加反应的n(H+)=0.4mol。若换成稀硫酸,同样产生0.2molH2。依据得失电子守恒,由2H+ H2得电子总数为0.2mol×2=0.4mol,故C正确。0.2molMg提供0.4mol电子,0.2molAl则提供0.6mol电子,0.2molMg、Al混合物提供的电子物质的量大于0.4mol,小于0.6mol,A错误。
随堂训练
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
随堂训练
答案:C
解析:设反应放出的气体均为3mol,
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
所以n(HCl)∶n(NaOH)=6mol∶2mol=3∶1。
随堂训练
将质量为100g的铁棒插入1L0.5mol·L-1CuSO4溶液中,足够长时间后,铁棒的质量将变为( )
A.102 g B.106 g
C.104 g D.110 g
随堂训练
答案:C
解析:根据题目中的数据可知,铁过量,而CuSO4不足,完全反应,当生成0.5molCu时,固体的质量增加4g,所以铁棒的质量变为104g。
随堂训练
铁粉可在高温下与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是 ( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
随堂训练
答案:C
随堂训练
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1 C.3∶4 D.4∶3
随堂训练
答案:C
随堂训练
对于反应:2A(g)+2B(g)===3C(g)+D(g),化学计量数之比与下列各项不等的是 ( )
A.分子数之比 B.物质的量之比
C.质量之比 D.体积之比(同温同压)
随堂训练
答案:C
解析:方程式中化学计量数之比等于物质的量之比,等于分子数之比,等于相同状态下气体体积比,只有C符合题意。
随堂训练
等物质的量的常见金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在金属C的生成物中,该金属的化合价为( )
A.+1价 B.+2价
C.+3价 D.+4价
随堂训练
答案:A
解析:VB=2VC,VA=VB+VC=3VC,根据得失电子守恒,A失去的电子数为C的3倍,金属最外层电子数一般小于4,故A的化合价为C的3倍,C的化合价只能为+1价。
随堂训练
向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,试计算:
(1)Al的物质的量;
(2)参加反应的NaOH的物质的量和溶液中NaOH的物质的量浓度;
(3)在标准状况下生成H2的体积。
随堂训练
答案:(1)铝的物质的量为0.4mol。
(2)参加反应的NaOH的物质的量是0.4mol,溶液中NaOH的物质的量浓度是0.8mol·L-1。
(3)标准状况下生成H2的体积为13.44L。
随堂训练
随堂训练
随堂训练
镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制作又轻又薄的笔记本电脑、手机等的外壳。把10.2g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72L氢气。试计算:
(1)该合金中铝的质量分数是___________。
(2)该合金中镁与铝的物质的量之比是________。
(3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是____________。
52.9%
1∶1
11.2L
随堂训练
随堂训练
随堂训练
谢谢观赏
THANK YOU
第三单元
铁 金属材料
第二课时 物质的量在化学方程式计算中的应用
第二节 金属材料
学习目标
1.复习回顾有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算方法。
2.掌握物质的量在化学方程式计算中的一般方法和步骤。能逐步熟练在计算中应用物质的量,掌握计算的技巧和方法。
旧知回顾
1.在化学变化前后,原子的_______和_______都保持不变,所以任何化学反应都遵循__________定律。
2.在标准状况下,46g钠和足量的水反应生成H2的质量为______,即2mol钠和足量的水反应,生成H2的物质的量为____mol,其体积为_______L。
种类
个数
质量守恒
2g
1
22.4
新知学习
一、物质的量与各物理量之间的关系
1.图示关系
气体体积(L)
(标准状况)
物质的量
(mol)
物质所含有的粒子数
物质的质量(g)
物质的量浓度
(mol·L-1)
溶液中溶质质量分数
×22.4L·mol-1
÷22.4L·mol-1
×NA
÷NA
×M
÷M
×V(L)
÷V(L)
新知学习
2.计算公式
(1)已知物质的质量:n(B)=______;
(2)已知标准状况时的气体体积:n(B)=_________;
(3)已知物质的粒子数:n(B)=______;
(4)已知溶液中的物质的量浓度:n(B)=________________。
c(B)·V[B(aq)]
新知学习
二、化学方程式中化学计量数与各化学计量间的关系
2Na + 2H2O === 2NaOH + H2↑
计量数之比: 2 ∶ 2 ∶ 2 ∶ 1
扩大NA倍: 2NA ∶ 2NA ∶ 2NA ∶ NA
物质的量之比:2 mol∶ 2 mol ∶ 2 mol ∶ 1 mol
质量之比: 46 g ∶ 36 g ∶ 80 g ∶ 2 g
结论:化学方程式中化学计量数之比等于____________之比,也等于____________之比,对于有气体参与的反应还等于________之比。
粒子个数
物质的量
体积
新知学习
三、根据化学方程式进行计算的基本步骤
有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应的HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
有关物质的量的计算中的“三个规范”
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
2.物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
有关物质的量的计算中的“三个规范”
3.化学计算中常用的三种方法
(1)关系式法
当已知物和未知物之间是靠多个反应来联系时,只需直接确定已知量和未知量之间的比例关系,即“关系式”。如把CO还原Fe2O3生成的CO2通入澄清石灰水中,求生成沉淀的量,根据化学方程式知3CO~3CO2~3CaCO3,即CO~CaCO3。
有关物质的量的计算中的“三个规范”
(2)守恒法
①质量守恒
宏观特征:反应前后元素的质量守恒。
微观守恒:反应前后各元素的原子个数守恒。
②得失电子守恒
氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
③电荷守恒
ⅰ.电解质溶液中,阴离子所带负电荷总数等于阳离子所带正电荷总数。
有关物质的量的计算中的“三个规范”
ⅱ.离子方程式中,反应物所带电荷总数与生成物所带电荷总数相等且电性相同。
(3)差量法
根据化学反应前后物质的有关物理量发生的变化,找出所谓“理论差量”,如反应前后的质量差、物质的量差、气体体积差等。该差量的大小与反应物的有关量成正比。差量法就是借助这种比例关系,解决一定量变的计算题。
有关物质的量的计算中的“三个规范”
例如,把一铁棒插入CuSO4溶液中,过一段时间取出,铁棒质量增加了4 g,据此可求出参加反应的Fe的质量。
Fe+CuSO4=FeSO4+Cu Δm(质量增加)
56 64 64-56=8
m(Fe) 4 g
56/8=m(Fe)/4g,
解得m(Fe)=28g。
随堂训练
Mg、Al组成的混合物与足量盐酸反应,产生标准状况下的氢气4.48L。下列推断中错误的是( )
A.参加反应的Mg、Al共0.2mol
B.参加反应的HCl为0.4mol
C.Mg、Al在反应中共失去0.4mol电子
D.若与足量的稀硫酸反应能产生0.2molH2
随堂训练
答案:A
解析:反应的实质为Mg+2H+=Mg2++H2↑,2Al+6H+=2Al3++3H2↑,n(H2)=(4. 48L)/(22.4L mol-1 )=0.2 mol,则参加反应的n(H+)=0.4mol。若换成稀硫酸,同样产生0.2molH2。依据得失电子守恒,由2H+ H2得电子总数为0.2mol×2=0.4mol,故C正确。0.2molMg提供0.4mol电子,0.2molAl则提供0.6mol电子,0.2molMg、Al混合物提供的电子物质的量大于0.4mol,小于0.6mol,A错误。
随堂训练
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相同时,反应中消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
随堂训练
答案:C
解析:设反应放出的气体均为3mol,
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
所以n(HCl)∶n(NaOH)=6mol∶2mol=3∶1。
随堂训练
将质量为100g的铁棒插入1L0.5mol·L-1CuSO4溶液中,足够长时间后,铁棒的质量将变为( )
A.102 g B.106 g
C.104 g D.110 g
随堂训练
答案:C
解析:根据题目中的数据可知,铁过量,而CuSO4不足,完全反应,当生成0.5molCu时,固体的质量增加4g,所以铁棒的质量变为104g。
随堂训练
铁粉可在高温下与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是 ( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
随堂训练
答案:C
随堂训练
将某份铁铝合金样品均分为两份,一份加入足量盐酸,另一份加入足量NaOH溶液,同温同压下产生的气体体积比为3∶2,则样品中铁、铝物质的量之比为( )
A.3∶2 B.2∶1 C.3∶4 D.4∶3
随堂训练
答案:C
随堂训练
对于反应:2A(g)+2B(g)===3C(g)+D(g),化学计量数之比与下列各项不等的是 ( )
A.分子数之比 B.物质的量之比
C.质量之比 D.体积之比(同温同压)
随堂训练
答案:C
解析:方程式中化学计量数之比等于物质的量之比,等于分子数之比,等于相同状态下气体体积比,只有C符合题意。
随堂训练
等物质的量的常见金属A、B、C分别与足量的稀盐酸反应,所得氢气的体积依次为VA、VB、VC,已知VB=2VC,且VA=VB+VC,则在金属C的生成物中,该金属的化合价为( )
A.+1价 B.+2价
C.+3价 D.+4价
随堂训练
答案:A
解析:VB=2VC,VA=VB+VC=3VC,根据得失电子守恒,A失去的电子数为C的3倍,金属最外层电子数一般小于4,故A的化合价为C的3倍,C的化合价只能为+1价。
随堂训练
向500mLNaOH溶液中投入10.8gAl,二者恰好完全反应,试计算:
(1)Al的物质的量;
(2)参加反应的NaOH的物质的量和溶液中NaOH的物质的量浓度;
(3)在标准状况下生成H2的体积。
随堂训练
答案:(1)铝的物质的量为0.4mol。
(2)参加反应的NaOH的物质的量是0.4mol,溶液中NaOH的物质的量浓度是0.8mol·L-1。
(3)标准状况下生成H2的体积为13.44L。
随堂训练
随堂训练
随堂训练
镁铝合金具有很好的强度、刚性和尺寸稳定性,常用来制作又轻又薄的笔记本电脑、手机等的外壳。把10.2g镁铝合金的粉末放入过量的烧碱溶液中,在标准状况下生成6.72L氢气。试计算:
(1)该合金中铝的质量分数是___________。
(2)该合金中镁与铝的物质的量之比是________。
(3)该合金溶于足量的盐酸中,标准状况下产生氢气的体积是____________。
52.9%
1∶1
11.2L
随堂训练
随堂训练
随堂训练
谢谢观赏
THANK YOU
