3.1.1 铁的单质、氧化物、氢氧化物 课件(共37张PPT)—2023-2024学年高中化学人教版-2019·高一上学期
文档属性
| 名称 | 3.1.1 铁的单质、氧化物、氢氧化物 课件(共37张PPT)—2023-2024学年高中化学人教版-2019·高一上学期 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 00:00:00 | ||
图片预览










文档简介
(共37张PPT)
第三章 铁 金属材料
第一节 铁及其化合物
第一课时
铁的单质、铁的氧化物、铁的氢氧化物
学习目标
1.了解单质铁、铁的氧化物性质及用途;
2.通过实验认识铁单质与水蒸气的反应的条件,加深对微观原子结构决定物质宏观性质的认识;
3.掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
铁元素在自然界中的分布
陨铁
赤铁矿
磁铁矿
陨铁是自然界中铁元素的单质形态,但是铁元素更多地以化合物的形式存在于矿石中。
钠在自然界有单质吗?为什么?
铁的性质
1.铁的物理性质
铁有_______和_______。铁能_____,但其导电性不如铜和铝。铁能被_____吸引。
2.铁的化学性质
(1)铁与___________的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成____价铁的化合物。
(2)铁与___________的氧化剂(如氯气等)反应,铁原子则失去__个电子生成____价铁的化合物。
延展性
导热性
导电
磁体
氧化性较弱
+2
氧化性较强
+3
3
铁的性质
(3)红热的铁能与水蒸气发生反应,生成___________和_____。化学方程式:___________________________。
四氧化三铁
氢气
3Fe+4H2O(g) Fe3O4+4H2
高温
====
铁的氧化物
化学式 FeO Fe2O3 Fe3O4纯净物
俗称 — _____ ___________
颜色和状态 ___色粉末 _______粉末 ___色晶体
铁的价态 ____价 ____价 +2价、+3价
水溶性 _____ _____ _____
与盐酸反应 (离子方程式) FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O
铁红
磁性氧化物
黑
红棕色
黑
+2
+3
不溶
不溶
不溶
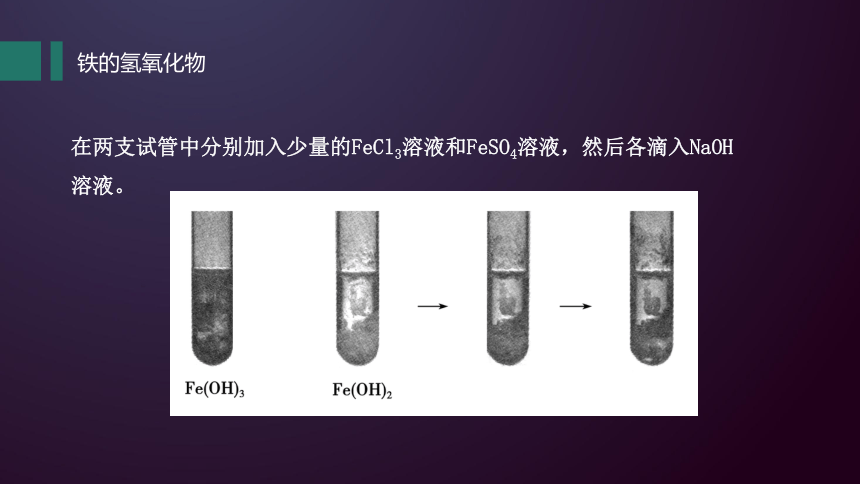
铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
铁的氢氧化物
(1)在FeCl3溶液中滴入NaOH溶液,生成__________沉淀,原因是_________________________________(填反应的离子方程式)。
(2)在FeSO4溶液中滴入NaOH溶液,生成________絮状沉淀,原因是_________________________________(填反应的离子方程式),沉淀迅速变成灰绿色,最后会有红褐色沉淀生成,原因是________________________________________(填反应的化学方程式)。
红褐色
白色
Fe3++3OH-===Fe(OH)3↓
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe(OH)2 Fe(OH)3
颜色 ________ __________
溶解性 ____________ ____________
制备 ________________________ ________________________
铁单质
(3)Fe(OH)2与Fe(OH)3的制备与性质
白色
红褐色
难溶于水
难溶于水
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
Fe(OH)2 Fe(OH)3
性质 还原性 ________________________
不稳 定性 (隔绝空气加热) _________________________
__________________________
与酸 反应 _____________________________ __________________________
铁单质
在空气中迅速被氧气氧化
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
铁及其氧化物的性质
材料一:铁陨石在化学成分上除Ni和Fe外,还含有Co、S、P、Cu、Cr、Ga、Ge和Ir等元素。有少数铁陨石还含有硅酸盐包体。铁陨石与地球岩石十分相似,所以一般很难鉴别。
材料二:从上世纪70年代开始,珍品陨石的价格就已经与黄金相差无几。 陨石最终的价值高低,要综合陨石的材质、结构、纹理等一起来评定,稀有陨石则可达到每克万元以上。
铁及其氧化物的性质
1.铁陨石可以应用磁铁检验法,说明单质铁具有哪些性质?
说明铁具有可以被磁铁吸引的性质。
2.铁陨石中主要含有Fe和Ni,若取少量陨石,加入足量的稀盐酸,你会观察到哪些现象(假设铁陨石的其他成分不与盐酸反应)?请写出相关的化学方程式。
铁及其氧化物的性质
3.某化学兴趣小组讨论:金属钠可以与水剧烈反应,生成氢气与氢氧化钠,那么金属铁是否可以与水反应呢?如果反应会生成氢气吗?针对问题,该小组设计出如下的实验装置进行探究。
铁及其氧化物的性质
方法 方法一(实验改进) 方法二
气体检验 用小试管C收集一试管气体,点燃,听到轻微的“噗”声,证明生成了_______ 用火柴点燃肥皂泡,听到爆鸣声,证明生成了_______
实验结论 __________________________________________
化学方程式 __________________________________________
方法二中湿棉花的作用 __________________________________________
H2
H2
铁可与水蒸气反应,生成的气体为H2
提供反应所需水蒸气
掌握铁的氧化物的性质
1.阿尔法磁谱仪又译为反物质太空磁谱仪,我国科学家为磁谱仪倾注了大量心血,磁谱仪已随航天飞船升入太空,开始了探索宇宙中是否存在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪的核心部件的材料是FeO、Fe2O3、Fe3O4中的哪一种?
Fe3O4。制造阿尔法磁谱仪的核心部件的材料是一种具有磁性的物质,在铁的各种化合物中,只有Fe3O4是具有磁性的物质,其他均不具有磁性。
掌握铁的氧化物的性质
2.“秦砖汉瓦”是我国传统建筑文化的一个缩影。都是由黏土烧制的砖瓦(黏土中含有铁元素),有的是黑色的,有的却是红色的,请分析其颜色不同的原因?
砖瓦显黑色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成黑色的FeO与Fe3O4。
砖瓦显红色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成红棕色的Fe2O3。
铁的还原性
铁的还原性
铁的还原性
从氧化还原反应的角度,分析FeO、Fe2O3、Fe3O4的氧化性和还原性。
FeO有还原性,Fe2O3有氧化性,Fe3O4既有氧化性又有还原性。但FeO与Fe2O3中Fe元素价态相邻,两者不会反应。FeO、Fe3O4遇强氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
氢氧化亚铁的制备
氢氧化亚铁不稳定,工业上和生活上通常都是把它转化为氢氧化铁,再进行利用。某化学兴趣小组用如图所示装置制备氢氧化亚铁。将吸有NaOH溶液的胶头滴管悬空于试管上方,缓慢挤出NaOH溶液,均匀滴入试管中的FeSO4溶液中。
该小组同学反映该试管中出现以下现象:试管中先生成白色沉淀,迅速变成灰绿色,最后变成红褐色。
氢氧化亚铁的制备
氢氧化亚铁的制备方法
(1)写出发生该现象的化学方程式:____________________________________________________________。
(2)利用该方法能否制备氢氧化亚铁:_____。
(3)实验室要制取Fe(OH)2,关键是_______________________。
FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、
4Fe(OH)2+O2+2H2O===4Fe(OH)3
不能
避免生成的Fe(OH)2接触O2
氢氧化亚铁的制备
(4)该小组对制取装置进行了改进,取用最新配制的FeSO4溶液;NaOH溶液加热煮沸并冷却后使用,成功制得了氢氧化亚铁。
①NaOH溶液要经过加热煮沸,目的是__________________;
②在FeSO4溶液表面覆盖一层苯,作用是_____________________。
赶走溶解的氧气
隔绝空气中的氧气
氢氧化亚铁的制备
制备Fe(OH)2时防氧化措施
(1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
氢氧化亚铁的制备
【注意】(1)氢氧化亚铁制备时所用水如不煮沸,其中会有氧气,制得的氢氧化亚铁易被氧化;
(2)制得的氢氧化亚铁不能接触氧气等具有氧化性的物质,否则会被氧化变为红褐色。
随堂训练
有人设计出一种在隔绝空气条件下钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至橡胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
随堂训练
(1)大试管的下层溶液中出现什么现象?
钠与FeSO4溶液剧烈反应,产生气泡,并生成白色絮状沉淀。由于金属Na的密度比H2O的小,但比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
随堂训练
(2)装置中长颈漏斗内液面下降还是上升?
上升。由于大试管内产生H2,大试管内气压增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
(3)写出钠与FeSO4溶液反应的化学方程式。
随堂训练
红珊瑚栖息于200~2000米深的海域,产于台湾海峡、中国南海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥富有的象征,一直被用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,呈红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Zn D.Cu
B
随堂训练
铁的应用在我国历史悠久。《史记 货殖列传》:“邯郸郭纵以铁冶成业。”下列反应中,铁只能转化为+3价铁的是( )
A.少量铁与稀硫酸反应
B.铁丝在氧气中燃烧
C.过量铁粉在氯气中燃烧
D.Fe投入CuSO4溶液中
C
随堂训练
下列有关金属及其化合物的说法正确的是( )
A.钠在空气中燃烧生成白色固体Na2O2
B.过量铁粉在氯气中燃烧,可以生成FeCl2
C.铁在高温下与水蒸气反应生成Fe3O4和H2
D.铁在潮湿的空气中不发生任何反应
C
随堂训练
将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
B
随堂训练
在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
D
随堂训练
随堂训练
随堂训练
随堂训练
THANK YOU
第三章 铁 金属材料
第一节 铁及其化合物
第一课时
铁的单质、铁的氧化物、铁的氢氧化物
学习目标
1.了解单质铁、铁的氧化物性质及用途;
2.通过实验认识铁单质与水蒸气的反应的条件,加深对微观原子结构决定物质宏观性质的认识;
3.掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
铁元素在自然界中的分布
陨铁
赤铁矿
磁铁矿
陨铁是自然界中铁元素的单质形态,但是铁元素更多地以化合物的形式存在于矿石中。
钠在自然界有单质吗?为什么?
铁的性质
1.铁的物理性质
铁有_______和_______。铁能_____,但其导电性不如铜和铝。铁能被_____吸引。
2.铁的化学性质
(1)铁与___________的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成____价铁的化合物。
(2)铁与___________的氧化剂(如氯气等)反应,铁原子则失去__个电子生成____价铁的化合物。
延展性
导热性
导电
磁体
氧化性较弱
+2
氧化性较强
+3
3
铁的性质
(3)红热的铁能与水蒸气发生反应,生成___________和_____。化学方程式:___________________________。
四氧化三铁
氢气
3Fe+4H2O(g) Fe3O4+4H2
高温
====
铁的氧化物
化学式 FeO Fe2O3 Fe3O4纯净物
俗称 — _____ ___________
颜色和状态 ___色粉末 _______粉末 ___色晶体
铁的价态 ____价 ____价 +2价、+3价
水溶性 _____ _____ _____
与盐酸反应 (离子方程式) FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O
铁红
磁性氧化物
黑
红棕色
黑
+2
+3
不溶
不溶
不溶
铁的氢氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。
铁的氢氧化物
(1)在FeCl3溶液中滴入NaOH溶液,生成__________沉淀,原因是_________________________________(填反应的离子方程式)。
(2)在FeSO4溶液中滴入NaOH溶液,生成________絮状沉淀,原因是_________________________________(填反应的离子方程式),沉淀迅速变成灰绿色,最后会有红褐色沉淀生成,原因是________________________________________(填反应的化学方程式)。
红褐色
白色
Fe3++3OH-===Fe(OH)3↓
Fe2++2OH-===Fe(OH)2↓
4Fe(OH)2+O2+2H2O===4Fe(OH)3
Fe(OH)2 Fe(OH)3
颜色 ________ __________
溶解性 ____________ ____________
制备 ________________________ ________________________
铁单质
(3)Fe(OH)2与Fe(OH)3的制备与性质
白色
红褐色
难溶于水
难溶于水
Fe2++2OH-===Fe(OH)2↓
Fe3++3OH-===Fe(OH)3↓
Fe(OH)2 Fe(OH)3
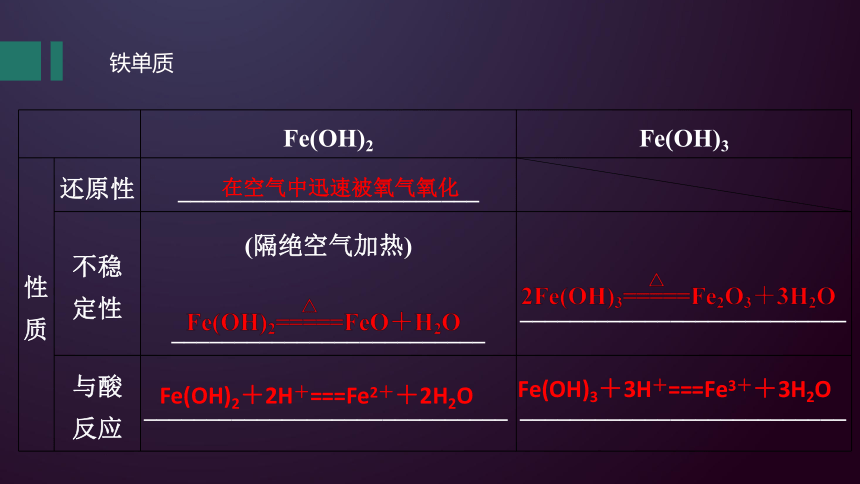
性质 还原性 ________________________
不稳 定性 (隔绝空气加热) _________________________
__________________________
与酸 反应 _____________________________ __________________________
铁单质
在空气中迅速被氧气氧化
Fe(OH)2+2H+===Fe2++2H2O
Fe(OH)3+3H+===Fe3++3H2O
铁及其氧化物的性质
材料一:铁陨石在化学成分上除Ni和Fe外,还含有Co、S、P、Cu、Cr、Ga、Ge和Ir等元素。有少数铁陨石还含有硅酸盐包体。铁陨石与地球岩石十分相似,所以一般很难鉴别。
材料二:从上世纪70年代开始,珍品陨石的价格就已经与黄金相差无几。 陨石最终的价值高低,要综合陨石的材质、结构、纹理等一起来评定,稀有陨石则可达到每克万元以上。
铁及其氧化物的性质
1.铁陨石可以应用磁铁检验法,说明单质铁具有哪些性质?
说明铁具有可以被磁铁吸引的性质。
2.铁陨石中主要含有Fe和Ni,若取少量陨石,加入足量的稀盐酸,你会观察到哪些现象(假设铁陨石的其他成分不与盐酸反应)?请写出相关的化学方程式。
铁及其氧化物的性质
3.某化学兴趣小组讨论:金属钠可以与水剧烈反应,生成氢气与氢氧化钠,那么金属铁是否可以与水反应呢?如果反应会生成氢气吗?针对问题,该小组设计出如下的实验装置进行探究。
铁及其氧化物的性质
方法 方法一(实验改进) 方法二
气体检验 用小试管C收集一试管气体,点燃,听到轻微的“噗”声,证明生成了_______ 用火柴点燃肥皂泡,听到爆鸣声,证明生成了_______
实验结论 __________________________________________
化学方程式 __________________________________________
方法二中湿棉花的作用 __________________________________________
H2
H2
铁可与水蒸气反应,生成的气体为H2
提供反应所需水蒸气
掌握铁的氧化物的性质
1.阿尔法磁谱仪又译为反物质太空磁谱仪,我国科学家为磁谱仪倾注了大量心血,磁谱仪已随航天飞船升入太空,开始了探索宇宙中是否存在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪的核心部件的材料是FeO、Fe2O3、Fe3O4中的哪一种?
Fe3O4。制造阿尔法磁谱仪的核心部件的材料是一种具有磁性的物质,在铁的各种化合物中,只有Fe3O4是具有磁性的物质,其他均不具有磁性。
掌握铁的氧化物的性质
2.“秦砖汉瓦”是我国传统建筑文化的一个缩影。都是由黏土烧制的砖瓦(黏土中含有铁元素),有的是黑色的,有的却是红色的,请分析其颜色不同的原因?
砖瓦显黑色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成黑色的FeO与Fe3O4。
砖瓦显红色的原因:烧制砖瓦时,黏土中的铁元素与O2反应,生成红棕色的Fe2O3。
铁的还原性
铁的还原性
铁的还原性
从氧化还原反应的角度,分析FeO、Fe2O3、Fe3O4的氧化性和还原性。
FeO有还原性,Fe2O3有氧化性,Fe3O4既有氧化性又有还原性。但FeO与Fe2O3中Fe元素价态相邻,两者不会反应。FeO、Fe3O4遇强氧化性酸(如HNO3)发生氧化还原反应,+2价的铁均被氧化成+3价。
氢氧化亚铁的制备
氢氧化亚铁不稳定,工业上和生活上通常都是把它转化为氢氧化铁,再进行利用。某化学兴趣小组用如图所示装置制备氢氧化亚铁。将吸有NaOH溶液的胶头滴管悬空于试管上方,缓慢挤出NaOH溶液,均匀滴入试管中的FeSO4溶液中。
该小组同学反映该试管中出现以下现象:试管中先生成白色沉淀,迅速变成灰绿色,最后变成红褐色。
氢氧化亚铁的制备
氢氧化亚铁的制备方法
(1)写出发生该现象的化学方程式:____________________________________________________________。
(2)利用该方法能否制备氢氧化亚铁:_____。
(3)实验室要制取Fe(OH)2,关键是_______________________。
FeSO4+2NaOH===Fe(OH)2↓+Na2SO4、
4Fe(OH)2+O2+2H2O===4Fe(OH)3
不能
避免生成的Fe(OH)2接触O2
氢氧化亚铁的制备
(4)该小组对制取装置进行了改进,取用最新配制的FeSO4溶液;NaOH溶液加热煮沸并冷却后使用,成功制得了氢氧化亚铁。
①NaOH溶液要经过加热煮沸,目的是__________________;
②在FeSO4溶液表面覆盖一层苯,作用是_____________________。
赶走溶解的氧气
隔绝空气中的氧气
氢氧化亚铁的制备
制备Fe(OH)2时防氧化措施
(1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。
(2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。
(3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。
(4)在亚铁盐溶液上面加保护层,如苯、植物油等。
氢氧化亚铁的制备
【注意】(1)氢氧化亚铁制备时所用水如不煮沸,其中会有氧气,制得的氢氧化亚铁易被氧化;
(2)制得的氢氧化亚铁不能接触氧气等具有氧化性的物质,否则会被氧化变为红褐色。
随堂训练
有人设计出一种在隔绝空气条件下钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至橡胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
随堂训练
(1)大试管的下层溶液中出现什么现象?
钠与FeSO4溶液剧烈反应,产生气泡,并生成白色絮状沉淀。由于金属Na的密度比H2O的小,但比煤油的大,故钠粒应位于两种液体的交界处,Na与FeSO4溶液接触的部分与H2O发生反应生成NaOH和H2,NaOH与FeSO4发生反应生成白色絮状沉淀Fe(OH)2,因隔绝了空气,制得的白色Fe(OH)2可以保存较长时间。
随堂训练
(2)装置中长颈漏斗内液面下降还是上升?
上升。由于大试管内产生H2,大试管内气压增大,把大试管内的液体压入长颈漏斗中,故长颈漏斗内的液面上升。
(3)写出钠与FeSO4溶液反应的化学方程式。
随堂训练
红珊瑚栖息于200~2000米深的海域,产于台湾海峡、中国南海,它与琥珀、珍珠被统称为有机宝石。在中国,珊瑚是吉祥富有的象征,一直被用来制作珍贵的工艺品。红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,呈红色是因为在海底长期积淀某种元素,该元素是( )
A.Na B.Fe C.Zn D.Cu
B
随堂训练
铁的应用在我国历史悠久。《史记 货殖列传》:“邯郸郭纵以铁冶成业。”下列反应中,铁只能转化为+3价铁的是( )
A.少量铁与稀硫酸反应
B.铁丝在氧气中燃烧
C.过量铁粉在氯气中燃烧
D.Fe投入CuSO4溶液中
C
随堂训练
下列有关金属及其化合物的说法正确的是( )
A.钠在空气中燃烧生成白色固体Na2O2
B.过量铁粉在氯气中燃烧,可以生成FeCl2
C.铁在高温下与水蒸气反应生成Fe3O4和H2
D.铁在潮湿的空气中不发生任何反应
C
随堂训练
将Fe(OH)2露置在空气中加热灼烧所得的产物为( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
B
随堂训练
在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁
B.该反应是化合反应
C.该反应是氧化还原反应
D.氢氧化亚铁作氧化剂
D
随堂训练
随堂训练
随堂训练
随堂训练
THANK YOU
