4.1.2硫酸的工业制备浓硫酸的性质 课件(共21张PPT)化学苏教版(2019)必修第一册
文档属性
| 名称 | 4.1.2硫酸的工业制备浓硫酸的性质 课件(共21张PPT)化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 81.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 10:51:07 | ||
图片预览








文档简介
(共21张PPT)
4.1.2 硫酸的工业制备
浓硫酸的性质
硫酸是当令世界上最重要的化工产品之一,美誉为“化学工业之母”,工业上常用硫酸的年产量来衡量一个国家的化工生产能力。早在1000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制硫酸,如:《黄帝九鼎神丹经诀》——“炼石胆取精华法”。
硫酸的应用史和重要作用
CuSO4·5H2O==CuO+SO3↑+5H2O
SO3 + H2O==H2SO4
胆矾
绿矾
2FeSO4·7H2O==Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O==H2SO4
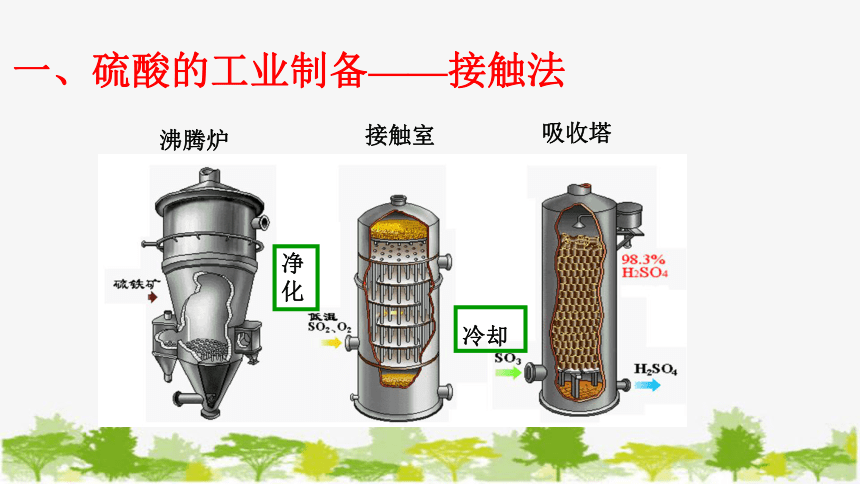
沸腾炉
接触室
吸收塔
净化
冷却
一、硫酸的工业制备——接触法
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓H2SO4
造气(生成SO2)
接触氧化
(生成SO3)
SO3吸收
(生成H2SO4)
沸腾炉
接触室
吸收塔
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
S + O2 == SO2
SO3+H2O===H2SO4
2SO2 + O2 2SO3
H2SO4
S
SO3
SO2
(1)
(2)
(3)
思考并回答下列问题:
(1)有哪些特殊的工艺要求?硫铁矿为什么要粉碎?
(2)从沸腾炉中出来的气体中含有哪些杂质,怎样处理?
(3)热交换器起什么作用?为什么控制温度在450℃?
(4)为什么用98.3%的浓硫酸吸收而不用水吸收?
(5)浓硫酸为什么要从上向下喷下?
(6)会产生哪些废弃物?
硫铁矿中FeS2的质量分数一般为20%-50%,制酸工艺过程中所产生的矿渣和废气便生产装置变得较为复杂。而采用硫黄制酸法,工艺流程和设备相对简易。硫黄含杂质少,燃烧生成的气体含杂质少,可免去气体净化的过程,制备过程也不产生矿渣。因此,硫铁矿制酸投资几乎是同等规模硫黄制酸设备的两倍。但硫黄原料价格高于硫铁矿,具体选用何种硫酸制备工艺,应根据实际条件和要求进行决策。
(1)原料廉价且稳定,降低运输成本。
(2)从环保、成本等角度选择合适的化学反应,保证在反应中能充分接触。
(3)制备流程简单高效,能耗低,反应放出的热量质尽可能加以循环利用,生副产物较少。
(4)制备过程绿色,环保,不使用或生成对环境有害的物质。
化学工业制备的要求
二、浓硫酸的特性
实验1、向表面皿中加入少量胆矾,
再加入约3mL浓硫酸,搅拌,观察实验现象。
实验现象:蓝色的胆矾(CuSO4·5H2O)变成白色(CuSO4)
1、吸水性
2、脱水性
实验2、取2g蔗糖,放入大试管中,加2-3滴水,再加入约3mL的浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
实验现象:蔗糖由白变黑,慢慢膨胀,形成疏松的海绵状,同时有刺激性气味产生。
脱水性:
浓硫酸按照水的组成比,夺取某些有机物中的氢、氧元素形成水分子,可使蔗糖、纤维素等物质脱水,这叫脱水性。
C12H22O11 12C + 11H2O
3、强氧化性
实验结论:铜与浓硫酸在加热条件发生反应,生成硫酸铜、二氧化硫和水,浓硫酸表现强氧化性。
实验3、将一小片铜片放入试管中,然后加入2mL浓硫酸,加热,观察实验现象。
实验现象:铜逐渐溶解,溶液变蓝,有无色刺激性气体生成,该气体可以使品红溶液褪色,加热退色溶液,溶液红色回复。
浓硫酸能与绝大多数金属发生反应,在加热时表现出更强的氧化性。在常温下,铁、铝等少数金属遇浓硫酸会发生钝化,铁、铝表面被浓硫酸氧化为致密的氧化膜,从而阻止了酸与内层金属的进一步反应,所以常温下可以用铁、铝制容器来盛装浓硫酸。浓硫酸还可以与一些非金属及某些化合物反应,浓硫酸在化学反应中常作氧化剂。
练习:写出下面两个反应的化学方程式并指出氧化剂、还原剂、氧化产物和还原产物
(1)铜与浓硫酸在加热条件反应
(2)碳与浓硫酸在加热条件反应
Cu + 2H2SO4 CuSO4 + SO2 ↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
C + 2H2SO4 CO2↑ + 2SO2 ↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
三、浓硫酸的用途
思考:
1、能用浓硫酸干燥的气体有哪些?
2、浓硫酸不能干燥哪些气体?
1、能被浓硫酸干燥的气体有:
O2、N2、CO、CO2、CH4 、 SO2、HCl、Cl2等
2、不能用来干燥:
碱性气体(如氨气);还原性气体(H2S、HI、HBr)
课堂小结
1.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
2.下列关于浓硫酸的叙述不正确的是( )
A.浓硫酸能与金属、非金属单质反应,作氧化剂,被还原为二氧化硫
B.浓硫酸可将铜、汞等金属氧化,生成高价态金属的硫酸盐
C.浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸
D.浓硫酸具有强氧化性,加热时浓硫酸能将铁、铝钝化
C
D
明矾
KAl(SO4)2·12H2O
芒硝
Na2SO4·10H2O
常见的几种硫酸盐
绿矾
皓矾(ZnSO4·7H2O)
常见的几种硫酸盐
胆矾
(又称蓝矾)
常见的几种硫酸盐
硫酸钡晶体
(重晶石)
4.1.2 硫酸的工业制备
浓硫酸的性质
硫酸是当令世界上最重要的化工产品之一,美誉为“化学工业之母”,工业上常用硫酸的年产量来衡量一个国家的化工生产能力。早在1000年以前,我国就用加热胆矾(CuSO4·5H2O)或绿矾(FeSO4·7H2O)的方法来制硫酸,如:《黄帝九鼎神丹经诀》——“炼石胆取精华法”。
硫酸的应用史和重要作用
CuSO4·5H2O==CuO+SO3↑+5H2O
SO3 + H2O==H2SO4
胆矾
绿矾
2FeSO4·7H2O==Fe2O3+SO2↑+SO3↑+14 H2O
SO3+H2O==H2SO4
沸腾炉
接触室
吸收塔
净化
冷却
一、硫酸的工业制备——接触法
硫黄或含硫矿石(硫铁矿)
空气
98.3%的浓H2SO4
造气(生成SO2)
接触氧化
(生成SO3)
SO3吸收
(生成H2SO4)
沸腾炉
接触室
吸收塔
4FeS2 + 11O2 == 2Fe2O3 + 8SO2
S + O2 == SO2
SO3+H2O===H2SO4
2SO2 + O2 2SO3
H2SO4
S
SO3
SO2
(1)
(2)
(3)
思考并回答下列问题:
(1)有哪些特殊的工艺要求?硫铁矿为什么要粉碎?
(2)从沸腾炉中出来的气体中含有哪些杂质,怎样处理?
(3)热交换器起什么作用?为什么控制温度在450℃?
(4)为什么用98.3%的浓硫酸吸收而不用水吸收?
(5)浓硫酸为什么要从上向下喷下?
(6)会产生哪些废弃物?
硫铁矿中FeS2的质量分数一般为20%-50%,制酸工艺过程中所产生的矿渣和废气便生产装置变得较为复杂。而采用硫黄制酸法,工艺流程和设备相对简易。硫黄含杂质少,燃烧生成的气体含杂质少,可免去气体净化的过程,制备过程也不产生矿渣。因此,硫铁矿制酸投资几乎是同等规模硫黄制酸设备的两倍。但硫黄原料价格高于硫铁矿,具体选用何种硫酸制备工艺,应根据实际条件和要求进行决策。
(1)原料廉价且稳定,降低运输成本。
(2)从环保、成本等角度选择合适的化学反应,保证在反应中能充分接触。
(3)制备流程简单高效,能耗低,反应放出的热量质尽可能加以循环利用,生副产物较少。
(4)制备过程绿色,环保,不使用或生成对环境有害的物质。
化学工业制备的要求
二、浓硫酸的特性
实验1、向表面皿中加入少量胆矾,
再加入约3mL浓硫酸,搅拌,观察实验现象。
实验现象:蓝色的胆矾(CuSO4·5H2O)变成白色(CuSO4)
1、吸水性
2、脱水性
实验2、取2g蔗糖,放入大试管中,加2-3滴水,再加入约3mL的浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,将玻璃导管的另一端插入盛有品红溶液的试管中,观察实验现象。
实验现象:蔗糖由白变黑,慢慢膨胀,形成疏松的海绵状,同时有刺激性气味产生。
脱水性:
浓硫酸按照水的组成比,夺取某些有机物中的氢、氧元素形成水分子,可使蔗糖、纤维素等物质脱水,这叫脱水性。
C12H22O11 12C + 11H2O
3、强氧化性
实验结论:铜与浓硫酸在加热条件发生反应,生成硫酸铜、二氧化硫和水,浓硫酸表现强氧化性。
实验3、将一小片铜片放入试管中,然后加入2mL浓硫酸,加热,观察实验现象。
实验现象:铜逐渐溶解,溶液变蓝,有无色刺激性气体生成,该气体可以使品红溶液褪色,加热退色溶液,溶液红色回复。
浓硫酸能与绝大多数金属发生反应,在加热时表现出更强的氧化性。在常温下,铁、铝等少数金属遇浓硫酸会发生钝化,铁、铝表面被浓硫酸氧化为致密的氧化膜,从而阻止了酸与内层金属的进一步反应,所以常温下可以用铁、铝制容器来盛装浓硫酸。浓硫酸还可以与一些非金属及某些化合物反应,浓硫酸在化学反应中常作氧化剂。
练习:写出下面两个反应的化学方程式并指出氧化剂、还原剂、氧化产物和还原产物
(1)铜与浓硫酸在加热条件反应
(2)碳与浓硫酸在加热条件反应
Cu + 2H2SO4 CuSO4 + SO2 ↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
C + 2H2SO4 CO2↑ + 2SO2 ↑ + 2H2O
还原剂
氧化剂
氧化产物
还原产物
三、浓硫酸的用途
思考:
1、能用浓硫酸干燥的气体有哪些?
2、浓硫酸不能干燥哪些气体?
1、能被浓硫酸干燥的气体有:
O2、N2、CO、CO2、CH4 、 SO2、HCl、Cl2等
2、不能用来干燥:
碱性气体(如氨气);还原性气体(H2S、HI、HBr)
课堂小结
1.浓硫酸与下列物质作用时,只表现强氧化性的是( )
A.蓝色硫酸铜晶体 B.木材炭化
C.红热木炭 D.氧化铝
2.下列关于浓硫酸的叙述不正确的是( )
A.浓硫酸能与金属、非金属单质反应,作氧化剂,被还原为二氧化硫
B.浓硫酸可将铜、汞等金属氧化,生成高价态金属的硫酸盐
C.浓硫酸可将碳、磷等非金属单质氧化成高价态的氧化物或含氧酸
D.浓硫酸具有强氧化性,加热时浓硫酸能将铁、铝钝化
C
D
明矾
KAl(SO4)2·12H2O
芒硝
Na2SO4·10H2O
常见的几种硫酸盐
绿矾
皓矾(ZnSO4·7H2O)
常见的几种硫酸盐
胆矾
(又称蓝矾)
常见的几种硫酸盐
硫酸钡晶体
(重晶石)
