2.1.3 碳酸钠和碳酸氢钠 课件(共43张PPT) 高中化学人教版(2019)必修第一册
文档属性
| 名称 | 2.1.3 碳酸钠和碳酸氢钠 课件(共43张PPT) 高中化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 24.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-27 21:22:09 | ||
图片预览










文档简介
(共43张PPT)
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
第一节 钠及其化合物
第三课时 碳酸钠与碳酸氢钠
第二章 海水中的重要元素—钠和氯
碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
化学式
颜色、状态
俗 名
白色粉末
白色晶体
Na2CO3
NaHCO3
纯碱、苏打
小苏打
生活中的化学
碳酸钠
(苏打)
碳酸氢钠
(小苏打)
硫代硫酸钠(大苏打)
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象
结块变成晶体;
温度升高
部分溶解;
温度降低
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
Na2CO3 + xH2O ====== Na2CO3·xH2O
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(5)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
1.Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
观察外观;加 1 mL水;触摸试管底部
加10mL水
加2滴酚酞溶液
结论 细小白色晶体;加水部分溶解;反应吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
一、碳酸钠和碳酸氢钠的性质
知识梳理
20℃时
S(Na2CO3)=21.5g
S(NaHCO3)=9.60 g
25℃
0.1mol/LNa2CO3:pH=11.6
0.1mol/L NaHCO3 pH =8.31
实验操作 实验现象 化学方程式及结论
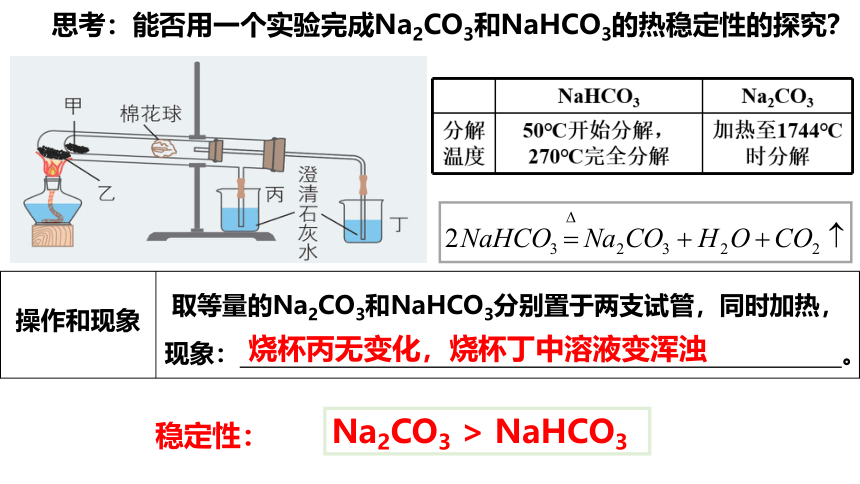
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 _____,试管口有 ____________
Na2CO3很稳定,受热不易发生分解
小液滴出现。
NaHCO3不稳定,受热容易分解,化学方程式为
【实验2-5】碳酸钠与碳酸氢钠的热稳定性对比实验
热稳定性:Na2CO3 >NaHCO3
思考:能否用一个实验完成Na2CO3和NaHCO3的热稳定性的探究?
操作和现象 取等量的Na2CO3和NaHCO3分别置于两支试管,同时加热, 现象: 。
烧杯丙无变化,烧杯丁中溶液变浑浊
稳定性:
Na2CO3 > NaHCO3
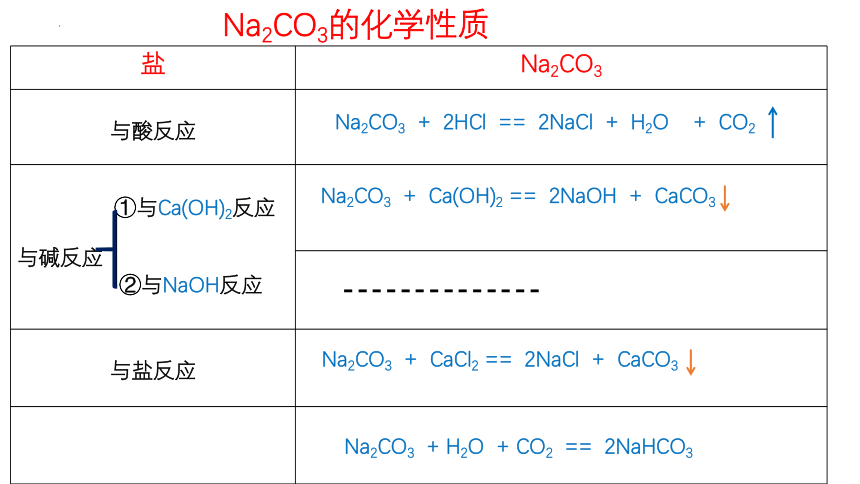
Na2CO3的化学性质
盐 Na2CO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
--------------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
Na2CO3 + H2O + CO2 == 2NaHCO3
互滴法鉴别Na2CO3溶液和稀盐酸
当两种物质反应时,由于量不同而造成反应现象各不相同,则可以通过改变滴加顺序,根据产生现象的不同进行鉴别。
(1)盐酸逐滴加入到Na2CO3溶液中
①现象:开始无明显现象,后有无色气体放出
②原理:CO32- +H+ =HCO3-(无明显现象)
HCO3- +H+==CO2↑+H2O( 放出无色气体)
(2)Na2CO3溶液逐滴加入到稀盐酸中
①现象:立即有无色气体放出
②原理:CO32- +2H+ =CO2↑+ H2O
NaHCO3的化学性质
盐 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
NaHCO3 + HCl == NaCl + H2O + CO2
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
--------------
--------------
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
NaHCO3 + HCl ==
NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
-----------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
-----------
归纳总结
Na2CO3 + H2O + CO2 == 2NaHCO3
-----------
反应慢
反应快
想一想
现有两个无标签试剂瓶,分别装有Na2CO3和NaHCO3,我们该如何鉴别?
加热法,前后质量减少或产生使澄清石灰水变浑浊的气体的是NaHCO3
气体法:①固体:逐滴加入稀盐酸,反应剧烈的是NaHCO3
②溶液:逐滴加入稀盐酸,立即产生气体的是NaHCO3
Na2CO3与NaHCO3的鉴别
沉淀法:加入CaCl2或BaCl2溶液,产生白色沉淀的是Na2CO3
酸碱法:等浓度的溶液,碱性强的是Na2CO3 ,碱性弱的是NaHCO3
Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
Na2CO3和NaHCO3相互转化
胃药---NaHCO3片
你 明 白 了吗?
1.去污粉中主要含碳酸钠,它为什么能去污?
碳酸钠溶液呈碱性,能和油脂发生反应,生成可溶性物质。
2.碳酸氢钠干粉灭火器中灭火剂主要是碳酸氢钠,加工饼干、蛋糕等食品时也常用到碳酸氢钠,碳酸氢钠起什么作用?
苏打饼干
碳酸氢钠在加热时生成二氧化碳,二氧化碳能灭火;加工饼干、蛋糕等食品时,碳酸氢钠受热生成二氧化碳有关,二氧化碳能使面团起泡,而使饼干、蛋糕蓬松。
3.患有胃病的人常因胃酸分泌过多而不适,碳酸氢钠片
能减轻病人的不适感,为什么?
碳酸氢钠片能与胃酸(含有盐酸)反应,从而降低了酸的浓度,使病人症状改善。
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:
胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
碳酸钠与碳酸氢钠用途对比
(1)按上图要求完成实验:在两支试管中分别加
入3mL稀盐酸,将两个各装有少量等质量的
Na2CO3、NaHCO3粉末的小气球分别套在两
支试管的管口。将气球内的Na2CO3和NaHCO3
同时倒入试管中。观察到的实验现象是____________________;NaHCO3与盐酸混合比Na2CO3与盐酸混合________________。
(2)实验结论:等质量的NaHCO3与盐酸反应比等质量的Na2CO3与盐酸反应产生气体多且剧烈。
Na2CO3、NaHCO3分别与盐酸反应的离子方程式为___________________________、_________________________
实验探究二:碳酸钠、碳酸氢钠与盐酸反应的比较
两个气球均膨胀
气球膨胀得快且大
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
俗名
颜色状态
溶解性
水溶液酸碱性
热稳定性
用途
白色粉末
细小白色晶体
碱性
碱性
纯碱、苏打
小苏打
易溶于水
易溶于水
受热分解
2NaHCO3 == Na2CO3 + H2O + CO2
受热不分解
归纳总结
>
>
>
洗涤剂、肥皂、玻璃、造纸、纺织、
食品发酵剂、胃药
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
NaHCO3 + HCl ==
NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
-----------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
-----------
归纳总结
Na2CO3 + H2O + CO2 == 2NaHCO3
-----------
反应慢
反应快
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(Na2CO3)
白色块状物
Na2CO3·10H2O
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
完成上述各变化过程中的化学反应方程式
4Na + O2 == 2Na2O Na2O + H2O == 2NaOH
2NaOH + CO2 +9H2O == Na2CO3·10H2O Na2CO3·xH2O == Na2CO3 + xH2O
01
1791年法国路布兰制碱法—首次实现了碳酸钠的工业生产
02
1861年比利时索尔维——氨碱法
03
1943年中国侯德榜——联合制碱法(侯氏制碱法)
了解纯碱的生成历史
路布兰制碱法
1791年,路布兰等人经过反复尝试终于熟练掌握了制碱的生产工艺。第1步反应通过氯化钠与硫酸反应制硫酸钠,与 Malherbe法相同。 路布兰的创新主要在第2步,将反复探索的质量比为100∶100∶50的硫酸钠、石灰石和木炭高温反应,反应后得到的产品是混合物,被称为“黑灰”。第3步,加水浸取黑灰,可把生成的碳酸钠溶解,过滤蒸发结晶后就得到碳酸钠的粗产品。
欧内斯特·索尔维
E.Ernest Solvay 1838-1922
比利时工业化学家,1860年索尔维到其叔父的煤气厂工作,研究煤气废液的用途。他想从废液中提取碳酸铵,但实验失败。1861年他又用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法),此反应已为前人发现,但投入工厂均失败。于是他在布鲁塞尔开设一个小厂从事试验。1863年创办一个正式的制碱工厂,实现了氨碱法的工业化,使制碱生产实现了连续化,食盐的利用率也提高了很多。产品由于质量纯净,而被称为纯碱。
索尔维制碱(Na2CO3)法
索尔维制碱(Na2CO3)法——又称氨碱法
索尔维制碱(Na2CO3)法
优点:原料易得便宜,产品纯度高、副产物循环,步骤简单可大规模生成。
缺点:原料利用率低,耗能高、副产物氯化钙使用价值不高。
侯德榜制碱法——又称联合制碱法
优点:提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足
我国化学工程专家侯德榜于1943年创立侯氏制碱法。
我
国
独
创
侯氏制碱法
侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。
1、原料: NaCl(饱和)、NH3、CO2等
2、反应原理:
制取碳酸氢钠:
NaCl(饱和)+NH3+H2O+CO2===NH4Cl+NaHCO3↓
制取碳酸钠:
2NaHCO3===Na2CO3+H2O+CO2↑
侯氏制碱法
侯德榜制碱法
3、优点:提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足。
索尔维制碱(Na2CO3)法
侯德榜制碱法——又称联合制碱法
焰色试验
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
思考
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
焰色试验
注意:钠元素的焰色试验是黄色
钾元素的焰色试验呈蓝色
(透过蓝色的钴玻璃观察)。
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
正误判断
(1)因酒精灯火焰略带黄色(因为玻璃中含钠元素),因此本实验中火源最好用酒精喷灯或煤气灯,它们的火焰无色。
(3)做钾元素的焰色试验时,要透过蓝色钴玻璃片进行观察。因为蓝色钴玻璃能吸收黄光,排除钠及其化合物的焰色干扰。
(4)焰色试验属于物理变化。
注意事项:
(2)不是所有的金属都能发生焰色反应如Fe、Pt,所以本实验采用铂丝,也可采用铁丝。
一些金属及化合物的焰色试验
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
根据火焰呈现的特征颜色,可以判试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
易错警示
(1)焰色反应是元素的性质,而不是单质或化合物的性质,与存在状态无关。
(2)焰色反应可以用于鉴别物质,这种鉴别物质的方法属于物理方法,而不是化学方法。
1、下列说法正确的是
A.焰色反应为黄色,说明该物质中肯定含有钠元素
B.某物质的焰色反应不显紫色(未透过蓝色钴玻璃),说 明该物质中肯定没有钾元素
C.焰色反应不能用于物质的鉴别
D.焰色反应是化学变化
解析 焰色反应是物理变化;焰色反应时,钠元素的黄光会干扰钾的紫光,可用蓝色钴玻璃滤去钠的黄光;焰色反应常被用于物质的鉴别。
√
课堂检测
2.下列说法中正确的是
A.焰色反应是化学变化
B.用稀盐酸清洗做焰色反应的铂丝(镍丝或铁丝)
C.焰色反应均应透过蓝色钴玻璃观察
D.利用焰色反应可区分NaCl与Na2CO3固体
√
3.下列有关Na2CO3与NaHCO3的性质中不正确的是( )
A.相同浓度两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同浓度的稀硫酸反应放出气泡的速率:NaHCO3D.热稳定性:NaHCO3C
4.现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.②③ B.①③ C.③④ D.②⑤
A
5.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
A
在面粉发酵或油条制作时常常用到纯碱或小苏打,你知道纯碱、小苏打的成分是什么吗?
第一节 钠及其化合物
第三课时 碳酸钠与碳酸氢钠
第二章 海水中的重要元素—钠和氯
碳酸钠和碳酸氢钠
碳酸钠 碳酸氢钠
化学式
颜色、状态
俗 名
白色粉末
白色晶体
Na2CO3
NaHCO3
纯碱、苏打
小苏打
生活中的化学
碳酸钠
(苏打)
碳酸氢钠
(小苏打)
硫代硫酸钠(大苏打)
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(2)向以上两支试管中分别滴入几滴水,振荡,观察现象
结块变成晶体;
温度升高
部分溶解;
温度降低
Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体——水合碳酸钠(Na2CO3·xH2O),碳酸钠晶体在干燥的空气中逐渐失去结晶水变成Na2CO3粉末。
Na2CO3·xH2O ====== Na2CO3 + xH2O
干燥的空气
碳酸钠-风化
Na2CO3
﹙粉末﹚
失H2O
Na2CO3 xH2O
﹙水合碳酸钠晶体﹚
得H2O
风化
Na2CO3 + xH2O ====== Na2CO3·xH2O
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象
振荡后全部溶解
仍有部分未溶解
碳酸钠与碳酸氢钠
【实验2-4】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),完成下列实验,并将实验现象和相应的结论填入下表。
盐 Na2CO3 NaHCO3
(5)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象
溶液变红(较深)
溶液微红
1.Na2CO3和NaHCO3在水中的溶解性及其溶液的酸碱性
步骤 Na2CO3 NaHCO3
观察外观;加 1 mL水;触摸试管底部
加10mL水
加2滴酚酞溶液
结论 细小白色晶体;加水部分溶解;反应吸热
白色粉末;加水结块成晶体;放热明显
振荡时间长时可溶解
部分溶解
溶液呈红色
溶液呈浅红色
Na2CO3>NaHCO3
Na2CO3>NaHCO3
溶解性
碱性
一、碳酸钠和碳酸氢钠的性质
知识梳理
20℃时
S(Na2CO3)=21.5g
S(NaHCO3)=9.60 g
25℃
0.1mol/LNa2CO3:pH=11.6
0.1mol/L NaHCO3 pH =8.31
实验操作 实验现象 化学方程式及结论
刚加热时,石灰水中有气泡,之后无气泡,澄清石灰水_____________
石灰水中有气泡,澄清石灰水 _____,试管口有 ____________
Na2CO3很稳定,受热不易发生分解
小液滴出现。
NaHCO3不稳定,受热容易分解,化学方程式为
【实验2-5】碳酸钠与碳酸氢钠的热稳定性对比实验
热稳定性:Na2CO3 >NaHCO3
思考:能否用一个实验完成Na2CO3和NaHCO3的热稳定性的探究?
操作和现象 取等量的Na2CO3和NaHCO3分别置于两支试管,同时加热, 现象: 。
烧杯丙无变化,烧杯丁中溶液变浑浊
稳定性:
Na2CO3 > NaHCO3
Na2CO3的化学性质
盐 Na2CO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
--------------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
Na2CO3 + H2O + CO2 == 2NaHCO3
互滴法鉴别Na2CO3溶液和稀盐酸
当两种物质反应时,由于量不同而造成反应现象各不相同,则可以通过改变滴加顺序,根据产生现象的不同进行鉴别。
(1)盐酸逐滴加入到Na2CO3溶液中
①现象:开始无明显现象,后有无色气体放出
②原理:CO32- +H+ =HCO3-(无明显现象)
HCO3- +H+==CO2↑+H2O( 放出无色气体)
(2)Na2CO3溶液逐滴加入到稀盐酸中
①现象:立即有无色气体放出
②原理:CO32- +2H+ =CO2↑+ H2O
NaHCO3的化学性质
盐 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
NaHCO3 + HCl == NaCl + H2O + CO2
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
--------------
--------------
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
NaHCO3 + HCl ==
NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
-----------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
-----------
归纳总结
Na2CO3 + H2O + CO2 == 2NaHCO3
-----------
反应慢
反应快
想一想
现有两个无标签试剂瓶,分别装有Na2CO3和NaHCO3,我们该如何鉴别?
加热法,前后质量减少或产生使澄清石灰水变浑浊的气体的是NaHCO3
气体法:①固体:逐滴加入稀盐酸,反应剧烈的是NaHCO3
②溶液:逐滴加入稀盐酸,立即产生气体的是NaHCO3
Na2CO3与NaHCO3的鉴别
沉淀法:加入CaCl2或BaCl2溶液,产生白色沉淀的是Na2CO3
酸碱法:等浓度的溶液,碱性强的是Na2CO3 ,碱性弱的是NaHCO3
Na2CO3和NaHCO3混合物的除杂
混合物(括号内为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3)
NaHCO3溶液(Na2CO3)
Na2CO3溶液(NaHCO3)
加热至恒重
通入足量CO2气体
加入适量NaOH溶液
Na2CO3
NaHCO3
①CO2 + H2O
②NaOH
②HCl(少量)
①
Na2CO3和NaHCO3相互转化
胃药---NaHCO3片
你 明 白 了吗?
1.去污粉中主要含碳酸钠,它为什么能去污?
碳酸钠溶液呈碱性,能和油脂发生反应,生成可溶性物质。
2.碳酸氢钠干粉灭火器中灭火剂主要是碳酸氢钠,加工饼干、蛋糕等食品时也常用到碳酸氢钠,碳酸氢钠起什么作用?
苏打饼干
碳酸氢钠在加热时生成二氧化碳,二氧化碳能灭火;加工饼干、蛋糕等食品时,碳酸氢钠受热生成二氧化碳有关,二氧化碳能使面团起泡,而使饼干、蛋糕蓬松。
3.患有胃病的人常因胃酸分泌过多而不适,碳酸氢钠片
能减轻病人的不适感,为什么?
碳酸氢钠片能与胃酸(含有盐酸)反应,从而降低了酸的浓度,使病人症状改善。
为何不用碳酸钠来治疗胃酸过多,而是采用碳酸氢钠?
Na2CO3碱性较强,反应速率较慢,不适宜做胃药。
NaHCO3碱性较强,反应速率快,可以治疗用于治疗胃酸过多。
温馨提示:
胃痛类型很多,胃溃疡不能吃含有
小苏打的药物进行治疗,反而会加重病情!
碳酸钠与碳酸氢钠用途对比
(1)按上图要求完成实验:在两支试管中分别加
入3mL稀盐酸,将两个各装有少量等质量的
Na2CO3、NaHCO3粉末的小气球分别套在两
支试管的管口。将气球内的Na2CO3和NaHCO3
同时倒入试管中。观察到的实验现象是____________________;NaHCO3与盐酸混合比Na2CO3与盐酸混合________________。
(2)实验结论:等质量的NaHCO3与盐酸反应比等质量的Na2CO3与盐酸反应产生气体多且剧烈。
Na2CO3、NaHCO3分别与盐酸反应的离子方程式为___________________________、_________________________
实验探究二:碳酸钠、碳酸氢钠与盐酸反应的比较
两个气球均膨胀
气球膨胀得快且大
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
俗名
颜色状态
溶解性
水溶液酸碱性
热稳定性
用途
白色粉末
细小白色晶体
碱性
碱性
纯碱、苏打
小苏打
易溶于水
易溶于水
受热分解
2NaHCO3 == Na2CO3 + H2O + CO2
受热不分解
归纳总结
>
>
>
洗涤剂、肥皂、玻璃、造纸、纺织、
食品发酵剂、胃药
Na2CO3和NaHCO3的比较
盐 Na2CO3 NaHCO3
与酸反应
①与Ca(OH)2反应 与碱反应 ②与NaOH反应
与盐反应
与CO2反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2
NaHCO3 + HCl ==
NaCl + H2O + CO2
Na2CO3 + Ca(OH)2 == 2NaOH + CaCO3
NaHCO3 + Ca(OH)2 == Na2CO3 + CaCO3 + H2O
NaHCO3 + NaOH == Na2CO3 + H2O
-----------
Na2CO3 + CaCl2 == 2NaCl + CaCO3
-----------
归纳总结
Na2CO3 + H2O + CO2 == 2NaHCO3
-----------
反应慢
反应快
银白色金属钠
(Na)
表面变暗
(生成Na2O)
出现白色固体
(生成NaOH)
表面变成溶液 (NaOH潮解)
白色粉末状物质
(Na2CO3)
白色块状物
Na2CO3·10H2O
O2
风化
CO2
H2O
H2O
思考:Na长时间暴露空气,最后生成什么物质?
①
⑤
④
③
②
完成上述各变化过程中的化学反应方程式
4Na + O2 == 2Na2O Na2O + H2O == 2NaOH
2NaOH + CO2 +9H2O == Na2CO3·10H2O Na2CO3·xH2O == Na2CO3 + xH2O
01
1791年法国路布兰制碱法—首次实现了碳酸钠的工业生产
02
1861年比利时索尔维——氨碱法
03
1943年中国侯德榜——联合制碱法(侯氏制碱法)
了解纯碱的生成历史
路布兰制碱法
1791年,路布兰等人经过反复尝试终于熟练掌握了制碱的生产工艺。第1步反应通过氯化钠与硫酸反应制硫酸钠,与 Malherbe法相同。 路布兰的创新主要在第2步,将反复探索的质量比为100∶100∶50的硫酸钠、石灰石和木炭高温反应,反应后得到的产品是混合物,被称为“黑灰”。第3步,加水浸取黑灰,可把生成的碳酸钠溶解,过滤蒸发结晶后就得到碳酸钠的粗产品。
欧内斯特·索尔维
E.Ernest Solvay 1838-1922
比利时工业化学家,1860年索尔维到其叔父的煤气厂工作,研究煤气废液的用途。他想从废液中提取碳酸铵,但实验失败。1861年他又用氨溶液、二氧化碳与食盐混合制成碳酸钠(称为氨碱法),此反应已为前人发现,但投入工厂均失败。于是他在布鲁塞尔开设一个小厂从事试验。1863年创办一个正式的制碱工厂,实现了氨碱法的工业化,使制碱生产实现了连续化,食盐的利用率也提高了很多。产品由于质量纯净,而被称为纯碱。
索尔维制碱(Na2CO3)法
索尔维制碱(Na2CO3)法——又称氨碱法
索尔维制碱(Na2CO3)法
优点:原料易得便宜,产品纯度高、副产物循环,步骤简单可大规模生成。
缺点:原料利用率低,耗能高、副产物氯化钙使用价值不高。
侯德榜制碱法——又称联合制碱法
优点:提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足
我国化学工程专家侯德榜于1943年创立侯氏制碱法。
我
国
独
创
侯氏制碱法
侯德榜发明的侯氏制碱法的原理是将二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出。
1、原料: NaCl(饱和)、NH3、CO2等
2、反应原理:
制取碳酸氢钠:
NaCl(饱和)+NH3+H2O+CO2===NH4Cl+NaHCO3↓
制取碳酸钠:
2NaHCO3===Na2CO3+H2O+CO2↑
侯氏制碱法
侯德榜制碱法
3、优点:提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本,克服了氨碱法的不足。
索尔维制碱(Na2CO3)法
侯德榜制碱法——又称联合制碱法
焰色试验
大家知道节日燃放的五彩缤纷的烟花是怎么来的吗?
思考
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,根据火焰呈现的特征颜色,可以判断试样所含的金属元素,这在化学上叫做焰色试验。
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈 。
黄色
②钠燃烧时,火焰呈 。
黄色
焰色试验
操作
盐酸
原火焰颜色相同
试样
火焰的颜色
盐酸
无色
焰色试验
注意:钠元素的焰色试验是黄色
钾元素的焰色试验呈蓝色
(透过蓝色的钴玻璃观察)。
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
正误判断
(1)因酒精灯火焰略带黄色(因为玻璃中含钠元素),因此本实验中火源最好用酒精喷灯或煤气灯,它们的火焰无色。
(3)做钾元素的焰色试验时,要透过蓝色钴玻璃片进行观察。因为蓝色钴玻璃能吸收黄光,排除钠及其化合物的焰色干扰。
(4)焰色试验属于物理变化。
注意事项:
(2)不是所有的金属都能发生焰色反应如Fe、Pt,所以本实验采用铂丝,也可采用铁丝。
一些金属及化合物的焰色试验
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
根据火焰呈现的特征颜色,可以判试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
易错警示
(1)焰色反应是元素的性质,而不是单质或化合物的性质,与存在状态无关。
(2)焰色反应可以用于鉴别物质,这种鉴别物质的方法属于物理方法,而不是化学方法。
1、下列说法正确的是
A.焰色反应为黄色,说明该物质中肯定含有钠元素
B.某物质的焰色反应不显紫色(未透过蓝色钴玻璃),说 明该物质中肯定没有钾元素
C.焰色反应不能用于物质的鉴别
D.焰色反应是化学变化
解析 焰色反应是物理变化;焰色反应时,钠元素的黄光会干扰钾的紫光,可用蓝色钴玻璃滤去钠的黄光;焰色反应常被用于物质的鉴别。
√
课堂检测
2.下列说法中正确的是
A.焰色反应是化学变化
B.用稀盐酸清洗做焰色反应的铂丝(镍丝或铁丝)
C.焰色反应均应透过蓝色钴玻璃观察
D.利用焰色反应可区分NaCl与Na2CO3固体
√
3.下列有关Na2CO3与NaHCO3的性质中不正确的是( )
A.相同浓度两溶液的碱性:Na2CO3>NaHCO3
B.相同条件下在水中的溶解度:Na2CO3>NaHCO3
C.与相同浓度的稀硫酸反应放出气泡的速率:NaHCO3
4.现有两瓶无标签的无色溶液,分别装有Na2CO3和NaHCO3,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.②③ B.①③ C.③④ D.②⑤
A
5.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
A
