化学苏教版(2019)必修第一册 1.1.2物质的转化化学反应的分类课件(共17张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 1.1.2物质的转化化学反应的分类课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 172.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 10:23:39 | ||
图片预览





文档简介
(共17张PPT)
专题一 物质的分类及计量
——物质及其反应的分类
物质的转化 化学反应的分类
交流与讨论
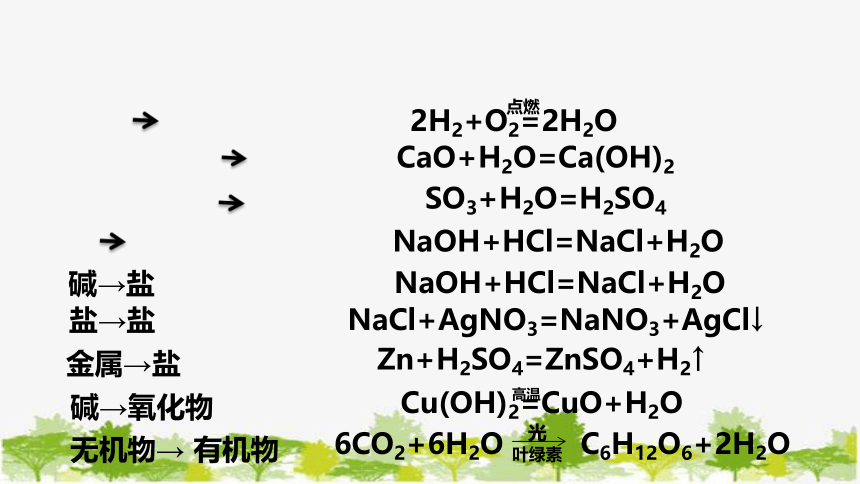
根据已学知识,举例说明下表中所列物质的转化反应,并将你所知道的其他反应类型补充到表中。
2H2+O2=2H2O
点燃
CaO+H2O=Ca(OH)2
SO3+H2O=H2SO4
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
NaCl+AgNO3=NaNO3+AgCl↓
Zn+H2SO4=ZnSO4+H2↑
Cu(OH)2=CuO+H2O
高温
6CO2+6H2O C6H12O6+2H2O
光
叶绿素
碱→盐
盐→盐
金属→盐
碱→氧化物
无机物→ 有机物
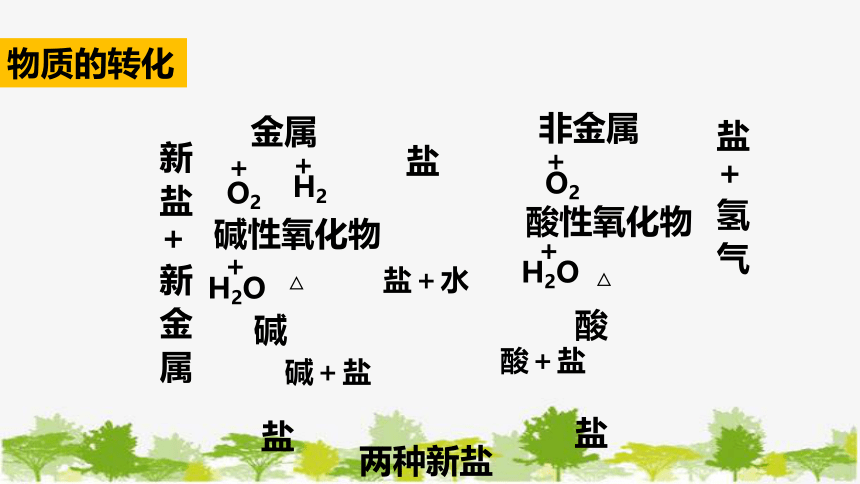
金属
+
O2
碱性氧化物
+
H2
+
H2O
△
碱
盐
非金属
+
O2
酸性氧化物
+
H2O
△
酸
盐
盐+水
碱+盐
酸+盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
物质的转化
CaCO3
CaO
Ca(OH)2
CaCl2
Ca
①
④
③
⑥
⑧
⑦
⑤
⑨
⑩
②
交流与讨论
联系课本8页习题,按顺序完成下列方程式,指出有元素化合价改变的反应,且从四种基本反应类型角度对反应进行分类。
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
核对答案
反应物和生成物的类别以及反应前后物质种类的多少。
思考:初中学过的化学反应四种基本类型的分类依据是什么?怎么判断反应类型?
交流与讨论
分类依据:
反应类型:
化合反应、分解反应、置换反应、复分解反应
科学史话
人工首次利用无机化合物合成有机化合物
1828年,德国化学家维勒
利用蒸发无机化合物氰酸氨NH4CNO的水溶液合成有机化合物尿素CO(NH2)2
NH4CNO → CO(NH2)2
加热
无机化合物 有机化合物
尿素的分子结构模型
化合反应
分解反应
置换反应
复分解反应
四种基本反应类型
由两种或多种物质生成一种物质的反应(多变一)
一种物质生成两种及以上物质的反应(一变多)
单质加化合物生成另一单质和另一化合物的反应
两种化合物相互交换成分,生成另两种化合物的反应
2Ca + O2 = 2CaO
实例
CaCO3 = CaO+CO2 ↑
Ca+2H2O= Ca(OH)2+H2↑
Ca(OH)2 +2HCl =
CaCl2+ 2H2O
判断下列反应能否发生:
1.Zn+HCl 2.Ag+HCl 3.Fe+H2SO4(稀) 4.Zn+CuSO4 5.Cu+ZnSO4
金属与盐溶液发生置换反应的条件:①前置后(K、Ca、Na不行)②H前面的金属遇盐酸或稀硫酸可置换出H2
整理与归纳
思考:请说明一种金属与另一种盐溶液发生置换反应的条件?
判断下列反应能否发生:
1.Na2CO3+HCl 2.NaOH+H2SO4
3.NaCl+K2CO3 4.CaCO3+NaCl
复分解反应发生的条件:①酸、碱、盐在溶液中反应
②生成物有气体、沉淀或水生成
整理与归纳
思考:请说明复分解反应发生的条件?
+3
+2
0
+4
这是什么反应?
定义:
有元素化合价发生变化的反应
特征:
反应前后元素化合价发生变化
交流与讨论
有元素化合价发生变化
氧化还原反应
(元素化合价不发生变化的反应称为非氧化还原反应)
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
思考:下列反应哪些属于氧化还原反应?
(9)Fe+CuSO4 = FeSO4+Cu
分析:
氧化还原反应与四种基本反应类型有什么关系?
氧化还原反应与四种基本反应类型的关系及一般规律:
1.有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应。
2.置换反应全部是氧化还原反应。
3.复分解反应都是非氧化还原反应。
4.有单质参与同时也有单质生成的反应不一定是氧化还原反应
例如:3O2= 2O3
放电
是非氧化还原反应
氧化还原反应
化合反应
分解反应
置换反应
氧化还原反应与基本反应类型的关系图
复分解反应
1、氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
A、Cl2+2KBr=Br2 + 2KCl
B、2NaHCO3 =Na2CO3+H2O+CO2↑
C、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
D、2Na2O2+2CO2=2Na2CO3+O2
课堂练习
D
2、下列说法正确的是 ( )
A、氧化还原反应一定有物质“失去氧”和“得到氧”
B、HCl+NaOH=NaCl+H2O 是氧化还原反应
C、凡是有元素化合价发生变化的反应都是氧化还原反应
D、2H2 + O2=2H2O 是非氧化还原反应
C
课堂练习
专题一 物质的分类及计量
——物质及其反应的分类
物质的转化 化学反应的分类
交流与讨论
根据已学知识,举例说明下表中所列物质的转化反应,并将你所知道的其他反应类型补充到表中。
2H2+O2=2H2O
点燃
CaO+H2O=Ca(OH)2
SO3+H2O=H2SO4
NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O
NaCl+AgNO3=NaNO3+AgCl↓
Zn+H2SO4=ZnSO4+H2↑
Cu(OH)2=CuO+H2O
高温
6CO2+6H2O C6H12O6+2H2O
光
叶绿素
碱→盐
盐→盐
金属→盐
碱→氧化物
无机物→ 有机物
金属
+
O2
碱性氧化物
+
H2
+
H2O
△
碱
盐
非金属
+
O2
酸性氧化物
+
H2O
△
酸
盐
盐+水
碱+盐
酸+盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
物质的转化
CaCO3
CaO
Ca(OH)2
CaCl2
Ca
①
④
③
⑥
⑧
⑦
⑤
⑨
⑩
②
交流与讨论
联系课本8页习题,按顺序完成下列方程式,指出有元素化合价改变的反应,且从四种基本反应类型角度对反应进行分类。
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
核对答案
反应物和生成物的类别以及反应前后物质种类的多少。
思考:初中学过的化学反应四种基本类型的分类依据是什么?怎么判断反应类型?
交流与讨论
分类依据:
反应类型:
化合反应、分解反应、置换反应、复分解反应
科学史话
人工首次利用无机化合物合成有机化合物
1828年,德国化学家维勒
利用蒸发无机化合物氰酸氨NH4CNO的水溶液合成有机化合物尿素CO(NH2)2
NH4CNO → CO(NH2)2
加热
无机化合物 有机化合物
尿素的分子结构模型
化合反应
分解反应
置换反应
复分解反应
四种基本反应类型
由两种或多种物质生成一种物质的反应(多变一)
一种物质生成两种及以上物质的反应(一变多)
单质加化合物生成另一单质和另一化合物的反应
两种化合物相互交换成分,生成另两种化合物的反应
2Ca + O2 = 2CaO
实例
CaCO3 = CaO+CO2 ↑
Ca+2H2O= Ca(OH)2+H2↑
Ca(OH)2 +2HCl =
CaCl2+ 2H2O
判断下列反应能否发生:
1.Zn+HCl 2.Ag+HCl 3.Fe+H2SO4(稀) 4.Zn+CuSO4 5.Cu+ZnSO4
金属与盐溶液发生置换反应的条件:①前置后(K、Ca、Na不行)②H前面的金属遇盐酸或稀硫酸可置换出H2
整理与归纳
思考:请说明一种金属与另一种盐溶液发生置换反应的条件?
判断下列反应能否发生:
1.Na2CO3+HCl 2.NaOH+H2SO4
3.NaCl+K2CO3 4.CaCO3+NaCl
复分解反应发生的条件:①酸、碱、盐在溶液中反应
②生成物有气体、沉淀或水生成
整理与归纳
思考:请说明复分解反应发生的条件?
+3
+2
0
+4
这是什么反应?
定义:
有元素化合价发生变化的反应
特征:
反应前后元素化合价发生变化
交流与讨论
有元素化合价发生变化
氧化还原反应
(元素化合价不发生变化的反应称为非氧化还原反应)
(1)CaO+H2O= Ca(OH)2
(7)Ca(OH)2 +2HCl = CaCl2+ 2H2O
化合反应
(8)Ca+2H2O= Ca(OH)2+H2↑
分解反应
复分解反应
置换反应
(3)Ca +Cl2= CaCl2
点燃
(4)CaCO3 = CaO+CO2 ↑
高温
(5) CaCl2= Ca +Cl2 ↑
通电
(6)Ca(OH)2+ CO2= CaCO3↓ +H2O
(2) 2Ca + O2 = 2CaO
思考:下列反应哪些属于氧化还原反应?
(9)Fe+CuSO4 = FeSO4+Cu
分析:
氧化还原反应与四种基本反应类型有什么关系?
氧化还原反应与四种基本反应类型的关系及一般规律:
1.有单质参加的化合反应和有单质生成的分解反应一定是氧化还原反应。
2.置换反应全部是氧化还原反应。
3.复分解反应都是非氧化还原反应。
4.有单质参与同时也有单质生成的反应不一定是氧化还原反应
例如:3O2= 2O3
放电
是非氧化还原反应
氧化还原反应
化合反应
分解反应
置换反应
氧化还原反应与基本反应类型的关系图
复分解反应
1、氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )
A、Cl2+2KBr=Br2 + 2KCl
B、2NaHCO3 =Na2CO3+H2O+CO2↑
C、4Fe(OH)2+O2+2H2O=4Fe(OH)3↓
D、2Na2O2+2CO2=2Na2CO3+O2
课堂练习
D
2、下列说法正确的是 ( )
A、氧化还原反应一定有物质“失去氧”和“得到氧”
B、HCl+NaOH=NaCl+H2O 是氧化还原反应
C、凡是有元素化合价发生变化的反应都是氧化还原反应
D、2H2 + O2=2H2O 是非氧化还原反应
C
课堂练习
