化学苏教版(2019)必修第一册 5.2.1离子键课件(共15张PPT)
文档属性
| 名称 | 化学苏教版(2019)必修第一册 5.2.1离子键课件(共15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 147.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 10:24:42 | ||
图片预览






文档简介
(共15张PPT)
5.2.1 离子键
一、化学键
1.定义:我们把物质中直接相邻的原子或离子之间存在的强的相互作用叫做化学键。
2.分类:化学键分为离子键、共价键。
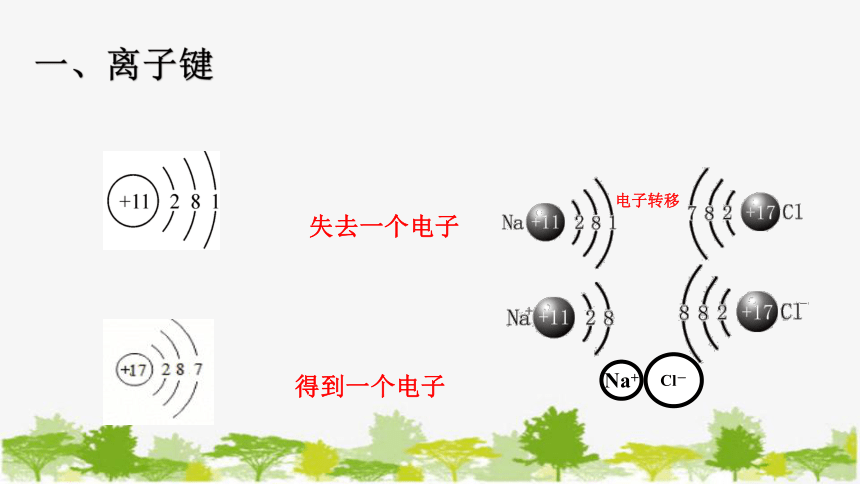
【问题1】:NaCl的形成过程来分析离子键是如何形成的。在氯化钠的形成过程中,哪种原子得到电子,哪种原子失去电子呢?请大家用原子结构示意图,完成下列表格。
思考
Na+
Cl-
电子转移
一、离子键
失去一个电子
得到一个电子
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些作用力?
正、负电荷之间的静电引力,以及原子核与原子核、核外电子与核外电子之间的静电斥力,当阴、阳离子达到一定距离后,二者达到平衡,因此,离子键的实质就是静电引力与静电斥力达到平衡时的静电作用。
一、离子键
1. 定义:使阴、阳离子结合成化合物的静电作用。
2. 成键微粒:阴、阳离子
3. 相互作用:静电作用(静电引力和静电排斥力)
4. 离子化合物:由离子键形成的化合物叫做离子化合物。
含有离子键的化合物就是离子化合物。
思考
哪些元素的原子能以这种方式结合?这种结合方式与它们的原子结构有什么关系?
练习
请大家判断下列化合物哪些属于离子化合物?
Na2O、SO2、CaCl2、H2O、NH4Cl、HCl、MgSO4、NH3
归纳总结
离子化合物的判断方法依据:
阳离子通常为活泼的金阳离子或铵根离子(NH4+),阴离子通常为活泼的非金属离子或原子团离子(如OH-、SO42-、NO3-等),即判断依据是否含有活泼的金属阳离子或铵根离子(NH4+)
二、电子式
(1)定义在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
原子电子式
Na
Cl
Mg
Br
O
原子电子式的书写,即在元素符号的周围标上其最外层所带的电荷数,最外层有几个电子,就在元素符号的周围标上几个“ ”或“ + ”)
练习:写出C、F、S、K电子式
阳离子电子式
Na+、Mg2+、Ca2+、H+
阳离子的电子式即为阳离子符号。
阴离子
Cl
Br
O
2-
阴离子的电子除了在元素符号周围标出最外层电子的情况外,还需要用“[ ]”括起来,并且在方括号外注明其所带的电荷数。
练习:写出F-、S2-电子式
离子化合物的电子式
Na
Cl
Mg
2
Br
Br
O
2-
Na
Na
离子化合物的电子式:由阴、阳离子的电子式组成,
但相同离子不能合并。在正确书写阴、阳离子电子
式的前提下,离子化合物中的阴、阳离子要间隔书写,
同时,相同离子对称分布。
练习
写出KF、Na2S电子式
5.2.1 离子键
一、化学键
1.定义:我们把物质中直接相邻的原子或离子之间存在的强的相互作用叫做化学键。
2.分类:化学键分为离子键、共价键。
【问题1】:NaCl的形成过程来分析离子键是如何形成的。在氯化钠的形成过程中,哪种原子得到电子,哪种原子失去电子呢?请大家用原子结构示意图,完成下列表格。
思考
Na+
Cl-
电子转移
一、离子键
失去一个电子
得到一个电子
思考
在氯化钠晶体中,Na+和Cl- 间存在哪些作用力?
正、负电荷之间的静电引力,以及原子核与原子核、核外电子与核外电子之间的静电斥力,当阴、阳离子达到一定距离后,二者达到平衡,因此,离子键的实质就是静电引力与静电斥力达到平衡时的静电作用。
一、离子键
1. 定义:使阴、阳离子结合成化合物的静电作用。
2. 成键微粒:阴、阳离子
3. 相互作用:静电作用(静电引力和静电排斥力)
4. 离子化合物:由离子键形成的化合物叫做离子化合物。
含有离子键的化合物就是离子化合物。
思考
哪些元素的原子能以这种方式结合?这种结合方式与它们的原子结构有什么关系?
练习
请大家判断下列化合物哪些属于离子化合物?
Na2O、SO2、CaCl2、H2O、NH4Cl、HCl、MgSO4、NH3
归纳总结
离子化合物的判断方法依据:
阳离子通常为活泼的金阳离子或铵根离子(NH4+),阴离子通常为活泼的非金属离子或原子团离子(如OH-、SO42-、NO3-等),即判断依据是否含有活泼的金属阳离子或铵根离子(NH4+)
二、电子式
(1)定义在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。
原子电子式
Na
Cl
Mg
Br
O
原子电子式的书写,即在元素符号的周围标上其最外层所带的电荷数,最外层有几个电子,就在元素符号的周围标上几个“ ”或“ + ”)
练习:写出C、F、S、K电子式
阳离子电子式
Na+、Mg2+、Ca2+、H+
阳离子的电子式即为阳离子符号。
阴离子
Cl
Br
O
2-
阴离子的电子除了在元素符号周围标出最外层电子的情况外,还需要用“[ ]”括起来,并且在方括号外注明其所带的电荷数。
练习:写出F-、S2-电子式
离子化合物的电子式
Na
Cl
Mg
2
Br
Br
O
2-
Na
Na
离子化合物的电子式:由阴、阳离子的电子式组成,
但相同离子不能合并。在正确书写阴、阳离子电子
式的前提下,离子化合物中的阴、阳离子要间隔书写,
同时,相同离子对称分布。
练习
写出KF、Na2S电子式
