1.2 离子反应 课件(共19张PPT)人教版(2019)必修第一册
文档属性
| 名称 | 1.2 离子反应 课件(共19张PPT)人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 544.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 19:56:18 | ||
图片预览





文档简介
(共19张PPT)
离 子 反 应
【学习任务二】学习分散系的分类
【课前思考】
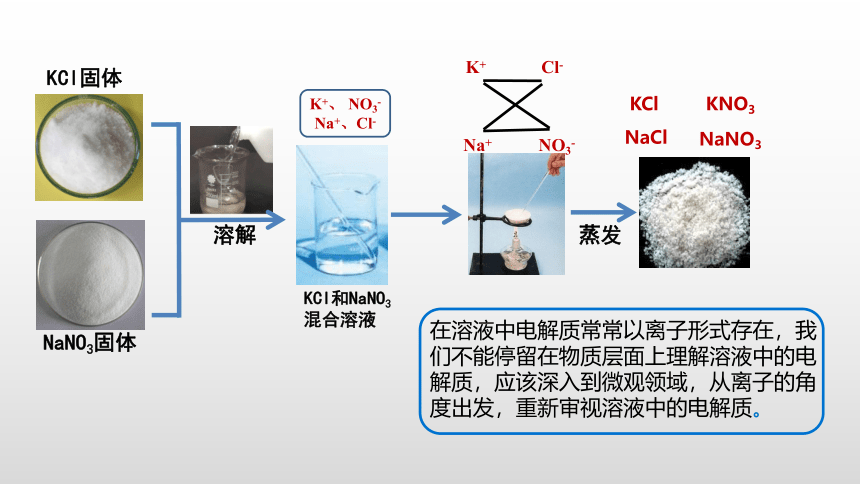
【思考与交流1】将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
任务一 从微观角度认识溶液中的反应
——以CuSO4溶液和BaCl2溶液混合为例
宏观现象 微观分析 CuSO4和BaCl2的 电离方程式 混合前两种溶液中的离子 混合后溶液中离子
CuSO4 + BaCl2 CuCl2 + BaSO4↓
白色沉淀
蓝色溶液
CuSO4 = Cu2+ +
SO4
2-
BaCl2 = Ba2+ + 2Cl-
Cu2+ 、SO42—
Ba2+ 、2Cl-
Cu2+ 、2Cl-
2
4
Ba2+ + SO BaSO4↓
化学用语:
电解质在溶液中的反应实质上是离子之间的反应。
宏观
微观
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
K+ Cl-
Na+ NO3-
KCl
KNO3
NaCl
K+、 NO3-
Na+、Cl-
在溶液中电解质常常以离子形式存在,我们不能停留在物质层面上理解溶液中的电解质,应该深入到微观领域,从离子的角度出发,重新审视溶液中的电解质。
NaNO3
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
一、离子反应
定义:电解质在溶液中的反应实质上是离子之间的反应,在中学阶段仅限于在溶液中进行的反应。
二、离子方程式
1. 用实际参加反应的离子符号来表示反应的式子。
SO42- + Ba2+ = BaSO4↓
离子方程式:
化学方程式:
CuSO4 + BaCl2 CuCl2 + BaSO4↓
CuSO4 + BaCl2 =CuCl2 + BaSO4↓
Cu2++SO4 2 — + Ba2++2Cl—═Cu2+ +2Cl — + BaSO4↓
2. 把易溶于水且易电离的物质(如强酸、强碱和大部分可溶性盐)写成离子形式,难溶的物质、气体和水等仍用化学式表示。
1. 写出反应的化学方程式。
3. 删去方程式两边不参加反应的离子,并将方程式化为最简。
4. 检查离子方程式两边各元素的原子个数和电荷总数是否相等。
拆
练习. 按上面书写步骤写出Na2CO3与Ca(OH)2溶液反应的离子方程式.
任务二 离子方程式的书写
Ba2+ + SO BaSO4↓
2
4
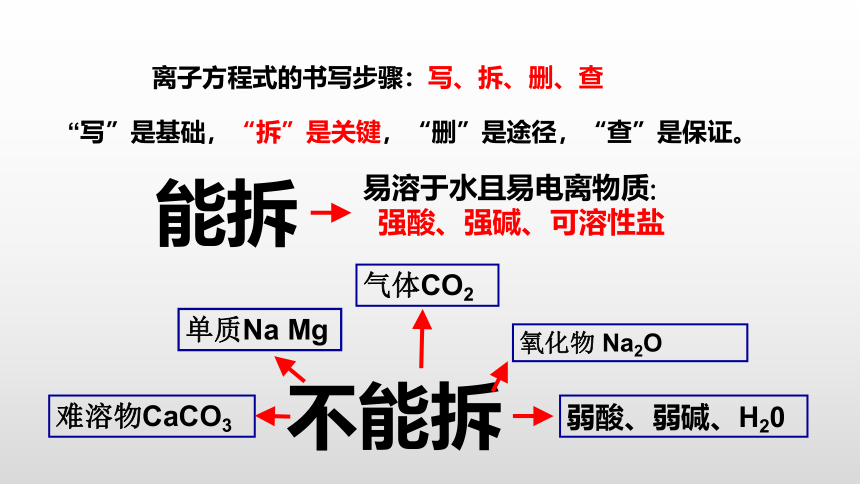
离子方程式的书写步骤:写、拆、删、查
“写”是基础,“拆”是关键,“删”是途径,“查”是保证。
不能拆
单质Na Mg
氧化物 Na2O
难溶物CaCO3
气体CO2
弱酸、弱碱、H20
易溶于水且易电离物质:
强酸、强碱、可溶性盐
能拆
六大强酸:
四大强碱:
H2SO4、HCl、HNO3、HBr、HI、HClO4
NaOH、KOH、Ba(OH)2、Ca(OH)2
钾、钠、铵盐、硝酸盐均可溶于水
盐酸盐不溶氯化银
硫酸盐不溶铅和钡,微溶银和钙
碳酸盐只溶钾、钠、铵盐
亚硫酸盐只溶钾、钠、铵盐
根据离子方程式的书写步骤写出下列反应的离子方程式。
(1)盐酸与氢氧化钠溶液反应;
(2)硫酸与氢氧化钾溶液反应;
(3)硫酸钠溶液与氯化钡溶液反应;
(4)硫酸钾溶液与硝酸钡溶液反应;
离子方程式的意义
H+ + OH — = H2O
H+ + OH— = H2O
SO42— + Ba2+ = BaSO4↓
SO42— + Ba2+ = BaSO4↓
离子方程式不仅可以表示某个具体的反应,还可以表示同一类型的离子反应。
离子方程式:用实际参加反应的离子符号表示离子反应的式子。
任务二 探究稀硫酸和Ba(OH)2溶液反应的实质
活动2 设计实验,验证稀硫酸和Ba(OH)2溶液混合前后微观粒子的变化。
向Ba(OH)2溶液中加入几滴酚酞溶液,然后向Ba(OH)2溶液中滴加稀硫酸,观察现象。
2H+ + + Ba2+ + 2OH- BaSO4↓ + 2H2O
SO4
2-
混合前两种 溶液中的离子 混合时溶液中
离子的变化
Ba2+和 反应生成
BaSO4沉淀
H+和OH-反应生成水
SO4
2-
SO4
2-
稀硫酸:H+和
Ba(OH)2溶液:Ba2+和OH-
H+ + OH — = H2O表示的是:强酸和强碱生成可溶性盐和水的反应。
氯化钙溶液和硝酸钠溶液混合情况:
分析
CaCl2 + 2NaNO3 = Ca(NO3)2 + 2NaCl
Ca2+ + 2Cl- + 2Na+ + 2NO3- = Ca2+ + 2NO3- + 2Na+ + 2Cl-
没有发生离子反应
【总结】酸、碱、盐在水溶液中的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应。
复分解型离子反应的条件就是复分解反应发生的条件,即生成沉淀、放出气体或生成水。
离子反应的本质:_____________________________
反应物的某些离子浓度减小。
三种题型
一、写出下列反应的离子方程式
盐酸与氢氧化钠溶液反应:__________________
二、判断下列方程式正误
①铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
②醋酸(CH3COOH)和烧碱反应:H++OH-= H2O
三、下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、CH3COO—
B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.Na+、Cu2+、Cl-、SO42-
1.碳酸钙固体加入盐酸中
2.锌与盐酸反应
3. 氢氧化钡溶液与硫酸铜溶液混合
4.醋酸溶液与氢氧化钠溶液混合
5.MnO2和浓盐酸共热制取Cl2气体
6.氯化铵溶液与氢氧化钾溶液混合加热
题型一、写出下列反应的离子方程式:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
NaOH+CH3COOH = CH3COONa+H2O
CaCO3 + 2H+ =Ca2++CO2 ↑+H2O
Zn+2H+ =Zn2++H2↑
Ba2++2OH—+Cu2++SO42— = BaSO4↓+Cu(OH)2↓
CH3COOH + OH — = CH3COO- + H2O
MnO2+4H++2Cl— = Mn2++Cl2 ↑+2H2O
△
NH4+ + OH— = NH3 ↑+H2O
△
NH4Cl+KOH KCl+NH3↑+H2O
①铁跟稀硫酸反应:
2Fe+6H+=2Fe3++3H2
②醋酸(CH3COOH)和烧碱反应
OH- +H+= H2O
③碘化钾溶液与适量溴水反应
I-+Br2=I2+Br-
④硫酸与氢氧化钡的反应
H++OH— = H2O
不符合反应事实,并缺↑符号
不符合电荷守恒规律
题型二、判断下列方程式正误
遗漏部分参加反应的离子
化学式的拆分不恰当
不能写化学式
不能写成Cu2+,且两边原子不守恒
离子方程式不符合客观事实
(1)生成难溶物而不能大量共存 如:
Ag+与_ __等;Ba2+与______________等;Ca2+与_______等。
三、离子共存
1.由于发生复分解反应,离子不能大量共存
离子之间不能反应
Cl —
SO42 — 、CO32 —
CO32 —
(2)生成易挥发的物质
常见:H+与 _________________________
(3)生成难电离的物质:
常见:H+与_________________________
如水,弱酸,弱碱
CO32—、HCO3—、SO32—、HSO3—
OH—、CH3COO—、ClO—、HCO3—
OH—与___________
NH4+
NH4+ + OH— = NH3 ↑+H2O
△
1.下列离子能在溶液中大量共存的是( )
A K+,H+,SO42-,CH3COO—,
B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32-
D、Na+、Cu2+、Cl-、SO42-
D
2.在强酸性溶液中能大量共存,并且溶液为
无色透明的是( )
A. NH4+ 、Fe3+ 、SO42- 、NO3-
B. K+ 、Na+ 、SO32- 、NO3-
C. K+ 、NH4+ 、Br- 、SO42-
D. Na+ 、K+ 、NO3- 、F-
C
※注意附加的隐含条件:
①溶液的酸碱性
②有色离子 MnO4- (紫红色)、Fe3+ (黄色)、
Fe2+ (浅绿色)、 Cu2+(蓝色)
【补充】
1.书写NaHSO4与NaOH反应的离子方程式.
2.判断NaHCO3与NaOH溶液能否发生反应?若能反应,请写出相应的离子方程式.
【思考】HCO3—与哪些离子不共存?
谢谢!!
离 子 反 应
【学习任务二】学习分散系的分类
【课前思考】
【思考与交流1】将混合溶液蒸干应该得到氯化钾和硝酸钠的固体?
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
氯化钠、氯化钾、硝酸钠、硝酸钾四种盐混合固体
任务一 从微观角度认识溶液中的反应
——以CuSO4溶液和BaCl2溶液混合为例
宏观现象 微观分析 CuSO4和BaCl2的 电离方程式 混合前两种溶液中的离子 混合后溶液中离子
CuSO4 + BaCl2 CuCl2 + BaSO4↓
白色沉淀
蓝色溶液
CuSO4 = Cu2+ +
SO4
2-
BaCl2 = Ba2+ + 2Cl-
Cu2+ 、SO42—
Ba2+ 、2Cl-
Cu2+ 、2Cl-
2
4
Ba2+ + SO BaSO4↓
化学用语:
电解质在溶液中的反应实质上是离子之间的反应。
宏观
微观
KCl固体
NaNO3固体
溶解
KCl和NaNO3
混合溶液
蒸发
K+ Cl-
Na+ NO3-
KCl
KNO3
NaCl
K+、 NO3-
Na+、Cl-
在溶液中电解质常常以离子形式存在,我们不能停留在物质层面上理解溶液中的电解质,应该深入到微观领域,从离子的角度出发,重新审视溶液中的电解质。
NaNO3
【学习任务二】学习分散系的分类
【学习任务二】离子反应及方程式
一、离子反应
定义:电解质在溶液中的反应实质上是离子之间的反应,在中学阶段仅限于在溶液中进行的反应。
二、离子方程式
1. 用实际参加反应的离子符号来表示反应的式子。
SO42- + Ba2+ = BaSO4↓
离子方程式:
化学方程式:
CuSO4 + BaCl2 CuCl2 + BaSO4↓
CuSO4 + BaCl2 =CuCl2 + BaSO4↓
Cu2++SO4 2 — + Ba2++2Cl—═Cu2+ +2Cl — + BaSO4↓
2. 把易溶于水且易电离的物质(如强酸、强碱和大部分可溶性盐)写成离子形式,难溶的物质、气体和水等仍用化学式表示。
1. 写出反应的化学方程式。
3. 删去方程式两边不参加反应的离子,并将方程式化为最简。
4. 检查离子方程式两边各元素的原子个数和电荷总数是否相等。
拆
练习. 按上面书写步骤写出Na2CO3与Ca(OH)2溶液反应的离子方程式.
任务二 离子方程式的书写
Ba2+ + SO BaSO4↓
2
4
离子方程式的书写步骤:写、拆、删、查
“写”是基础,“拆”是关键,“删”是途径,“查”是保证。
不能拆
单质Na Mg
氧化物 Na2O
难溶物CaCO3
气体CO2
弱酸、弱碱、H20
易溶于水且易电离物质:
强酸、强碱、可溶性盐
能拆
六大强酸:
四大强碱:
H2SO4、HCl、HNO3、HBr、HI、HClO4
NaOH、KOH、Ba(OH)2、Ca(OH)2
钾、钠、铵盐、硝酸盐均可溶于水
盐酸盐不溶氯化银
硫酸盐不溶铅和钡,微溶银和钙
碳酸盐只溶钾、钠、铵盐
亚硫酸盐只溶钾、钠、铵盐
根据离子方程式的书写步骤写出下列反应的离子方程式。
(1)盐酸与氢氧化钠溶液反应;
(2)硫酸与氢氧化钾溶液反应;
(3)硫酸钠溶液与氯化钡溶液反应;
(4)硫酸钾溶液与硝酸钡溶液反应;
离子方程式的意义
H+ + OH — = H2O
H+ + OH— = H2O
SO42— + Ba2+ = BaSO4↓
SO42— + Ba2+ = BaSO4↓
离子方程式不仅可以表示某个具体的反应,还可以表示同一类型的离子反应。
离子方程式:用实际参加反应的离子符号表示离子反应的式子。
任务二 探究稀硫酸和Ba(OH)2溶液反应的实质
活动2 设计实验,验证稀硫酸和Ba(OH)2溶液混合前后微观粒子的变化。
向Ba(OH)2溶液中加入几滴酚酞溶液,然后向Ba(OH)2溶液中滴加稀硫酸,观察现象。
2H+ + + Ba2+ + 2OH- BaSO4↓ + 2H2O
SO4
2-
混合前两种 溶液中的离子 混合时溶液中
离子的变化
Ba2+和 反应生成
BaSO4沉淀
H+和OH-反应生成水
SO4
2-
SO4
2-
稀硫酸:H+和
Ba(OH)2溶液:Ba2+和OH-
H+ + OH — = H2O表示的是:强酸和强碱生成可溶性盐和水的反应。
氯化钙溶液和硝酸钠溶液混合情况:
分析
CaCl2 + 2NaNO3 = Ca(NO3)2 + 2NaCl
Ca2+ + 2Cl- + 2Na+ + 2NO3- = Ca2+ + 2NO3- + 2Na+ + 2Cl-
没有发生离子反应
【总结】酸、碱、盐在水溶液中的复分解反应,实质上是两种电解质在溶液中相互交换离子的反应。
复分解型离子反应的条件就是复分解反应发生的条件,即生成沉淀、放出气体或生成水。
离子反应的本质:_____________________________
反应物的某些离子浓度减小。
三种题型
一、写出下列反应的离子方程式
盐酸与氢氧化钠溶液反应:__________________
二、判断下列方程式正误
①铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
②醋酸(CH3COOH)和烧碱反应:H++OH-= H2O
三、下列各组中的离子,能在溶液中大量共存的是( )
A.K+、H+、SO42-、CH3COO—
B.Na+、Ca2+、CO32-、NO3-
C.Na+、H+、Cl-、CO32-
D.Na+、Cu2+、Cl-、SO42-
1.碳酸钙固体加入盐酸中
2.锌与盐酸反应
3. 氢氧化钡溶液与硫酸铜溶液混合
4.醋酸溶液与氢氧化钠溶液混合
5.MnO2和浓盐酸共热制取Cl2气体
6.氯化铵溶液与氢氧化钾溶液混合加热
题型一、写出下列反应的离子方程式:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
NaOH+CH3COOH = CH3COONa+H2O
CaCO3 + 2H+ =Ca2++CO2 ↑+H2O
Zn+2H+ =Zn2++H2↑
Ba2++2OH—+Cu2++SO42— = BaSO4↓+Cu(OH)2↓
CH3COOH + OH — = CH3COO- + H2O
MnO2+4H++2Cl— = Mn2++Cl2 ↑+2H2O
△
NH4+ + OH— = NH3 ↑+H2O
△
NH4Cl+KOH KCl+NH3↑+H2O
①铁跟稀硫酸反应:
2Fe+6H+=2Fe3++3H2
②醋酸(CH3COOH)和烧碱反应
OH- +H+= H2O
③碘化钾溶液与适量溴水反应
I-+Br2=I2+Br-
④硫酸与氢氧化钡的反应
H++OH— = H2O
不符合反应事实,并缺↑符号
不符合电荷守恒规律
题型二、判断下列方程式正误
遗漏部分参加反应的离子
化学式的拆分不恰当
不能写化学式
不能写成Cu2+,且两边原子不守恒
离子方程式不符合客观事实
(1)生成难溶物而不能大量共存 如:
Ag+与_ __等;Ba2+与______________等;Ca2+与_______等。
三、离子共存
1.由于发生复分解反应,离子不能大量共存
离子之间不能反应
Cl —
SO42 — 、CO32 —
CO32 —
(2)生成易挥发的物质
常见:H+与 _________________________
(3)生成难电离的物质:
常见:H+与_________________________
如水,弱酸,弱碱
CO32—、HCO3—、SO32—、HSO3—
OH—、CH3COO—、ClO—、HCO3—
OH—与___________
NH4+
NH4+ + OH— = NH3 ↑+H2O
△
1.下列离子能在溶液中大量共存的是( )
A K+,H+,SO42-,CH3COO—,
B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32-
D、Na+、Cu2+、Cl-、SO42-
D
2.在强酸性溶液中能大量共存,并且溶液为
无色透明的是( )
A. NH4+ 、Fe3+ 、SO42- 、NO3-
B. K+ 、Na+ 、SO32- 、NO3-
C. K+ 、NH4+ 、Br- 、SO42-
D. Na+ 、K+ 、NO3- 、F-
C
※注意附加的隐含条件:
①溶液的酸碱性
②有色离子 MnO4- (紫红色)、Fe3+ (黄色)、
Fe2+ (浅绿色)、 Cu2+(蓝色)
【补充】
1.书写NaHSO4与NaOH反应的离子方程式.
2.判断NaHCO3与NaOH溶液能否发生反应?若能反应,请写出相应的离子方程式.
【思考】HCO3—与哪些离子不共存?
谢谢!!
