2.3 物质的量 课件(共28张PPT)人教版(2019)必修第一册
文档属性
| 名称 | 2.3 物质的量 课件(共28张PPT)人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-08-28 19:58:22 | ||
图片预览





文档简介
(共28张PPT)
物质的量
-----第一课时
银河系有2000亿颗恒星、星云、星团系
1g干冰中含有13万亿个CO2分子,一秒钟数一个要数1.3万亿年……系
任务一:认识计量微观粒子的物理量
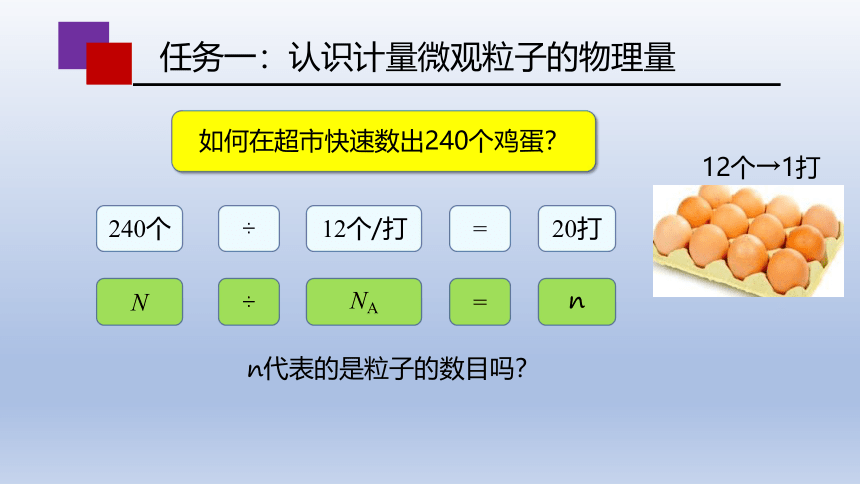
如何在超市快速数出240个鸡蛋?
12个→1打
N
÷
NA
=
n
240个
÷
12个/打
=
20打
n代表的是粒子的数目吗?
任务一:认识计量微观粒子的物理量
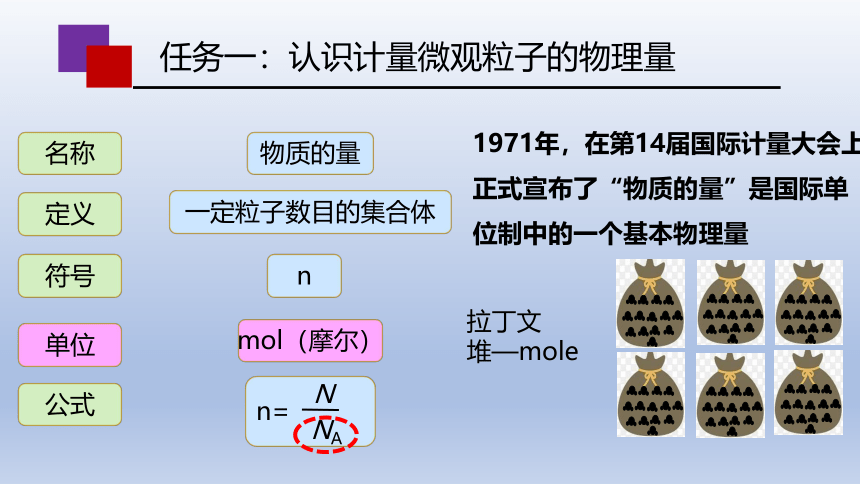
1971年,在第14届国际计量大会上,
正式宣布了“物质的量”是国际单
位制中的一个基本物理量
名称
定义
符号
单位
公式
物质的量
一定粒子数目的集合体
n
n=
N
NA
堆
拉丁文
堆—mole
mol(摩尔)
阿伏伽德罗常数—NA
NA 近似于 6.02×1023 mol-1
名称
定义
符号
单位
公式
阿伏伽德罗常数
单位物质的量粒子的数目
NA
NA=
N
n
mol-1
阿伏伽德罗
意大利物理学家,化学家
1776年出生于意大利都灵市
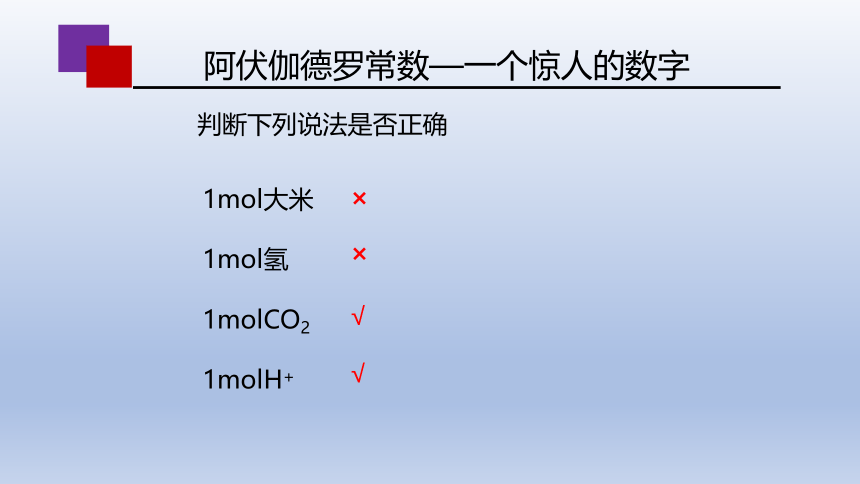
阿伏伽德罗常数—一个惊人的数字
1mol大米
1mol氢
1molCO2
1molH+
判断下列说法是否正确
√
×
√
×
任务二:建立物质的量与微粒数目的关系
1.1mol的H2O中约含有 个水分子
2.0.5molNaOH中含有 个Na+
3.6.02×1023个H2相当于 molH2
4.1.204×1024个NO3-相当于 molNO3-
6.02×1023
3.01×1023
1
2
n=
N
NA
N1
N2
=
n1
n2
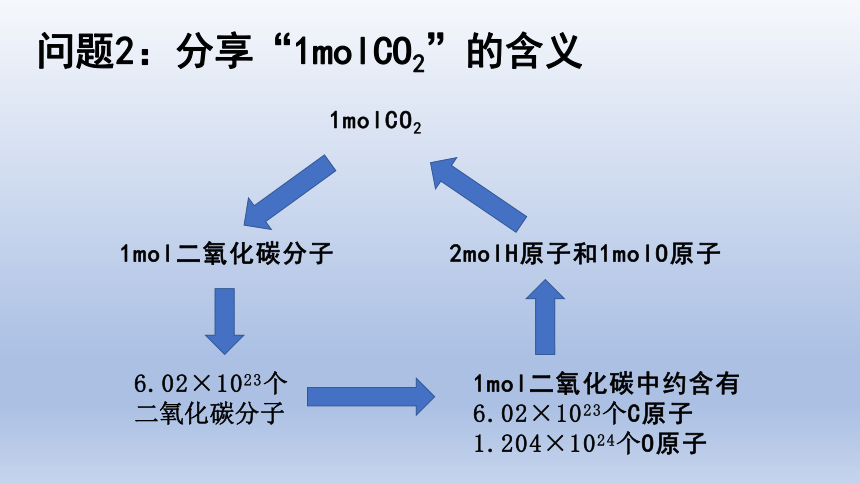
问题2:分享“1molCO2”的含义
1molCO2
1mol二氧化碳分子
6.02×1023个
二氧化碳分子
1mol二氧化碳中约含有
6.02×1023个C原子1.204×1024个O原子
2molH原子和1molO原子
小试一把
1mol O2含有 个O2分子, mol O原子
2molCO2中含有的原子总数约为
NA
2
3.612×1024
6.02×1023
阅读教材,总结规律
序号 物质 相对式量 质量(g) 物质的量
1 Fe 56 1mol
2 Cu 63.5 1mol
3 Al 27 1mol
4 Zn 65 1mol
5 S 32 1mol
6 NaCl 58.5 1mol
7 H2O 18 1mol
8 蔗糖 342 1mol
56
27
32
65
58.5
18
63.5
342
实验室如何量取1mol的干冰
任务三:建立物质的量与质量的关系
任务三:建立物质的量与质量之间的联系
名称
定义
符号
单位
公式
摩尔质量
单位物质的量所具有的质量
M
M=
m
n
g/mol
在质量以g为单位时,
摩尔质量的数值=相对式量
物质 摩尔质量 相对式量 1mol物质所具有的质量 构成 1mol含有的
微粒数目
H2O 18
H2SO4 98
NaOH 40
18g/mol
98g/mol
40g/mol
知识巩固
18g
98g
40g
6.02×1023 or NA
6.02×1023 or NA
6.02×1023 or NA
结论:构成1mol任何物质的微粒数目都是相同的,
但是物质的量相同时,物质的质量通常并不相同
你能否说明1mol的集合体数目定约为6.02×1023 的好处在哪里?
解释原因,总结概念
C + O2
点燃
CO2
NA NA NA
12g 32g 44g
质量
(m)
粒子数
(N)
÷NA
÷NA
÷NA
1mol
1mol
1mol
×12
g/mol
×32
g/mol
×44
g/mol
物质的量
宏观
微观
请尝试画出物质的量,质量,粒子数,
阿伏伽德罗常数,摩尔质量之间的概念关系图
22kg的干冰会升华变成多少个CO2气体分子
22KgCO2
22000gCO2
÷44g/mol
500mol
×NA
500NA
小结
质量,物质的量,粒子数之间的关系
物质的量
n(mol)
质量
m(g)
粒子数
N
×NA(mol-1)
NA(mol-1)÷
M(g.mol-1)×
÷M(g.mol-1)
N
NA
=n=
m
M
宏观
微观
物质的量
问题:与1molCO2含有相同氧原子数的O2的质量是多少
1 molO2
2 molO原子
1.204×1024 O原子
1 molCO2
相同的氧原子数
×32g/mol
32g
6.02×1023 O2
任务四:多水平定量认识物质
学以致用
含有1.204×1024个CO2分子的CO2质量有多少?
1.204×1024个CO2
2molCO2
÷NA
×44g/mol
88g
含2.408×1024个O的CO2 质量为多少?
CO2
~
2.408×1024
÷NA
4molO
含44 NA个电子的二氧化碳质量?
22电子
~
44 NA个电子
÷NA
44mol电子
2O
如何求算单个H2O分子的真实质量?
M
NA
18g
1molH2O
约为6.02×1023
任务一:认识计量微观粒子的物理量
水是一种重要的物质,如何计量?
质量,体积
如何计量一瓶水中含有多少个水分子?
任务一:认识计量微观粒子的物理量
2H2 + O2
点燃
2H2O
如何知道以上的反应过程有多少个H2,O2参与反应,又有多少个H2O生成?
物质的量的单位——摩尔
1打鸡蛋 12只
一包纸巾 15张
1盒曲别针 100个
1mol粒子
?
任务一:认识计量微观粒子的物理量
一袋
一包
一盒
结论
1.越小的物质越要用集合体形式进行计量
2.不同的集合体有不同的固定的数量
任务一:认识计量微观粒子的物理量
一:物质的量的单位-摩尔
物质的量:表示含有一定数目粒子的集合体
符号:n
单位:摩尔(mol),简称“摩”
物质的量的单位——摩尔
阿伏伽德罗
意大利物理学家,化学家
1776年出生于意大利都灵市
任务二:建立物质的量与微粒数目的关系
物质的量
n(mol)
粒子数
N(个)
阿伏伽德罗常数
NA(mol-1)
×NA(mol-1)
NA(mol-1)÷
物质的量与粒子数之间的关系
N
NA
:n=
量取“1molH2O”的质量
1molH2O
1mol水分子
6.02×1023个水分子
1mol水中有
1.204×1024个H原子
6.02×1023个O原子
2molH原子和1molO原子
18g
×18g/mol
摩尔质量
—单位物质的量所具有的质量
符号:M
单位:g/mol 或者 g.mol-1
表达式:M =
m
n
在质量以g为单位时,摩尔质量的数值=相对式量
任务二:建立物质的量与质量的关系
物质的量与质量之间的关系
物质的量
n(mol)
质量
m(g)
× M(g.mol-1)
M(g.mol-1)÷
m
M
:n=
任务二:建立物质的量与质量的关系
物质的量
-----第一课时
银河系有2000亿颗恒星、星云、星团系
1g干冰中含有13万亿个CO2分子,一秒钟数一个要数1.3万亿年……系
任务一:认识计量微观粒子的物理量
如何在超市快速数出240个鸡蛋?
12个→1打
N
÷
NA
=
n
240个
÷
12个/打
=
20打
n代表的是粒子的数目吗?
任务一:认识计量微观粒子的物理量
1971年,在第14届国际计量大会上,
正式宣布了“物质的量”是国际单
位制中的一个基本物理量
名称
定义
符号
单位
公式
物质的量
一定粒子数目的集合体
n
n=
N
NA
堆
拉丁文
堆—mole
mol(摩尔)
阿伏伽德罗常数—NA
NA 近似于 6.02×1023 mol-1
名称
定义
符号
单位
公式
阿伏伽德罗常数
单位物质的量粒子的数目
NA
NA=
N
n
mol-1
阿伏伽德罗
意大利物理学家,化学家
1776年出生于意大利都灵市
阿伏伽德罗常数—一个惊人的数字
1mol大米
1mol氢
1molCO2
1molH+
判断下列说法是否正确
√
×
√
×
任务二:建立物质的量与微粒数目的关系
1.1mol的H2O中约含有 个水分子
2.0.5molNaOH中含有 个Na+
3.6.02×1023个H2相当于 molH2
4.1.204×1024个NO3-相当于 molNO3-
6.02×1023
3.01×1023
1
2
n=
N
NA
N1
N2
=
n1
n2
问题2:分享“1molCO2”的含义
1molCO2
1mol二氧化碳分子
6.02×1023个
二氧化碳分子
1mol二氧化碳中约含有
6.02×1023个C原子1.204×1024个O原子
2molH原子和1molO原子
小试一把
1mol O2含有 个O2分子, mol O原子
2molCO2中含有的原子总数约为
NA
2
3.612×1024
6.02×1023
阅读教材,总结规律
序号 物质 相对式量 质量(g) 物质的量
1 Fe 56 1mol
2 Cu 63.5 1mol
3 Al 27 1mol
4 Zn 65 1mol
5 S 32 1mol
6 NaCl 58.5 1mol
7 H2O 18 1mol
8 蔗糖 342 1mol
56
27
32
65
58.5
18
63.5
342
实验室如何量取1mol的干冰
任务三:建立物质的量与质量的关系
任务三:建立物质的量与质量之间的联系
名称
定义
符号
单位
公式
摩尔质量
单位物质的量所具有的质量
M
M=
m
n
g/mol
在质量以g为单位时,
摩尔质量的数值=相对式量
物质 摩尔质量 相对式量 1mol物质所具有的质量 构成 1mol含有的
微粒数目
H2O 18
H2SO4 98
NaOH 40
18g/mol
98g/mol
40g/mol
知识巩固
18g
98g
40g
6.02×1023 or NA
6.02×1023 or NA
6.02×1023 or NA
结论:构成1mol任何物质的微粒数目都是相同的,
但是物质的量相同时,物质的质量通常并不相同
你能否说明1mol的集合体数目定约为6.02×1023 的好处在哪里?
解释原因,总结概念
C + O2
点燃
CO2
NA NA NA
12g 32g 44g
质量
(m)
粒子数
(N)
÷NA
÷NA
÷NA
1mol
1mol
1mol
×12
g/mol
×32
g/mol
×44
g/mol
物质的量
宏观
微观
请尝试画出物质的量,质量,粒子数,
阿伏伽德罗常数,摩尔质量之间的概念关系图
22kg的干冰会升华变成多少个CO2气体分子
22KgCO2
22000gCO2
÷44g/mol
500mol
×NA
500NA
小结
质量,物质的量,粒子数之间的关系
物质的量
n(mol)
质量
m(g)
粒子数
N
×NA(mol-1)
NA(mol-1)÷
M(g.mol-1)×
÷M(g.mol-1)
N
NA
=n=
m
M
宏观
微观
物质的量
问题:与1molCO2含有相同氧原子数的O2的质量是多少
1 molO2
2 molO原子
1.204×1024 O原子
1 molCO2
相同的氧原子数
×32g/mol
32g
6.02×1023 O2
任务四:多水平定量认识物质
学以致用
含有1.204×1024个CO2分子的CO2质量有多少?
1.204×1024个CO2
2molCO2
÷NA
×44g/mol
88g
含2.408×1024个O的CO2 质量为多少?
CO2
~
2.408×1024
÷NA
4molO
含44 NA个电子的二氧化碳质量?
22电子
~
44 NA个电子
÷NA
44mol电子
2O
如何求算单个H2O分子的真实质量?
M
NA
18g
1molH2O
约为6.02×1023
任务一:认识计量微观粒子的物理量
水是一种重要的物质,如何计量?
质量,体积
如何计量一瓶水中含有多少个水分子?
任务一:认识计量微观粒子的物理量
2H2 + O2
点燃
2H2O
如何知道以上的反应过程有多少个H2,O2参与反应,又有多少个H2O生成?
物质的量的单位——摩尔
1打鸡蛋 12只
一包纸巾 15张
1盒曲别针 100个
1mol粒子
?
任务一:认识计量微观粒子的物理量
一袋
一包
一盒
结论
1.越小的物质越要用集合体形式进行计量
2.不同的集合体有不同的固定的数量
任务一:认识计量微观粒子的物理量
一:物质的量的单位-摩尔
物质的量:表示含有一定数目粒子的集合体
符号:n
单位:摩尔(mol),简称“摩”
物质的量的单位——摩尔
阿伏伽德罗
意大利物理学家,化学家
1776年出生于意大利都灵市
任务二:建立物质的量与微粒数目的关系
物质的量
n(mol)
粒子数
N(个)
阿伏伽德罗常数
NA(mol-1)
×NA(mol-1)
NA(mol-1)÷
物质的量与粒子数之间的关系
N
NA
:n=
量取“1molH2O”的质量
1molH2O
1mol水分子
6.02×1023个水分子
1mol水中有
1.204×1024个H原子
6.02×1023个O原子
2molH原子和1molO原子
18g
×18g/mol
摩尔质量
—单位物质的量所具有的质量
符号:M
单位:g/mol 或者 g.mol-1
表达式:M =
m
n
在质量以g为单位时,摩尔质量的数值=相对式量
任务二:建立物质的量与质量的关系
物质的量与质量之间的关系
物质的量
n(mol)
质量
m(g)
× M(g.mol-1)
M(g.mol-1)÷
m
M
:n=
任务二:建立物质的量与质量的关系
